Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Фотосинтез
Краткое содержание главы
В световых реакциях фотосинтеза у зеленых растений поглощенная световая энергия создает поток электронов, направленный от Н2O к NADP+, который при этом восстанавливается в NADPH; одновременно выделяется кислород, входивший ранее в состав воды. Вторым продуктом световых реакций является АТР. В темновых реакциях АТР и NADPH используются для восстановления СO2, приводящего к образованию глюкозы. В клетках зеленых растений фотосинтез протекает в хлоропластах. Световые реакции происходят в тилакоидах - уплощенных мембранных пузырьках, находящихся внутри хлоропластов. В фотосинтезирующих растительных клетках присутствуют светопоглощающие пигменты двух главных типов - хлорофиллы и каротиноиды, объединенные в два вида фотосистем. В каждой фотосистеме имеется набор светособирающих, или антенных, пигментов и реакционный центр, использующий световую энергию для передачи электронов в цепь электронных переносчиков. Фотосистема I возбуждается более длинноволновым светом; при ее участии электроны восстанавливают NADP+ в NADPH. Фотосистема II активируется более коротковолновым светом; она ответственна за отщепление электронов от Н2O и выделение кислорода. Возбуждение фотосистемы I приводит к восстановлению NADP+ через ферредоксин и ферредоксин-NADP-оксидоредуктазу. Электроны для заполнения дырок в фотосистеме I поступают от возбужденной фотосистемы И. Они переносятся по цепи переноса электронов, соединяющей фотосистемы II и I, с которой сопряжено фотосинтетическое фосфорилирование. Электроны, необходимые для заполнения дырок в фотосистеме II, обладающей высокой окислительной способностью, поступают от Н2O. Источником энергии для синтеза АТР служит трансмембранный Н+-градиент, создаваемый потоком электронов, направленным «вниз». Для того чтобы обеспечить выделение одной молекулы кислорода и образование двух молекул NADPH и двух молекул АТР, требуется восемь квантов света.
В темновых реакциях происходит фиксация СO2, приводящая к образованию углеродного скелета глюкозы. Фиксация осуществляется посредством реакции СO2 с рибулозо-1,5-дифосфатом, продуктами которой являются две молекулы 3-фосфоглицерата. 3-фосфоглицерат превращается в глюкозу через цикл Кальвина, причем на каждую синтезированную молекулу глюкозы расходуются 18 молекул АТР и 12 молекул NADPH, образовавшихся в световых реакциях. Цикл Кальвина состоит из взаимосвязанных реакций пентозофосфатного и гликолитического путей. У С4-растений СO2 фиксируется сначала в клетках мезофилла с образованием малата, переходящего затем в клетки обкладки. Здесь СO2 вновь высвобождается, и ее концентрация оказывается достаточно высокой, чтобы могла произойти реакция, катализируемая рибулозодифосфат-карбоксилазой. После этой реакции весь процесс идет уже по С3-пути. У С3-растений часть добытой в процессе фотосинтеза энергии теряется в результате фотодыхания. Субстратом для фотодыхания служит гликолат - продукт оксигенирования рибулозо-1,5-дифосфата.
Бактериородопсин, содержащийся в клеточной мембране галофильных бактерий, при освещении перекачивает ионы Н+ из клетки в окружающую среду. Возникающий вследствие этого трансмембранный Н+-градиент используется клетками для синтеза АТР.
ЛИТЕРАТУРА
Свет
Hendricks S. В. How Light Interacts with Living Matter, Sci. Am., 219, 174-186, September 1968.
Фотореакции
Govindjee and Govindjee R. The Primary Events in Photosynthesis, Sci. Am., 231, 8-82, December 1974.
Фотосинтетический перенос электронов и фосфорилирование
Blankenship R.E., Parson W. W. The Photochemical Electron Transfer Reactions of Photosynthetic Bacteria and Plants, Annu. Rev. Biochem., 44, 635-653 (1978).
Hinkle P. C., McCarty R. E. How Cells Make ATP, Sci. Am., 238, 104-123 (1978).
Miller K. R. The Photosynthetic Membrane, Sci. Am., 241, 102-113, October 1979.
Путь углерода
Bassham J. A The Path of Carbon in Photosynthesis, Sci. Am., 206, 88-100, June 1962.
Zelitch I. Pathways of Carbon Fixation in Green Plants, Annu. Rev. Biochem., 44, 123-145 (1975).
Фотодыхание
Bjorkman O., Berry J. High-Efficiency Photosynthesis, Sci. Am., 229, 80-93, October 1973.
Osmond С. B. Photorespiration and Photoinhibition. Implications for the Bioenergetics of Photosynthesis, Biochem, Biophys. Acta, 639, 77-156 (1981).
Бактериородопсин
Sinqh K., Caplan S. R. The Purple Membrane and Solar Energy Conversion, Trends Biochem. Sсi., 5, 62-64, March 1980.
Stoeckenius W. The Purple Membrane of Salt-Loving Bacteria, Sсi. Am., 234, 38-46 (1976).
Книги
Govindjee (ed.). Bioenergetics of Photosynthesis, Academic, New York, 1975.
Greqory R. P. F. The Biochemistry of Photosynthesis, 2d ed., Wiley, New York, 1977.
Slumpf P. K., Conn E. E. (eds.). The Biochemistry of Plants, 8 vols., Academic, New York, 1980-1981. Tom 8 посвящен фотосинтезу.
Вопросы и задачи
1. Фазы фотосинтеза. Если суспензию зеленых водорослей сначала освещать в отсутствие двуокиси углерода, а затем инкубировать с 14СО2 в темноте, то в течение короткого промежутка времени наблюдается превращение 14СО2 в 14С-глюкозу. Что нам говорит это наблюдение о двух фазах фотосинтеза? Почему превращение 14СО2 в 14С-глюкозу быстро прекращается?
2. Фотохимическая эффективность света с различной длиной волны. При освещении зеленого растения светом с длиной волны 680 или 700 нм скорость фотосинтеза, измеряемая по выделению О2, в первом случае оказывается выше. Однако освещение растения светом с той и другой длиной волны одновременно обеспечивает более высокую скорость фотосинтеза, чем освещение каждым светом в отдельности. Объясните причину этого.
3. Роль H2S у некоторых фотосинтезирующих бактерий. У пурпурных серных бактерий при освещении может идти фотосинтез в присутствии Н2О и 14СО2, но только в том случае, если имеется H2S, а кислород отсутствует. В ходе фотосинтеза (скорость которого измеряется по образованию 14С-глюкозы) H2S превращается в элементарную серу, а кислород не выделяется. Какую роль играет превращение H2S в элементарную серу? Почему не выделяется кислород?
4. Увеличение восстановительной силы фотосистемы I в результате поглощения света. Когда фотосистема I поглощает красный свет с длиной волны 700 нм, восстановительный потенциал Р700 изменяется от +0,4 до -0,6 В. Какая доля поглощенного света улавливается в форме восстановительной силы?
5. Механизм действия гербицида диурона. Если обработать хлоропласты таким мощным гербицидом, как диурон [3-(3.4-дихлорфенил)-1,1-диметилмочевина], то выделение кислорода и фотофосфорилирование прекращаются. Выделение кислорода (но не фотофосфорилирование) можно восстановить, добавив какой-нибудь внешний акцептор электронов, например реагент Хилла. Как действует этот гербицид, когда он убивает сорняки? В какой точке схемы, изображенной на рис. 23-12, может сказываться, по вашему мнению, его ингибирующее действие? Дайте аргументированный ответ.
6. Биоэнергетика фотофосфорилирования. Стационарные концентрации ATP, ADP и Рі в изолированных хлоропластах шпината при полном освещении и pH 7 равны соответственно 120, 6 и 700 мкМ.
а) Сколько требуется свободной энергии для синтеза 1 моля АТР при этих условиях?
б) Энергию для синтеза АТР поставляет перенос электронов в хлоропластах, индуцированный светом. При какой минимальной разности потенциалов должен происходить перенос пары электронов в этих условиях для обеспечения синтеза АТР?
7. Идентификация ключевых промежуточных продуктов в темновых реакциях фотосинтеза. Кальвин с сотрудниками использовали при изучении темновых реакций фотосинтеза одноклеточную зеленую водоросль Chlorella. В своих экспериментах эти исследователи инкубировали освещаемые суспензии водорослей с 14СО2 при различных условиях, а затем прослеживали динамику появления 14С в двух продуктах, X и Y, в зависимости от условий опыта.
а) Клетки Chlorella выращивались на свету в присутствии немеченой СО2; затем свет выключали и добавляли 14СО2. В этих условиях 14С обнаруживался у водорослей прежде всего в продукте X. Продукт Y оставался немеченым.
Задача 7а
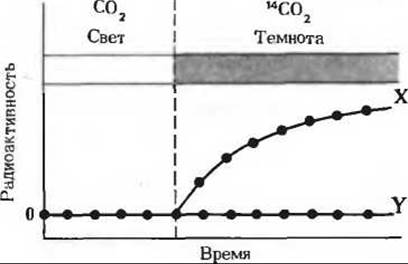
б) Клетки Chlorella выращивались на свету в присутствии 14СО2. Свет выключали по исчерпании всей СО2 (прерывистая вертикальная линия). В этих условиях продукт X быстро включал метку, но затем ее утрачивал. Радиоактивность продукта Y со временем, напротив, возрастала. Основываясь на знании цикла Кальвина, назовите соединения, о которых идет здесь речь.
Задача 7б
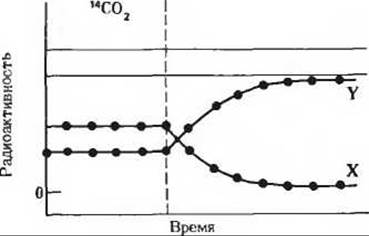
8. Регуляция рибулозо-1,5-дифосфат—карбоксилазы путем изменения pH. У рибулозо-1,5-дифосфат—карбоксилазы величина КМ для СО2 с повышением pH среды заметно снижается. Как сказывается это снижение на скорости фиксации СО2 в рибулозодифосфаткарбоксилазной реакции? Как может растение использовать это свойство для регуляции скорости фотосинтеза при освещении? Какую роль играет эта регуляция в растении в темное время суток?
9. Путь фиксации СО2 у кукурузы. Если освещать растение кукурузы в присутствии газообразной 14СО2, то уже примерно через 1 с свыше 90% всей радиоактивности, включенной в листьях, обнаруживается в С-4 малата, аспартата и оксалоацетата. В С-1 3-фосфоглицерата 14С появляется лишь по истечении 60 с. Объясните эти результаты.
10. Химизм малатдегидрогеназы: вариации одной темы. Малатдегидрогеназа, содержащаяся в клетках обкладки С4-растений, катализирует реакцию, для которой можно указать аналогичную реакцию в цикле лимонной кислоты. Назовите эту аналогичную реакцию. Объясните, в чем заключается аналогия.
11. Отсутствие фотосистемы II в клетках мезофилла. У тропических злаков в клетках мезофилла имеется только фотосистема I, а фотосистема II отсутствует. У тех же растений в клетках обкладки имеются обе фотосистемы, I и II. Согласуется ли это обстоятельство с той ролью, которую играет у этих растений путь Хэтча-Слэка? Дайте полный ответ.
12. Эксперименты по реконструкции: АТР- синтезирующие пузырьки. В. Стокениус и Э. Рэкер сообщили об интересных экспериментах по реконструкции. В этих экспериментах использовались инвертированные синтетические фосфолипидные пузырьки, содержавшие молекулы бактериородопсина из Halobacterium halobium и F0F1-АТРазу из митохондрий бычьего сердца. При освещении эти пузырьки синтезировали АТР из ADP и Рі. Однако если их освещали в присутствии динитрофенола, то образования АТР не происходило. Объясните эти результаты исходя из хемиосмотической гипотезы.
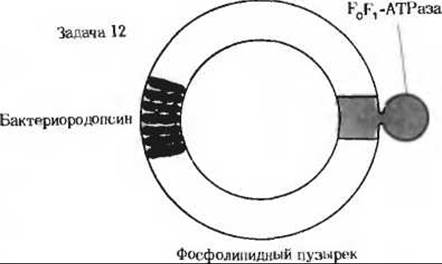
Приложение
Ответы
Глава 13
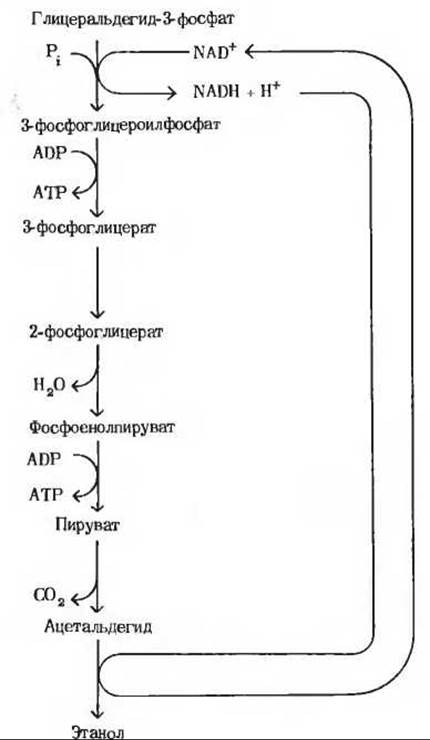
1. а) Глицеральдегид-3-фосфат + Pi +
+ NAD+ → 3-фосфоглицероилфосфат + NADH + Н+.
3-фосфоглицероилфосфат + ADP → 3-фосфоглицерат + АТР.
3-фосфоглицерат → 2-фосфоглицерат.
2-фосфоглицерат → Фосфоенолпируват + H2O.
Фосфоенолпируват + ADP → Пируват + АТР.
Пируват → СO2 + Ацетальдегид.
Ацетальдегид NADH + Н+ → Этанол + NAD+.
б) Глицеральдегид-3-фосфат + Рi +
+ 2ADP → Этанол + СO2 + 2АТР + Н2O.
в)
2. а) Оксалат + Формил-СоА → Формиат + Оксалил-СоА.
Оксалил-СоА + Н+→ СO2 + Формил-СоА.
Формиат + NAD+→ СO2 + NADH.
6) Оксалат + Н+ + NAD+→ 2СO2 + NADH.
3. 14С-глюкоза распадается на более мелкие фрагменты, которые татем используются в биосинтезе гистидина. Немеченый гистидин действует как ингибитор по обратной связи, блокируя путь, по которому происходит синтез гистидина.
4. а) Уровнем ß-галактозидазы; б) из-за того, что число оборотов фермента не изменяется; в) процесс индукции обладает высокой специфичностью.
5. а) Глюкоза + 2АТР → Фруктозо-1,6-дифосфат + 2ADP.
б) Фруктозо-1,6-дифосфат + 2Н2O → Глюкоза + 2Pi.
в) Различия состоят в том, что при катаболическом пути потребляются две молекулы АТР, а при анаболическом пути - две молекулы воды. Таким образом, эти два пути нельзя представить как обращение одного и того же ряда реакций.
г) Обращению процесса препятствуют два термодинамически выгодных переноса фосфата от АТР к глюкозе.
д) Превращение глюкозы в глюкозо-6-фосфат и обратно в этих двух путях метаболизма не может катализироваться одним и тем же ферментом, так как при этом протекают разные процессы, что видно из суммарной записи реакции. Вместе с тем взаимопревращение глюкозо-6-фосфата и фруктозо-6-фосфата осуществляется одним и тем же ферментом.
6. а) 5∙10-4 М; б) 9∙106 имп/мин.
7. 1,1∙10-4 М.
Глава 14
1. а) -1,13 ккал/моль; б) +1,80 ккал/моль;
в) -3,27 ккал/моль.
2. а) 267 М; б) 622 М; в) 0,28.
3. 9,7.
4. а) 3,75∙10-3 М-1; 8,64∙10-8М; нет; б) 13,9 М; нет; в) ∆G0' = -4,0 ккал/моль; K'eq = 873; концентрация глюкозы 1,12 х 10-7 М; да; г) нет. д) При прямом переносе фосфатной группы от АТР к глюкозе энергетический потенциал АТР позволяет протекать реакции без образования в высоких концентрациях промежуточных соединений. Сущность такого переноса, конечно, составляет ферментативный катализ.
5. а) -3,0 ккал; б) -3,5 ккал.
6. -2,4 ккал.
7. 11,0 ккал/моль.
8. а) 11,0 ккал/моль; б) 46 кг; 68%; в) АТР синтезируется по мере необходимости и его концентрация поддерживается на постоянном уровне.
9. а) 1,1 с; б) Креатинфосфат + ADP → Креатин + АТР.
в) Синтез АТР в процессе катаболизма глюкозы, аминокислот и жирных кислот.
10. а) + 0,2 ккал/моль. б) Пирофосфатаза катализирует гидролиз пирофосфата и сдвигает суммарную реакцию в сторону синтеза анетил-СоА.
Глава 15
1. Глюкоза+ 2АТР → 2-глицеральдегид-3-фосфат + ADP + 2Н+; ∆С0' = +0,56 ккал/моль.
2. Глицеральлегид-3-фосфат + 2ADP +
+ 2Рi + Н +→ Лактат + 2АТР + Н2O;
∆G0' = -15,0 ккал/моль.
3. Фруктоза + 2ADP + 2Рi = 2Лактат + 2АТР+ + 2Н2O.
4. а) 14СН3—СН2—ОН; б) 3-14С-глюкоза или 4-14С-глюкоза.
5. Величина КM гексокиназы (0,1 мМ) в 100 раз ниже, чем КM глюкокиназы (10,0 мМ). При нормальной концентрации глюкозы в крови (5 мМ) гексокиназа полностью связана с глюкозой и работает с максимальной эффективностью, тогда как глюкокиназа насыщена лишь частично. Пока потребность мышц в глюкозо-6-фосфате невелика (например, в отсутствие усиленной физической работы), повышенная концентрация глюкозо-6-фосфата приводит к выключению гексокиназы, Таким образом, утилизация глюкозы мышцами имеет место даже в случае, когда уровень глюкозы в крови ниже нормы, но не происходит при малой потребности в глюкозо-6-фосфате. В отличие от гексокиназы глюкокиназа не ингибируется глюкозо-6-фосфатом; это важное свойство обеспечивает утилизацию глюкозы печенью, даже когда потребность в глюкозо-6-фосфате минимальна (например, при биосинтезе гликогена). Когда уровень глюкозы в крови нормализуется, глюкокиназа перестает работать и утилизация глюкозы печенью прекращается.
6. Нет; лактатдегидрогеназа необходима для регенерации NAD+ из NADH, образующегося при окислении глицеральдегид-3-фосфата.
7. а) Продуктом будет 3-фосфоглицерат. б) В присутствии арсената при анаэробных условиях не накапливается АТР.
8. а) Согласно стехиометрии спиртового брожения. на моль глюкозы требуется 2 моля Рi. б) Восстановление ацетальдегида до этанола необходимо для регенерации NAD+ из NADH. При брожении фруктозо-1,6-дифосфат накапливается, чтобы восстановить запас аденозинфосфатов. в) В присутствии арсената не происходит накопления АТР.
9. Глицерол + 2NAD+ + ADP + Рi→ Пируват + 2NADH + АТР + 2Н+.
10. a) Q = 0,029; б) К'eq = 316; в) В физиологических условиях реакция не находится в равновесии; фосфофруктокиназа регулируется.
11. а) Существуют два участка связывания АТР; каталитический и регуляторный. б) Интенсивность гликолиза снижается при избытке АТР. в) График свидетельствует о том, что при добавлении ADP снимается ингибирование, вызываемое АТР. Поскольку пул аденозинфосфатов относительно постоянен, расход АТР приводит к повышению уровня ADP. Имеются данные, свидетельствующие о том, что активность фосфофруктокиназы регулируется соотношением АТР и ADP.
12. а) Гликоген-фосфорилаза катализирует превращение запасенного гликогена в глюкозо-1-фосфат. Глюкозо-1-фосфат служит предшественником глюкозо-6-фосфата - промежуточного продукта гликолиза. При усиленной работе скелетным мышцам требуются большие количества глюкозо-6-фосфата. Вместе с тем в печени расход гликогена используется для поддержания постоянного уровня глюкозы в крови в промежутках между приемами пищи, б) В активно работающих мышцах, где очень высока потребность в АТР, необходимо, чтобы глюкозо-1-фосфат образовывался быстро - для этого нужна большая Vmах.
13. Случай А: (е), (3); случай Б: (в), (3); случай В; (а), (4); случай Г; (г), (6).
14. При недостаточности галактокиназы накапливается галактоза. При недостаточности галактозо-1-фосфат-уридилил-трансферазы накапливается галактозо-1-фосфат. Последний более токсичен.
Глава 16
1. а) Цитрат-синтаза:
Ацетил-СоА + Оксалоацетат + Н2O →
→ Цитрат + CoA-SH + Н+.
Аконитаза: Цитрат → Изоцитрат.
Изоцитратдегидрогеназа:
Изоцитрат + NAD+→ а-Кетоглутарат + СO2 + NADH.
а-Кетоглутаратдегидрогеназа:
а-Кетоглутарат + NAD+ + CoA-SH →
→ Сукцинил-СоА + СO2 + NADH.
Сукцинил-СоА-синтетаза:
Сукцинил-СоА + Рi + GDP → Сукцинат + GTP + CoA-SH.
Сукцинатдегидрогеназа:
Сукцинат + FAD → Фумарат + FADH2.
Фумараза: Фумарат + Н2O → Малат. Малатдегидрогеназа:
Малат + NAD+→ Оксалоацетат + NADH + H+.
б) и в) Этап 1: СоА, конденсация; этап 2: изомеризация; этап 3: NAD+, окисление, декарбоксилирование; этап 4: NAD+, СоА, тиаминпирофосфат, окисление, декарбоксилирование; этап 5: СоА, фосфорилирование; этап 6: FAD, окисление; этап 7; гидратация; этап 8: NAD+, окисление,
г) Ацетил-СоА + 3NAD+ + FAD + GDP +
+ Рi + 2H2O → 2СO2 + 3NADH + FADH2+ + GTP + 2Н+ + СоА.
2. а) Окисление; Метанол→Формальдегид + Н—Н.
б) Окисление; Формальдегид → Муравьиная кислота + Н—Н.
в) Восстановление; СO2 + Н—Н → Муравьиная кислота.
г) Восстановление; Глицериновая кислота + Н—Н → Глицеральдегид.
д) Окисление; Глицерол → Дигидроксиацетон + Н—Н.
е) Окисление; 2Н2O + Толуол → Бензойная кислота + 3Н—Н.
ж) Окисление; Сукцинат → Фумарат + Н—Н.
з) Окисление; Пиро виноградная кислота + Н2O → Уксусная кислота + Н—Н + СO2.
3 а) Этанол + NAD+→ Ацетальдегид + NADH + Н+.
б) 3-фосфоглицероилфосфат + NADH + Н+ → Глицеральдегид-3-фосфат + NAD+ + НРО2-4.
в) Пируват + Н+→ Ацетальдегид + СО2.
г) Пируват + NAD+→ Ацетат + NADH + Н+ + CO2.
д) Оксалоацетат + NADH + Н+→ Малат + NAD+.
е) Ацетоацетат + Н+→ Ацетон + СO2.
4. а) Потребление кислорода служит мерой активности двух первых этапов клеточного дыхания - гликолиза и цикла лимонной кислоты. Добавление оксалоацетата или малата стимулирует цикл лимонной кислоты и тем самым стимулирует дыхание. б) Добавленный оксалоацетат (или малат) выполняет в цикле лимонной кислоты роль катализатора, поскольку на последнем этапе цикла он образуется вновь.
5. а) 6,0∙10-6; б) 1,2∙10-8 М; в) 30 молекул.
6. а)-ООССН2СН2СОО- (сукцинат), б) Малонат служит конкурентным ингибитором сукцинатдегидрогеназы. в) Блокировка цикла лимонной кислоты прерывает образование NADH, что в свою очередь останавливает транспорт электронов. В результате такой остановки прекращается дыхание. г) Добавлением сукцината в большом избытке.
7. а) Добавьте равномерно меченную 14С-глюкозу и последите за выделением 14СO2.
б) Поровну распределится между положениями 2 и 3 в оксалоацетате. в) Бесконечно много.
8. а) Положение 1; б) положение 3; в) положение 3; г) входит в состав метальной группы; д) поровну распределится между —СН2-группами; е) положение 4; ж) поровну распределится между положениями 2 и 3.
9. Нет; карбоксилированием пирувата.
10. а) На стадии действия аконитазы путем ее ингибирования, б) Фторцитрат; конкурирует с цитратом; большим избытком цитрата, в) Цитрат и фторцитрат- ингибиторы фосфофруктокиназы. г) Катаболические процессы, ведущие к образованию АТР полностью подавлены.
11. 2пируват + ATP + 2NAD+ + Н2O → а-кетоглутарат + СO2 + ADP + Рi + 2NADH + 3Н+.
12. 2Ацетил-СоА + 2NAD+ + FAD + Н2O → Оксалоацетат + 2СоА + 2NADH + 4Н+ +FADH2.
13. Отношение начальной скорости образования 14С02 из 1-14С-глюкозы к начальной скорости образования СO2 из 6-14С- глюкозы должно быть 2/1.
Глава 17
1. 1): а) и г) NADH; б) и д) Е—FMN;
в) NADH/NAD+ и Е—FMNH2/E—FMN.
2): а) и г) Е—FMNH2; б) и д) Fe3+; в) Е—FMNH2/E—FMN и Fe2+/Fe3+.
3): а) и г) Fe2+; б) и д) Q; в) Fe2+/Fe3 + и Q/QH2.
2. a) NAD+/NADH; б) Пируват/Лактат; в) в направлении образования лактата; г) -6,0 ккал; д) 1,6∙104.
3. Ферредоксин-фосстанавливающии субстрат → ферредоксин → цитохром b6 → цитохром f → пластоцианин; на первом и последнем этапах.
4. а) 39; б) 12; в) 20; г) 76.
5. а) 1,14 В; б) -52,6 ккал; в) ~7.
6. Окисление сукцината с помощью FAD характеризуется отрицательной величиной изменения стандартной свободной энергии (∆G0'= -0,9 ккал), тогда как окисление с помощью NAD+. характеризуется соответствующей положительной величиной (∆G0' = 16,1 ккал).
7. а) Цианид блокирует восстановление кислорода, катализируемое цитохромом аа3.
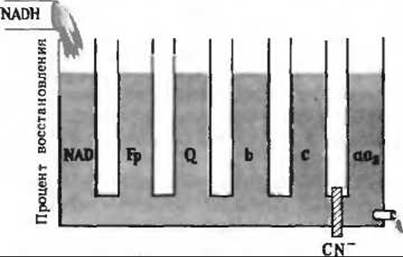
б) В отсутствие кислорода восстановленные переносчики электронов повторно не окисляются.
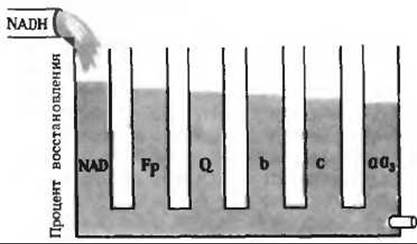
в) В отсутствие NADH не все переносчики электронов окисляются кислородом.
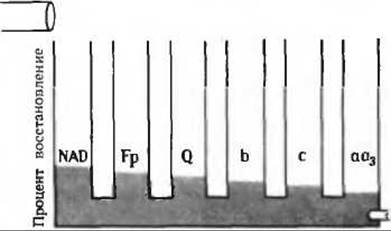
г) См. рис. 17-14, А.
8. а) Ингибирование NADH-дегидрогеназы ротеноном снижает скорость транспорта электронов, что в свою очередь уменьшает скорость образования АТР. Если уменьшенная скорость образования АТР не способна удовлетворить потребности организма, то животное погибает, б) Антимицин А сильно ингибирует окисление убихинола в цепи транспорта электронов. Это снижает скорость транспорта электронов и приводит к последствиям, описанным в п. а), в) Антимицин.
9. а) В присутствии разобщающего агента интенсивность транспорта электронов, необходимого для удовлетворения потребности в АТР, уменьшается, причем с ростом концентрации агента уменьшение становится более резким и отношение Р/О стремится к нулю, б) Отношение Р/О уменьшается, в) В присутствии разобщающего агента требуются более высокие скорости окисления клеточного топлива Если отношение Р/О становится слишком малым, количество синтезируемого при этом АТР не достаточно для поддержания жизни. г) Он может действовать как разобщающий агент.
10. а) Подавляется образование АТР. б) Образование АТР тесно сопряжено с транспортом электронов; 2,4-динитрофенол-разобщитель окислительного фосфорилирования. в) Олигомицин.
11. в) Олигомицин ингибирует оба процесса; атрактилозид не влияет на транспорт электронов и на синтез АТР в инвертированных пузырьках.
12. а) Бурый жир вырабатывает тепло, чтобы поддерживать температуру тела у новорожденных. б) Несопряженное окислительное фосфорилирование; повышенное потребление АТР; менее трех мест фосфорилирования.
13. а) Будет протекать только анаэробная фаза гликолиза, б) Потребление кислорода прекратится, в) Образование лактата возрастет, г) Синтез АТР прекратится.
14. а) Регенерация NAD+ из NADH происходит с помощью транспорта электронов, б) Окислительное фосфорилирование более эффективно, в) При высоком отношении действующих масс системы синтеза АТР фосфофруктокиназа ингибируется.
15. а) Мышечное сокращение, б) Оно стимулирует гликолиз и дыхание, в) См. рис. 17-29.
16. а) В окружающей среде 4,0∙10-8М; в матриксе 2,0∙10-8 М; б) 2/1; в) 21; г) нет;
д) трансмембранный потенциал.
Глава 18
1. Остатки жирных кислот.
2. а) 9,5∙104 ккал; б) 48 дней; в) около 227 г в день.
3. Первый этап в окислении жирных кислот аналогичен превращению сукцината в фумарат; второй этап аналогичен превращению фумарата в малат; третий этап аналогичен превращению малата в оксалоацетат.
4. a) R—СООН + АТР → Ацил-АМР + РРi; Ацил-АМР + CoA-SH → R—СО—S—СоА + АМР. б) Необратимым гидролизом пирофосфата до неорганического фосфата с помощью клеточной пирофосфатазы.
5. Да; удаленный тритий обнаруживается в виде тритиевой воды.
6. Около 1,1 л воды на I кг трипальмитина.
7. Полное окисление углеводородов до двуокиси углерода и воды.
8. а) Фенилуксусная кислота; молекулярная масса 136; б) нечетное.
9. Поскольку митохондриальный запас кофермента А мал, он должен постоянно возобновляться путем образования кетоновых тел для того, чтобы поддерживать процесс ß-окисления, необходимый для получения энергии.
10. а) Отсутствие углеводов вызовет снижение активности цикла лимонной кислоты; б) с нечетным числом атомов.
2. Описанная процедура представляет собой сопряженную реакцию, в которой продукт медленного трансаминирования (пируват) быстро вступает в последующую индикаторную реакцию, катализируемую лактатдегидрогеназой. За протеканием индикаторной реакции следят с помощью спектрофотометра, наблюдая исчезновение характерной желтой окраски NADH, обусловленной поглощением при 340 нм.
3. Нет; азот аланина может посредством трансаминирования переноситься на оксалоацетат с образованием аспартата.
4. а) Фенилаланин-4-монооксигеназа; диета с пониженным содержанием фенилаланина, б) Нормальный путь обмена Phe - гидроксилирование с образованием Туr - блокирован, и потому Phe - накапливается, в) Phe - превращается в фенилпируват при трансаминировании и в фениллактат при восстановлении, г) Тирозин служит предшественником в синтезе меланина - пигмента, представляющего собой красящее вещество волос.
5. Катаболизм углеродного скелета валина, метионина и изолейцина будет ослаблен.
6. Из I молекулы лактата образуется 17 молекул АТР, а из I молекулы аланина-15 молекул АТР (с учетом энергетических затрат на выведение азота).
8. а) Изолейцин → II → IV → I → V → III → Ацетил-СоА + Пропионил-СоА. б) Этап 1: трансаминирование; этап 2: окислительное декарбоксилирование, аналогичное окислительному декарбоксилированию пирувата в ацетил-СоА; этап 3: окисление, аналогичное дегидрированию сукцината; этап 4: гидратация, аналогичная гидратации фумарата с образованием малата; этап 5: окисление, аналогичное дегидрированию малата в оксалоацетат; этап 6: тиолиз (процесс, обратный альдольной конденсации), аналогичный тиолазной реакции.
9. а) Голодание приводит к снижению уровня глюкозы в крови; предложенная в опыте диета вызывает быстрый катаболизм глюкогенных аминокислот, б) Повышение уровня аммиака обусловлено окислительным дезаминированием; отсутствие Arg (промежуточного продукта в цикле мочевины) препятствует превращению аммиака в мочевину; Arg у кошек синтезируется в недостаточном количестве и не удовлетворяет потребности, возникшие в эксперименте в условиях стресса, в) От превращается в Arg в цикле мочевины.
10. O2 + 2глутамат + СO2 + 2ADP + 2Рi → 2а-кетоглутарат + 3Н2O + 2АТР + Мочевина.
Глава 20
1. На превращение 2 молекул пирувата в одну молекулу глюкозы затрачиваются энергия (4АТР + 2GTP) и восстановительные эквиваленты (2NADH). Необходимые энергия и восстановительные эквиваленты образуются в цикле лимонной кислоты или окислительного фосфорилирования в результате катаболизма аминокислот, жирных кислот или углеводов.
2. а) 14С в глюкозе не обнаружится; б) 3,4-14С-глюкоза.
3. Пируваткарбоксилаза - это митохондриальный фермент. Образовавшийся 14С-оксалоацетат смешивается с пулом оксалоацетата, используемого в цикле трикарбоновых кислот. Следовательно, между 14С-оксалоацетатом и промежуточными продуктами цикла трикарбоновых кислот устанавливается равновесие с образованием через 14С-сукцинат смеси 1-14С- и 4-14С-оксалоацетата. Из оксалоацетата, меченного 14С в положении I, образуется 3,4-14С-глюкоза [см. задачу 2(6)].
4. Фосфофруктокиназа: активируется АМР и ингибируется АТР, регулирует гликолиз; фруктозодифосфатаза: активируется АТР и ингибируется АМР, регулирует глюконеогенез.
5. а), б) и г) Глюкогенные соединения; в) и д) нет.
6. а) Быстрым повышением скорости гликолиза; повышение уровней пирувата и NADH приводит к возрастанию концентрации лактата, б) Лактат превращается в глюкозу через пируват; это более медленный процесс, потому что образование пирувата зависит от доступности NAD+; кроме того, равновесие реакции, катализируемой лактатдегидрогеназой, сдвинуто в сторону образования лактата, а превращение пирувата в глюкозу требует затраты энергии, в) Равновесие реакции, катализируемой лактатдегидрогеназой, сдвинуто в сторону образования лактата.
7. Если катаболический и анаболический пути превращения глюкозы функционируют одновременно, то АТР будет потребляться, а реального синтеза глюкозы происходить не будет. Такие циклы называют холостыми.
8. Наблюдение, согласно которому гликоген-синтаза обладает самой низкой активностью по сравнению с другими ферментами синтеза гликогена, наводит на мысль, что этот ферментативный этап представляет собой узкое место данного метаболического пути и, следовательно, точку его регуляции. Это подтверждается наблюдением, что стимуляция синтеза гликогена путем активации регуляторного фермента приводит к снижению концентрации промежуточных продуктов до точки регуляции и к повышению концентрации метаболитов после точки регуляции. Активация гликоген-синтазы повышает скорость протекания этой стадии, что вызывает уменьшение равновесной концентрации UDP- глюкозы и увеличение равновесной концентрации UDP.
9. На превращение 1 моля глюкозо-6-фосфата затрачивается 1 моль АТР; это составляет 2,6% общего количества АТР, образующегося при полном расщеплении глюкозо-6-фосфата, т. е. эффективность хранения составляет 97,4%.
10. UDP-глюкозопирофосфорилаза.
11. Использование глюкозы и ее предшественника оксалоацетата для образования молока в условиях активного катаболизма жирных кислот приводит к кетозу. Жвачные могут легко превращать пропионат в сукцинил-СоА (рис. 20-7) и далее в оксалоацетат, что предотвращает кетоз.
12. Присутствие UDP-галактозопирофосфорилазы обеспечивает катаболизм галактозы по следующему пути:

Глава 21
1. СО2 участвует в ацетил-СоА-карбоксилазной реакции; инкубация с 14СО2 не ведет к включению 14С в пальмитат.
2. а) Равномерно меченный 14С-ацетил-СоА превращается в 14С-малонил-СоА; эти предшественники в свою очередь превращаются в равномерно меченный 14С-пальмитат. б) Если к большому избытку немеченого малонил-СоА добавить следовые количества 14С-аиетил-СоА, 14С не включится в метаболический пул малонил-СоА; поэтому образуется только 15,16-14С-пальмитат.
3. 8Ацетил-СоА (митохондриальный) + 15АТР + 14NADPH + 9Н2О → Пальмитат + 8СоА + 15ADP + 15Рі + 14NADP+ + 2Н+.
4. а) 3 атома дейтерия на 1 молекулу пальмитата; все три будут расположены у С-16, б) 7 атомов дейтерия на одну молекулу пальмитата;
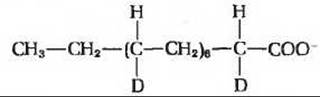
5. Ацетил-СоА (митохондриальный) +
+ NADH + NADP+ + 2АТР + 2Н2О →
→ Ацетил-СоА (цитозольный) + NAD+ + NADPH + 2ADP + 2Рі + 2Н+.
6. Скорость биосинтеза жирных кислот лимитируется стадией карбоксилирования ацетил-СоА, катализируемого ацетил-СоА—карбоксилазой. Высокие уровни цитрата и изоцитрата указывают на то, что синтез жирных кислот протекает в благоприятных условиях вследствие активной работы цикла лимонной кислоты, в процессе которого образуется большой запас АТР, восстановленных пиридиннуклеотидов и ацетил-СоА. Следовательно, цитрат стимулирует (увеличивает Vmах) протекание ферментативной реакции, являющейся лимитирующим этапом биосинтеза жирных кислот. Кроме того, поскольку цитрат прочнее связывается с нитевидной (активной) формой фермента, присутствие цитрата сдвигает равновесие между двумя формами в сторону активной формы. Наоборот, пальмитоил-СоА (конечный продукт биосинтеза жирных кислот) сдвигает равновесие в сторону неактивной формы. Поэтому по мере образования конечного продукта биосинтеза жирных кислот скорость биосинтеза снижается.
7. 3Пальмитиновая кислота + Глицерол + 7АТР + 4Н2O → Трипальмитин + 7ADP + 7Рi + 7Н+.
8. Дигидроксиацетонфосфат + NADH + Пальмитиновая кислота + Олеиновая кислота + 3АТР + СТР + Холин + 4Н2O → Фосфатидилхолин + NAD+ + 2АМР + ADP + CMP + 5Рi + Н+; 7 молекул АТР на 1 молекулу фосфатидилхолина.
9. ß-Ситостерол имитирует некоторые регуляторные функции холестерола, например подавление ферментов во время синтеза холестерола, всасывание холестерола, ингибирование синтеза ферментов.
10. 14СН3—СН2—(14СН2—СН2)6—14СН2— COO-; Ala может служить предшественником пальмитата.
11. а) Они не являются простым обращением один другого; анаболический путь требует гидролиза трех дополнительных молекул АТР на один оборот цикла, б) Различия суммированы в табл. 21-1.
Глава 22
1. Если фенилаланин—4-оксидаза дефектна, путь биосинтеза Туr блокирован и Туr должен поступать с пищей.
2. Глюкоза + 2СO2 + 2NH+4 → Аспартат + 4Н+ +2Н2O.
3. 5-Фосфорибозил-1-пирофосфат.
4. Бактериальные мутанты, которые не способны синтезировать Gly, Asp или Glu, обычно требуют добавки пуринов-аденина и гуанина. Кроме того, для ауксотрофов по Asp и Glu необходимо, чтобы в среде содержались уридин и цитозин, а для ауксотрофов по Gly дополнительные пиримидины не нужны.
5. а) Быстрое деление клеток, подобных раковым, зависит от скорости синтеза ДНК. Поскольку синтез ДНК лимитируется недостатком дезокситимидилата, блокирование синтеза последнего, вызванное необратимым ингибированием тимидилат-синтазы под действием F-dUMP, снижает скорость деления клеток и тем самым рост тканей, б) Тетрагидрофолат превращается в N5,N10-метилентетрагидрофолат в процессе биосинтеза глицина из серина:
Серин + Тетрагидрофолат → Глицин + N5,N10-метилентетрагидрофолат + Н2O.
Ингибирование дигидрофолатредуктазы метотрексатом препятствует превращению дигидрофолата обратно в N5,N10-метилентетрагидрофолат. Поэтому, как только у клеток возникает дефицит N5,N10-Meтилентетрагидрофолата, необходимого для синтеза dTMP, сразу снижается скорость синтеза ДНК, деления клеток и роста тканей. Хотя метотрексат воздействует и на нормальные клетки, это воздействие не так опасно, потому что нормальные клетки в любом случае растут медленнее.
6. Организмы не запасают нуклеотиды в качестве источника энергии и не расщепляют их до конца, а гидролизуют лишь до оснований, а затем реутилизируют эти основания с помощью особых (salvage) метаболических путей. Из-за низкого отношения углерода к азоту нуклеотиды представляют собой бедный источник энергии.
7. а) Как показано на рис. 22-7, n-аминобензойная кислота-это компонент N5,N10- метилентетрагидрофолата, кофактора, участвующего в переносе одноуглеродных фрагментов, б) Стрептоцид - структурный аналог n-аминобензойной кислоты. В присутствии стрептоцида бактерии не могут синтезировать тетрагидрофолат - кофактор, необходимый для превращения 5'-фосфорибозил - 4-карбоксамид - 5-аминоимидазола в 5'-фосфорибозил-4-карбоксамид-N5-формиламиноимидазол при добавлении —СНО; поэтому предшественник и накапливается, в) Добавление избытка n-аминобензойной кислоты снимает подавление роста и накопление рибонуклеотидов, поскольку n-аминобензойная кислота и стрептоцид конкурируют за один и тот же активный центр фермента (конкурентное ингибирование), участвующего в биосинтезе тетрагидрофолата. Такое конкурентное ингибирование (гл. 9) устраняется добавлением избытка субстрата.
8. Лечение подагры аллопуринолом приводит к двум биохимическим последствиям. Во-первых, подавляется превращение гипоксантина в мочевую кислоту, в результате чего накапливается гипоксантин, который выводится легче (он более растворим), чем мочевая кислота. Это облегчает решение клинических проблем, связанных с расщеплением АМР. Во-вторых, ингибируется также превращение гуанина в мочевую кислоту. При этом накапливается ксантин, который, к сожалению, растворяется еще хуже, чем мочевая кислота. Это служит причиной образования ксантиновых камней. Поскольку основной путь образования ксантина из гипоксантина подавлен аллопуринолом, уровень распада GMP ниже уровня распада АМР, и вероятность возникновения ксантиновых камней при лечении подагры аллопуринолом меньше, чем при отсутствии лечения.
9. Бактерии в корневых клубеньках находятся в симбиозе с растением: растение поставляет АТР и восстановительные эквиваленты, а бактерии-ионы аммония, получаемые путем восстановления атмосферного азота. На это восстановление затрачивается большое количество АТР.
10.
Глава 23
1. Эти наблюдения наводят на мысль, что АТР и NADPH образуются на свету; превращение прекращается, как только запасы NADPH и АТР оказываются исчерпанными.
2. Для того чтобы фотосинтез протекал с максимальной скоростью, фотосистема 1 (которая поглощает при 700 нм) и фотосистема II (которая поглощает при 680 нм) должны работать одновременно.
3. Пурпурные серные бактерии используют H2S в качестве донора водорода при фотосинтезе. Кислород не выделяется, поскольку у бактерий отсутствует фотосистема II.
4. 0,57.
5. Диурон блокирует процесс переноса электронов от фотосистемы II к первому участку, соответствующему реакции образования АТР.
6. а) +13,4 ккал; б) 0,29 В.
7. Х-3-фосфоглицерат, Y-рибулозо-1,5-дифосфат.
8. Снижение КM для СO2 при повышении pH среды активирует рибулозо-1,5-дифосфат — карбоксилазу и тем самым повышает скорость фиксации СO2. При освещении pH среды повышается. Ночью при отсутствии освещения активность рибулозо-1,5-дифосфат — карбоксилазы уменьшается и интенсивность фотодыхания снижается.
9. У кукурузы СO2 фиксируется в ходе реакций, называемых путем Хэтча-Слэка: фосфоенолпируват быстро карбоксилируется до оксалоацетата (часть которого в результате трансаминирования превращается в аспартат) и восстанавливается до малата. Только после последующего декарбоксилирования СO2 наконец попадает в цикл Кальвина.
10. В цикле лимонной кислоты роль, аналогичную малатдегидрогеназе в реакциях пути Хэтча-Слэка, играет изоцитратдегидрогеназа.
11. Поскольку фотосистема I может синтезировать АТР с помощью циклического фотофосфорилирования, для осуществления пути Хэтча-Слэка в клетках мезофилла требуется лишь фотосистема I.
12. При освещении протоны накачиваются бактериородопсином внутрь фосфолипидных пузырьков. Затем этот градиент протонов используется митохондриальной F0F1-АТРазой для синтеза АТР.