Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
ATP-Цикл и биоэнергетика клетки
АТР служит общим промежуточным продуктом в реакциях переноса фосфатных групп
Мы видели выше, что в термодинамической шкале фосфорилированных соединений АТР занимает промежуточное положение, т.е. характеризуется средней величиной ∆G0'. Именно эта особенность АТР наряду с другими его свойствами позволяет ему служить промежуточным переносчиком фосфатных групп от сверхвысокоэнергетических соединений, т. е. от таких, которые при гидролизе выделяют больше свободной энергии, чем АТР, к акцепторам фосфата, фосфорилированные производные которых характеризуются низким значением ∆G0' и потому при гидролизе в стандартных условиях выделяют меньше свободной энергии, чем АТР.
Как же именно осуществляет АТР эту свою роль посредника? Мы уже знаем, что метаболические превращения включают цепь последовательных ферментативных реакций, связанных общими промежуточными продуктами (разд. 13.3); в такой последовательности продукт каждой предыдущей реакции служит субстратом для следующей. Например две реакции
![]()
связаны общим промежуточным продуктом D. При постоянной температуре и постоянном давлении химическая энергия может передаваться от одной химической реакции к другой только в том случае, если эти две реакции связаны общим промежуточным продуктом. В нашем примере с двумя реакциями промежуточный продукт D может служить переносчиком энергии от первой реакции ко второй.
Дополнение 14-2. Свободная энергия гидролиза АТР в интактных клетках
Стандартная свободная энергия гидролиза АТР равна -7,3 ккал/моль. Однако в клетке концентрации АТР, ADP и фосфата не только не равны между собой, но и намного ниже принятого для них стандартного значения 1 М (табл. 14-4). Кроме того, значение pH клеточного содержимого тоже может в какой-то мере отличаться от стандартного значения (7,0). Поэтому истинная свободная энергия гидролиза АТР в условиях, существующих внутри клетки, ∆Gр, не совпадает со стандартной свободной энергией ∆G0'. Истинное изменение свободной энергии при гидролизе АТР в клетке (∆Gp) нетрудно вычислить. В табл. 14-4 указаны концентрации ATP, ADP и Рі для эритроцитов человека: 2,25,0,25 и 1,65 мМ соответственно. Примем для простоты, что pH и температура имеют стандартные значения (pH 7,0; температура 25°С). Истинная свободная энергия ∆G гидролиза АТР в эритроцитах определяется в этих условиях из уравнения
![]()
Подставляя в это уравнение соответствующие значения, получаем
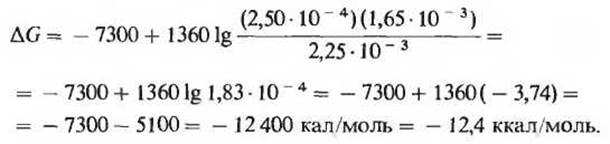
Мы видим, таким образом, что истинное изменение свободной энергии при гидролизе АТР в интактных эритроцитах (-12,4 ккал/моль) значительно превышает изменение стандартной свободной энергии (- 7,3 ккал/моль). Еще одним доказательством этого служит тот факт, что при синтезе АТР из ADP и фосфата в эритроцитах изменение свободной энергии равно + 12,4 ккал/моль.
Поскольку концентрации АТР, ADP и Рі в клетках разных типов различны (табл. 14-4), эти клетки отличаются друг от друга также и по величине ∆Gp гидролиза АТР. Более того, величина ∆Gp может меняться во времени в зависимости от метаболизма клетки, определяющего в ней концентрации АТР, ADP и фосфата, а также pH клеточного содержимого в каждый данный момент. Мы можем вычислить истинное изменение свободной энергии для любой метаболической реакции, протекающей в клетке, если нам известны концентрации всех исходных веществ и продуктов данной реакции, а также другие параметры (температура, pH или концентрация ионов Mg2+) от которых зависит константа равновесия, а следовательно, и величина ∆G0'.
АТР в клетке функционирует как общий промежуточный продукт, переносящий энергию и связывающий реакции, сопровождающиеся выделением свободной энергии, с теми, в которых потребляется свободная энергия. В процессе катаболизма за счет энергии, высвобождающейся при распаде органических питательных веществ клетки, образуются фосфорилированные соединения. При участии специфичного фермента из группы киназ фосфатная группа от такого сверхвысокоэнергетического фосфорилированного соединения (обозначим его через ![]() переносится на ADP, в результате чего образуется АТР. На втором этапе другая специфичная киназа переносит концевую фосфатную группу АТР на молекулу, выполняющую функцию акцептора фосфата (обозначим ее через Y), повышая тем самым ее энергию. В результате образуются молекулы
переносится на ADP, в результате чего образуется АТР. На втором этапе другая специфичная киназа переносит концевую фосфатную группу АТР на молекулу, выполняющую функцию акцептора фосфата (обозначим ее через Y), повышая тем самым ее энергию. В результате образуются молекулы ![]()
Запишем обе реакции:
![]()
В итоге этих двух реакций, сопряженных через общий промежуточный продукт, АТР, химическая энергия передается от ![]() посредством переноса фосфатной группы. В таких реакциях переноса фосфатных групп почти всегда посредником является АТР, поскольку клетки обычно не содержат киназ, способных осуществлять перенос фосфатных групп непосредственно от сверхвысокоэнергетических фосфорилированных соединений к низкоэнергетическим акцепторам.
посредством переноса фосфатной группы. В таких реакциях переноса фосфатных групп почти всегда посредником является АТР, поскольку клетки обычно не содержат киназ, способных осуществлять перенос фосфатных групп непосредственно от сверхвысокоэнергетических фосфорилированных соединений к низкоэнергетическим акцепторам.