Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Гликолиз - центральный путь катаболизма глюкозы
Краткое содержание главы
Гликолиз, в ходе которого молекула D-глюкозы превращается в две молекулы пирувата, является для большинства организмов одним из центральных метаболических путей, используемых для получения химической энергии в форме АТР. При анаэробных условиях пируват в большей части животных и растительных тканей восстанавливается до лактата, а в дрожжевых клетках в процессе спиртового брожения превращается в этанол и СО2. Суммарное уравнение для анаэробного гликолиза в мышцах и для молочнокислого брожения, вызываемого некоторыми видами микроорганизмов, имеет вид
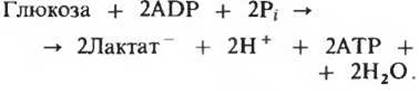
Процесс спиртового брожения описывается суммарным уравнением
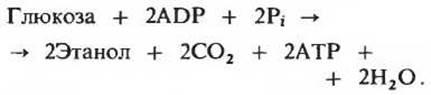
В аэробных клетках пируват не восстанавливается до лактата (или до этанола и СО2), а окисляется в ацетил-СоА и СО2. Таким образом, гликолиз у многих организмов составляет обязательную первую стадию аэробного катаболизма глюкозы.
Превращение глюкозы в пируват катализируется десятью ферментами, действующими последовательно. Это превращение слагается из двух стадий. На первой из них, состоящей из пяти ферментативных реакций, D-глюкоза фосфорилируется за счет АТР и расщепляется в конечном счете на две молекулы D-глицеральдегид-3-фосфата. На второй стадии глицеральдегид-3-фосфат окисляется за счет NAD+ и присоединяет неорганический фосфат с образованием 3-фосфоглицероилфосфата. Высокоэнергетическая фосфатная группа 3-фосфоглицероилфосфата передается затем на ADP, в результате чего образуются АТР и 3-фосфоглицерат, который претерпевает изомеризацию и превращается в 2-фосфоглицерат. Катализируемая енолазой дегидратация 2-фосфоглицерата приводит к фосфоенолпирувату, а этот последний отдает свою фосфатную группу ADP и превращается в свободный пируват. На первой стадии гликолиза используются две молекулы АТР, но на второй стадии из ADP образуются четыре молекулы АТР, так что в итоге на каждую расщепленную молекулу глюкозы образуются две молекулы АТР. В животных тканях в отсутствие кислорода NADH, образующийся при окислении глицеральдегид-3-фосфата, вновь окисляется в NAD+, восстанавливая при этом пируват до лактата; катализирует эту реакцию лактатдегидрогеназа.
Остатки глюкозы, из которых построены гликоген и крахмал, превращаются в глюкозо-6-фосфат под действием гликогенфосфорилазы или фосфорилазы крахмала и фосфоглюкомутазы. Другие гексозы, а именно фруктоза, манноза и галактоза также фосфорилируются и превращаются в промежуточные продукты гликолиза. Вовлечение глюкозы в процесс гликолиза при участии фермента гексокиназы регулируется глюкозо-6-фосфатом, который играет роль отрицательного модулятора. Гликоген-фосфорилаза, катализирующая превращение глюкозных единиц гликогена в глюкозо-1-фосфат, принадлежит к числу регуляторных ферментов и существует в двух формах: более активной (фосфорилаза а) и менее активной (фосфорилаза b); стимулирующее действие на фосфорилазу b оказывает АМР. Роль главного регуляторного фермента в последовательности реакций гликолиза играет фосфофруктокиназа, которую ингибируют АТР и цитрат и стимулирует АМР. Вторым регуляторным пунктом гликолиза является пируваткиназная реакция. Последовательность реакций спиртового брожения идентична последовательности реакций гликолиза на всех этапах вплоть до образования пирувата, однако при спиртовом брожении пируват не восстанавливается до лактата, а декарбоксилируется с образованием ацетальдегида, который затем восстанавливается до этанола за счет NADH в реакции, катализируемой алкогольдегидрогеназой.
ЛИТЕРАТУРА
Книги
Atkinson D. Е. Cellular Energy Metabolism and Its Regulation, Academic, New York, 1977. Интересная трактовка энергетики и регуляции гликолиза.
Dickens F.. Randle P.J., Whelan W. J. Carbohydrate Metabolism and Its Disorders, 2 vols., Academic, New York, 1968. Достаточно полное собрание обзорных статей.
Fruton J. S. Molecules and Life, Wiley, New York, 1972. Книга содержит подробное описание истории изучения гликолиза. Hochachka Р. Living without Oxygen, Harvard University Press, Cambridge, Mass., 1980. Сравнительная биохимия и физиология анаэробного гликолиза у разных организмов.
Kalckar Н. М. (ed.). Biological Phosphorylations: Development of Concepts, Prentice-Hall, Englewood Clifs, N.J., 1969. Содержит классические работы no гликолизу.
Lehninger A. L. Biochemistry, 2d ed., Worth, New York, 1975. (Имеется перевод: Ленинджер А. Биохимия. - М.: Мир, 1976.) В гл. 16 приведены подробные сведения о гликолизе.
Newsholme Е. A., Start С. Regulation in Metabolism, Wiley, New York, 1973. В гл. З и 6 описана регуляция гликолиза.
Статьи
Coulson R. A. Anaerobic Glycolysis: The Smith and Wesson of the Heterotherms, Perspec. Biol. Med., 22, 465-479 (1979). Очень интересный анализ сравнительной роли анаэробного гликолиза у крупных животных, в основе которого лежат экспериментальные наблюдения над аллигаторами и другими животными.
Ottaway J.H., Mowbray J. The Role of Compartmentation in the Control of Glycolysis, Curr. Topics Cell Regulation, 12, 108-195 (1977).
Вопросы и задачи
1. Уравнение для первой стадии гликолиза. Напишите уравнения химического баланса для последовательности реакций, в ходе которых происходит расщепление D-глюкозы на две молекулы D-глицеральдегид-3-фосфата (первая стадия гликолиза). Для каждого уравнения укажите изменение стандартной свободной энергии. Напишите также суммарное уравнение первой стадии гликолиза и укажите суммарное изменение стандартной свободной энергии, соответствующее этой стадии.
2. Вторая стадия гликолиза в скелетных мышцах. В работающей скелетной мышце при анаэробных условиях глицеральдегид-3-фосфат превращается в лактат (вторая стадия гликолиза). Напишите уравнения химического баланса для последовательности реакций в этом процессе с указанием изменения стандартной свободной энергии для каждой из реакций. Напишите также суммарное уравнение для второй стадии гликолиза и укажите суммарное изменение стандартной свободной энергии для этой стадии.
3. Обмен фруктозы в сперматозоидах. Концентрация фруктозы в сперме человека и быка равна приблизительно 12 мМ. В сперматозоидах в результате анаэробного расщепления фруктозы образуется АТР, необходимый для движения (биений) жгутика. Главный катаболический путь от фруктозы к лактату в этих клетках ведет в обход фосфофруктокиназной реакции гликолиза; на этом пути используется фермент, расщепляющий фруктозо-1-фосфат на два трехуглеродных соединения (рис. 15-8). Напишите уравнения для последовательности соответствующих химических превращений. Напишите также суммарное уравнение анаэробного катаболизма фруктозы (превращения ее в лактат) в сперматозоидах.
4. Путь атомов углерода при брожении. Опыт с вытеснением радиоактивной метки проводится на дрожжевом экстракте в строго анаэробных условиях, обеспечивающих спиртовое брожение. Небольшое количество меченного радиоактивным углеродом субстрата (импульсная метка) инкубируют с дрожжевым экстрактом в течение времени, достаточного для того, чтобы каждый из промежуточных продуктов данного метаболического пути успел включить метку. Затем метку «прогоняют» по всему пути, добавляя избыток немеченого субстрата. Это делают для того, чтобы предотвратить участие меченых продуктов в обратных реакциях и отвлечение их на другие метаболические пути.
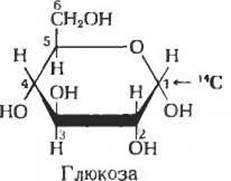
а) В каком положении обнаруживается метка в продукте брожения - этаноле, если субстратом служит глюкоза, меченная 14С по положенню 1? Почему?
б) В каком положении должна находиться метка в исходной молекуле глюкозы для того, чтобы вся радиоактивность 14С обнаруживалась в виде 14СO2, выделяющейся при спиртовом брожении? Поясните свой ответ.
Задача 4
5. Соотношение между кинетическими характеристиками ферментов и их физиологическими функциями. Концентрация глюкозы в клетках млекопитающих невелика по сравнению с ее концентрацией в плазме крови. Объясняется это тем, что поступление глюкозы в клетки регулируется, и глюкоза быстро фосфорилируется в результате реакции с АТР
![]()
В организме млекопитающих эту реакцию катализируют два разных фермента, заметно различающихся по своим свойствам. В скелетных мышцах присутствует только один из них - гексокиназа. Этот фермент ингибируется глюкозо-6-фосфатом и характеризуется величиной КM 0,1 мМ. В печени помимо гексокиназы содержится также и глюкокиназа, которая здесь преобладает. Глюкокиназа характеризуется гораздо большей величиной КM (10,0 мМ) и не ингибируется глюкозо-6-фосфатом. Какое значение имеет различие в величине КM для гексокиназы мышц и глюкокиназы печени? Как должны сказываться различия в свойствах этих двух ферментов (величина КM и способность ингибироваться глюкозо-6-фосфатом) на их физиологической роли в мышцах и в печени?
6. Роль лактатдегидрогеназы. При напряженной работе мышечная ткань потребляет гораздо больше АТР, чем в состоянии покоя. В белых скелетных мышцах, например в мышцах ног у кролика или мышцах крыла у индейки, почти весь этот АТР образуется в процессе анаэробного гликолиза. На рис. 15-5 видно, что АТР образуется на второй стадии гликолиза в ходе двух ферментативных реакций, катализируемых фосфоглицераткиназой и пируваткиназой. Представим себе, что в скелетной мышце отсутствует лактатдегидрогеназа. Могла бы мышца в этом случае напряженно работать, т.е. с большой скоростью генерировать АТР путем гликолиза? Аргументируйте свой ответ. Учтите, что лактатдегидрогеназная реакция не требует участия АТР. От ясного понимания ответа на этот вопрос зависит правильное представление о гликолитическом цикле в целом.
7. Арсенатное отравление. В структурном и химическом отношении арсенат сходен с фосфатом (Рі), поэтому многие ферменты, нуждающиеся в фосфате, используют также и арсенат. Однако органические производные мышьяковой кислоты менее стабильны, чем соответствующие производные фосфорной кислоты. Например, ациларсенаты легко разлагаются без участия катализаторов:
![]()
В отличие от них ацилфосфаты, например 3-фосфоглицероилфосфат, более устойчивы и подвергаются в клетке превращениям только под действием соответствующих ферментов.
а) Как повлияет замена фосфата арсенатом на суммарную реакцию, катализируемую глицеральдегид-3-фосфатдегидрогеназой ?
б) Каковы последствия замены фосфата арсенатом? Для большинства организмов арсенат крайне токсичен. Чем это объясняется?
8. Потребность в фосфате при спиртовом брожении. В 1905 г. Гарден и Йонг провели ряд работ по спиртовому брожению, ставших классическими. Изучая сбраживание D-глюкозы до этанола и СО2 под действием экстрактов пивных дрожжей, исследователи установили следующее. 1) Для сбраживания необходим неорганический фосфат; по исчерпании запаса фосфата брожение прекращается еще до того, как будет использована вся глюкоза. 2) При брожении в этих условиях накапливаются этанол, СО2 и гексозодифосфат. 3) Если заменить фосфат на арсенат, то гексозодифосфат не накапливается, но брожение продолжается до тех пор, пока вся глюкоза не превратится в этанол и СО2.
а) Почему при исчерпании запаса фосфата брожение прекращается?
б) Почему накапливаются этанол и СО2? Необходимо ли превращение пирувата в этанол и СО2? Почему? Укажите, какой гексозодифосфат накапливается. Почему он накапливается?
в) Почему замена фосфата на арсенат предотвращает накопление гексозодифосфата, но в то же время обеспечивает завершение брожения, т. е. полное превращение глюкозы в этанол и СО2 (см. п. 7)?
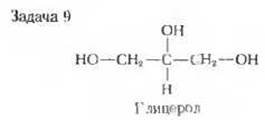
9. Обмен глицерола. Глицерол, образующийся при расщеплении жиров, превращается в результате двух ферментативных реакций в промежуточный продукт гликолиза - дигидроксиацетонфосфат. Выскажите свои предположения о возможной последовательности реакций в процессе обмена глицерола. На каких известных ферментативных реакциях основаны ваши предположения? Напишите суммарное уравнение превращения глицерола в пируват исходя из своих представлений.
10. Измерение внутриклеточных концентраций метаболитов. Измерение концентраций промежуточных продуктов метаболизма в живой клетке сопряжено с большими экспериментальными трудностями. Поскольку клеточные ферменты катализируют быстро протекающие метаболические превращения, одна из обычных проблем при всяком экспериментальном вмешательстве в жизнь клетки связана с тем, что данные, полученные путем измерений, отражают не физиологические, а равновесные концентрации метаболитов. Поэтому любая экспериментальная методика будет надежной лишь в том случае, если с ее помощью удастся мгновенно подавить все ферментативные реакции в интактной ткани и тем самым предотвратить дальнейшие превращения промежуточных продуктов метаболизма. Этой цели можно достичь путем быстрого сжатия ткани между большими алюминиевыми пластинами, охлажденными жидким азотом (-190 ˚С); такой прием носит название «фиксация замораживанием». После замораживания, мгновенно подавляющего действие ферментов, ткань растирают в порошок и ферменты инактивируют путем осаждения хлорной кислотой. Осадок удаляют центрифугированием, а прозрачную надосадочную жидкость анализируют на содержание в ней метаболитов с помощью специфических ферментативных тестов. Истинную концентрацию данного метаболита в клетке определяют расчетным путем, учитывая общее содержание воды в ткани и данные измерений объема внеклеточного пространства. В табл. 1 приведены кажущиеся внутриклеточные концентрации субстратов и продуктов реакции фосфорилирования фруктозо-6-фосфата, катализируемой ферментом фосфофруктокиназой в изолированной ткани сердца крысы, а) По данным табл. 1 вычислите отношение действующих масс Q для фосфофруктокиназной реакции при физиологических условиях
![]()
Таблица 11)
|
Метаболит |
Кажущаяся концентрация, мМ (мкмоль/мл внутриклеточной Н2О) |
|
Фруктозо-6-фосфат |
0,087 |
|
Фруктозо-1,6-дифосфат |
0,022 |
|
АТР |
11,52 |
|
ADP |
1,32 |
1) По Williamson, J. Biol. Chem., 240, 2308, 1965.
б) Величина ∆G0' для фосфофруктокиназной реакции равна — 3,4 ккал/моль. Исходя из этого вычислите константу равновесия для этой реакции.
в) Сравните величины Q и К'eq. Находится ли данная физиологическая реакция в состоянии равновесия? Что говорит этот эксперимент о роли фосфофруктокиназы в качестве регуляторного фермента?
11. Регуляция фосфофруктокиназы. Приведенный на рисунке график описывает зависимость между концентрацией АТР и активностью фосфофруктокиназы, которая представляет собой аллостерический фермент. При данной концентрации фруктозо-6-фосфата активность фосфофруктокиназы с повышением концентрации АТР сначала возрастает, но в какой-то момент наступает перелом - дальнейшее повышение концентрации АТР вызывает уже ингибирование фермента.
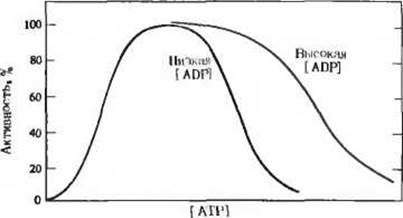
а) Объясните, как может АТР быть и субстратом, и ингибитором фосфофруктокиназы. Как регулируется активность этого фермента с помощью АТР?
б) Каким образом регулируется гликолиз в зависимости от уровня АТР?
в) Ингибирующее действие АТР на фосфофруктокиназу проявляется слабее при высокой концентрации ADP. Как можно объяснить этот факт?
12. Ферментативная активность и физиологическая функция. Гликоген-фосфорилаза из скелетных мышц характеризуется гораздо более высокой величиной Vmaх, чем тот же фермент из ткани печени.
а) Какую физиологическую функцию выполняет гликоген-фосфорилаза в скелетной мышце и в ткани печени?
б) Почему величина Vmаx для мышечного фермента должна быть больше, чем для фермента из печени?
13. Ферментная недостаточность при углеводном обмене. Ниже описаны четыре клинических случая. Назовите для каждого случая дефектный фермент и дайте соответствующие рекомендации, выбрав их из приложенного перечня. Укажите на чем основано ваше решение. Ответьте на вопросы, приведенные в описании каждого из четырех случаев.
Случай 1. Больной не переносит молока. Как только он его выпьет, у него сразу же начинаются рвота и понос. Проведен тест на толерантность к лактозе. (Испытуемый получает при этом определенное количество лактозы, после чего у него через соответствующие промежутки времени измеряют концентрацию глюкозы и галактозы в плазме крови. В норме уровень этих сахаров возрастает до максимума примерно через час, а затем снижается.) У больного в этом тесте концентрация глюкозы и галактозы в крови не возрастала, а оставалась постоянной. Объясните, почему у здоровых людей концентрация глюкозы и галактозы в крови сначала растет, а затем снижается. Почему у больного таких изменений не происходит? Случай 2. У больного с умственной отсталостью молоко вызывает рвоту и понос. В крови концентрация глюкозы низка, а концентрация редуцирующих сахаров значительно выше нормы. В моче обнаруживается галактоза. Чем объясняется высокая концентрация редуцирующих сахаров в крови? Почему в моче обнаруживается галактоза?
Случай 3. Больной страдает от судорог в мышцах при напряженной физической работе, но в остальном чувствует себя здоровым. Биопсия мышечной ткани выявила, что концентрация гликогена в мышцах этого больного гораздо выше нормы. Почему накапливается гликоген?
Случай 4. Больная вялая, апатичная. Печень увеличена; при биопсии печени обнаружен большой избыток гликогена. Концентрация глюкозы в крови ниже нормы. В чем причина пониженной концентрации глюкозы в крови этой больной?
|
Ферменты, активность которых нарушена |
Рекомендации |
|
а) Фосфофруктокиназа мышц |
1. Бег трусцой по 5 км/день |
|
б) Фосфоманноизомераза |
2. Обезжиренная диета |
|
в) Галактозо-1-фосфатуридилилтрансфераза |
3. Диета с низким содержанием лактозы |
|
г) Фосфорилаза печени |
4. Запрещается тяжелая физическая работа |
|
д) Триозокиназа |
|
|
е) Лактаза в слизистой кишечника |
5. Большие дозы ниацина |
|
ж) Мальтаза в слизистой кишечника |
6. Частое и регулярное питание |
14. Тяжесть клинических симптомов, обусловленных ферментной недостаточностью. Клинические симптомы двух форм галактоземии, одна из которых обусловлена недостаточностью галактокиназы, а другая - галактозо-1-фосфат - уридилилтрансферазы, резко различаются по своей тяжести. И в том и в другом случае молоко вызывает у больных кишечные расстройства, но при недостаточности галактозо-1-фосфатуридилилтрансферазы нарушаются также функции печени, почек, селезенки и мозга, а затем наступает смерть. Какие продукты накапливаются в крови и в тканях при недостаточности каждого из этих двух ферментов? Оцените сравнительную токсичность этих продуктов на основе приведенных выше данных.