Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Цикл лимонной кислоты
Пируват должен сначала окислиться до ацетил-СоА и СО2
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счете через цикл лимонной кислоты до СО2 и Н2O. Однако, прежде чем эти питательные вещества будут вовлечены в цикл, их углеродный скелет должен быть разрушен, а его фрагменты должны превратиться в ацетильные группы ацетил-СоА, потому что именно в этой форме цикл лимонной кислоты принимает большую часть поступающего в него «топлива». О том, как из жирных кислот и аминокислот образуются ацетильные группы для этого цикла, мы узнаем из гл. 18 и 19. Здесь же мы рассмотрим процесс, в результате которого пируват, образовавшийся при гидролитическом расщеплении глюкозы, окисляется до ацетил-СоА и СО2 при участии набора ферментов, объединенных структурно в так называемый пируватдегидрогеназный комплекс. Эта мультиферментная система, находящаяся у эукариотических клеток в митохондриях. а у прокариотических-в цитоплазме, катализирует следующую суммарную реакцию:
Пируват + NAD+ + CoA-SH →
→ Ацетил-СоА + NADH + СО2
∆G0' = -8,0 ккал/моль.
В ходе этой довольно сложной реакции происходит окислительное декарбоксилирование пирувата - процесс дегидрирования, в результате которого карбоксильная группа пирувата удаляется в виде молекулы СО2, а его ацетильная группа включается в состав ацетил-СоА. Один атом водорода, отщепляемый от пирувата, обнаруживается в составе NADH, а другой - в виде Н+. Затем образовавшийся таким путем NADH передает свои электроны в цепь переноса электронов (рис. 16-1), по которой они в конечном счете передаются на молекулярный кислород.
В объединенном процессе дегидрирования и декарбоксилирования пирувата до ацетил-СоА участвуют последовательно три разных фермента: пируватдегидрогеназа (E1), дигидролипоил-ацетил-трансфераза (Е2) и дигидролипоилдегидрогеназа (Е3), а также пять коферментов. или простетических групп - тиамин-пирофосфат (ТРР), флавинадениндинуклеотид (FAD), кофермент А (СоА), никотинамидадениндинуклеотид (NAD+) и липоевая кислота. Все эти ферменты и коферменты объединены в мультиферментную систему, которую впервые выделили и подробно исследовали Лестер Рид с сотрудниками из Техасского университета. Четыре витамина из числа тех, в которых нуждается организм человека, являются необходимыми компонентами именно этой системы. Эти витамины: тиамин (в ТРР), рибофлавин (в FAD), пантотеновая кислота (в СоА) и никотинамид (в NAD+). Кроме того, для реакции требуется еще и липоевая кислота (рис. 16-3); она играет роль необходимого витамина, или фактора роста у некоторых микроорганизмов, тогда как высшие животные способны ее синтезировать из легко доступных предшественников. Пируватдегидрогеназный комплекс, выделенный из клеток Е. coli, представляет собой частицу диаметром около 45 нм, т. е. несколько большую по своим размерам, чем рибосома. Молекулярная масса этой крупной мультиферментной системы превышает 6 ∙ 106. В центре комплекса, составляя как бы его «ядро», к которому прикрепляются другие ферменты, располагается дигидролипоил-ацетилтрансфераза (мол. масса 200 000). Ее молекула состоит из 24 субъединиц - полипептидных цепей, в каждой из которых к двум специфическим остаткам лизина в активном центре субъединицы присоединены две липоильные группы (присоединение происходит путем образования пептидной связи между карбоксильной группой липоевой кислоты и Е-аминогруппой остатка лизина; рис. 16-3). К дигидролипоил-ацетилтрансферазе присоединены очень крупные молекулы пируватдегидрогеназы и дигидролипоилдегидрогеназы. Пируватдегидрогеназа содержит связанный тиаминпирофосфат, а дигидролипоилдегидрогеназа - связанный FAD.
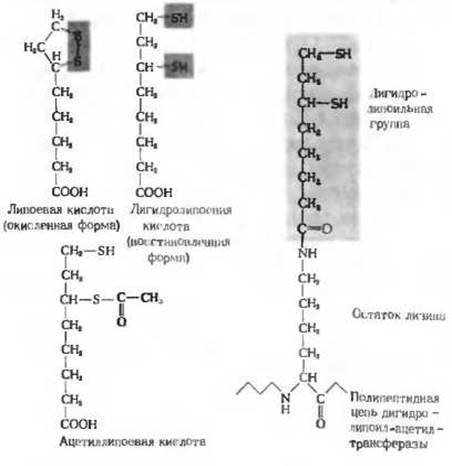
Рис. 16-3. Липоевая кислота и ее активная форма, представляющая собой простетическую группу дигидролипоил-ацетилтраисферазы. Липоевая кислота и липоильная группа могут существовать в окисленной (дисульфидной), восстановленной (дитиоловой) и ацетилированной формах. Поэтому липоильная группа действует и как переносчик водорода, и как переносчик ацетильных групп. Липоиллизиновая группа, имеющая длину около 1,4 нм, действует как «поворотный кронштейн». Она переносит атомы водорода от пируватдегидрогеназы на дигидролипоилдегидрогеназу, а также ацетильную группу на CoA-SH. Липоевую кислоту называют иногда псевдовитамином.
Липоиллизиновые группы центрального фермента пируватдегидрогеназного комплекса, имеющие длину около 1,4 нм, функционируют как «поворотные кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой. К пируватдегидрогеназному комплексу присоединены еще и два других фермента, регулирующие пируватдегидрогеназную реакцию (о них будет сказано ниже).
На рис. 16-4 представлена в схематическом виде катализируемая пируватдегидрогеназным комплексом последовательность реакций, в ходе которых осуществляется декарбоксилирование и дегидрирование пирувата. Эта последовательность включает пять стадий. На стадии 1 пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом, присоединенным к пируватдегидрогеназе (Е1); в результате этой реакции образуется гидроксиэтильное производное тиаминпирофосфата с гидроксиэтильной группой при тиазольном кольце (разд. 10.4). Пируватдегидрогеназа катализирует также стадию 2-перенос атомов водорода и ацетильной группы от тиаминпирофос фата на окисленную форму липоиллизиновых простетических групп центрального фермента комплекса, дигидролипоил-ацетилтрансферазы, с образованием 6-ацетилтиоэфира восстановленных липоильных групп. На стадии 3 молекула CoA-SH взаимодействует с ацетильным производным дигидролипоил-ацетилтрансферазы, что приводит к образованию ацетил-S-CoA и к полностью восстановленной, или дитиоловой, форме липоильных групп. На стадии 4 на эту восстановленную форму дигидролипоил- ацетилтрансферазы воздействует дигидролипоилдегидрогеназа, катализирующая перенос атомов водорода от восстановленных липоильных групп на FAD, который играет роль простетической группы дигидролипоилдегидрогеназы. На стадии 5 (заключительной в этой последовательности реакций) восстановленная FAD-группа дигидролипоилдегидрогеназы передает водород на NAD+ с образованием NADH. Важнейшую роль в рассматриваемом процессе играют липоиллизиновые боковые группы дигидролипоил-ацетилтрансферазы, передающие от одного фермента к другому атомы водорода и ацетильную группу. Все эти ферменты и коферменты структурно организованы в единый комплекс, благодаря чему простетические группы сближены и промежуточные продукты реакции быстро взаимодействуют друг с другом. Если бы эти очень крупные ферментные молекулы были разобщены и свободно перемещались в цитозоле, то им пришлось бы в процессе диффузии преодолевать немалые расстояния, прежде чем они могли бы столкнуться и вступить во взаимодействие. На рис. 16-5 приведена электронная микрофотография пируватдегидрогеназного комплекса.
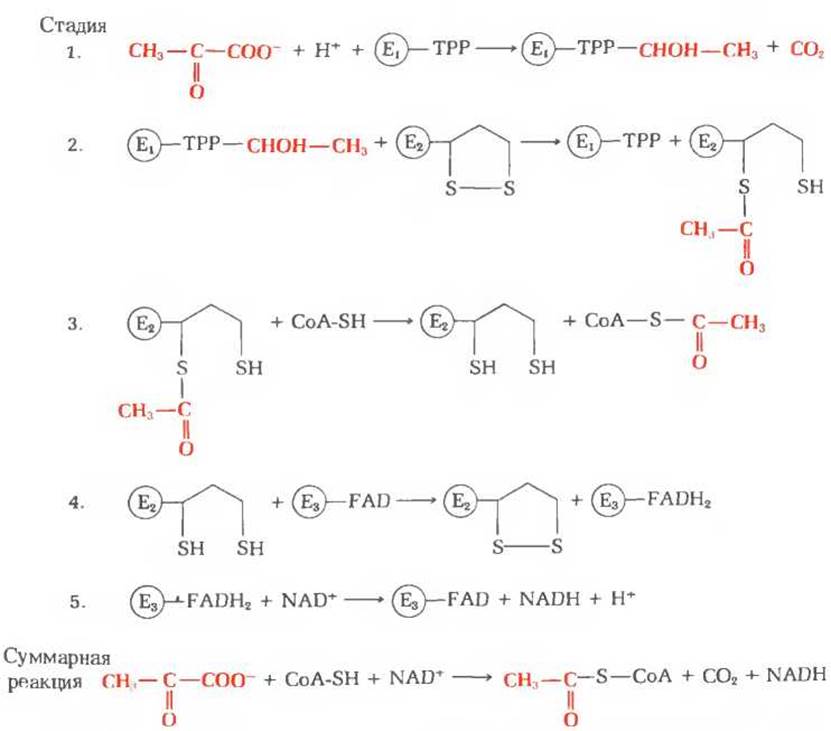
Рис. 16-4 Стадии окислительного декарбокодирования пирувата до ацетил-СоА процесса, катализируемого пируватдегидрогеназным комплексом. Для того чтобы можно было легче проследить судьбу пирувата, его превращения выделены красным цветом. Структура тиаминпирофосфата и его а-гидроксиэтильного производного показана на рис. 10-2. E1-пиpyватдегидрогеназа; ТРР - тиаминпирофосфат; ТРР-СНОН-СН3-а-гидроксиэтилтиаминпирофосфат; Е2-дигидролипоил-ацетилтраисфераза; Е3 - дигидролипоилдегидрогеназа.
Недостаток витамина B1, или тиамина (разд. 10.4), обусловливает заболевание, известное под названием бери-бери. Теперь нам ясно, что в организме животных, лишенных тиамина, оказывается невозможным нормальное окисление пирувата. Особенно сильно влияет такое нарушение на мозг, который обычно получает всю необходимую энергию путем аэробного окисления глюкозы и для которого поэтому окисление пирувата - жизненно необходимый процесс. Характерный для бери-бери полиневрит и общее нарушение функций двигательной нервной системы (гл. 10) обусловлены нарушением функции пируватдегидрогеназы.
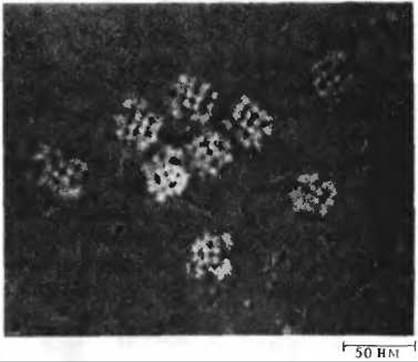
Рис. 16-5. Электронная микрофотография пируватдегидрогеназного комплекса, выделенного из клеток Е. coli. Видно, что частицы комплекса состоят из субъединиц.
Важно отметить, что процесс, катализируемый пируватдегидрогеназным комплексом. в животных тканях необратим. Это подтверждено изотопным методом, при помощи которого было показано, что радиоактивная СО2 не присоединялась вновь к ацетил-СоА, т.е. образования пирувата, меченного по карбоксильной группе, не происходило.
Ниже мы увидим, что регуляция активности пируватдегидрогеназного комплекса составляет один из важных элементов в биологическом контроле дыхания.