Основы биохимии Том 3 - А. Ленинджер 1985
Молекулярные механизмы передачи генетической информации
Синтез белка и его регуляция
Рибосомы - это молекулярные машины, предназначенные для синтеза полипептидных цепей
В каждой клетке Е. coli имеется больше 15 000 рибосом, которые составляют почти четверть сухого веса клетки. Прокариотические рибосомы содержат приблизительно 65% рРНК и около 35% белка. Вес рибосомной частицы ~2,8∙106 дальтон, диаметр ~18 нм, коэффициент седиментации 70S.
Прокариотические рибосомы состоят из двух субчастиц неравного размера (рис. 29-11)-большой с коэффициентом седиментации 50S и малой с коэффициентом седиментации 30S; вес большой субчастицы 1,8∙106 дальтон, а малой 1,0∙106 дальтон. В состав 50S-субчастицы входят одна молекула 23S-pPHK (~3200 нуклеотидов), одна молекула 5S-pPHK (~120 нуклеотидов) и 34 белка. Субчастица 30S содержит одну молекулу 16S-pPHK (1600 нуклеотидов) и 21 белок. Белки субчастиц обозначаются номерами: в большой (50S) субчастице от L1 до L34 (L от англ. Large - большая) и в малой (30S) субчастице от S1 до S21 (S от англ. Small — малая). Все белки рибосом Е. coli выделены и многие из них сек- венированы; они заметно отличаются друг от друга. Их молекулярные массы лежат в пределах от 6000 до 75 000.
Нуклеотидные последовательности одноцепочечных рРНК Е. coli также установлены. Каждая из трех рРНК обладает специфической трехмерной структурой, обусловленной характером внутримолекулярного спаривания оснований. На рис. 29-12 показана предполагаемая конформация 5S-pPHK, соответствующая максимальному числу спаренных оснований. рРНК, по-видимому, выполняют роль каркасов, на которых в строго определенном порядке крепятся полипептидные компоненты. Если 21 полипептид и 16S-pPHK 30S-субчастицы выделить в чистом виде, а затем смешать в соответствующей последовательности при правильной температуре, то макромолекулы самопроизвольно образуют 30S-субчастицы, идентичные по структуре и активности нативным. Аналогичным образом, 50S-субчастица может быть самопроизвольно реконструирована из своих 34 полипептидов и своих 5S- и 16S-pPHK при условии, что в смеси присутствует также 30S-субчастица. Вероятно, каждый из 55 белков прокариотической рибосомы играет специфическую роль в синтезе полипептидов, выполняя функцию либо фермента, либо “помощника” в общем процессе. Однако в настоящее время эти специфические функции установлены только для нескольких рибосомных белков.
Хотя обычно рибосомы изображают в виде симметричной фигуры, в которой 30S-субчастица наподобие шапочки лежит на 50S-субчастице, имеющей форму, близкую к сфере (как это показано на рис. 29-11), в действительности эти субчастицы расположены не симметрично и имеют совершенно неправильную форму. На рис. 29-13 показана трехмерная структура 30S- и 50S-субчастиц рибосомы Е. coli, построенная на основе данных рентгеноструктурного анализа и электронной микроскопии. Две замысловатой формы субчастицы пригнаны друг к другу, причем между ними остается щель. Через эту щель проходит молекула мРНК, вдоль которой в процессе трансляции перемещается рибосома. Из этой щели появляется новосинтезированная полипептидная цепь.
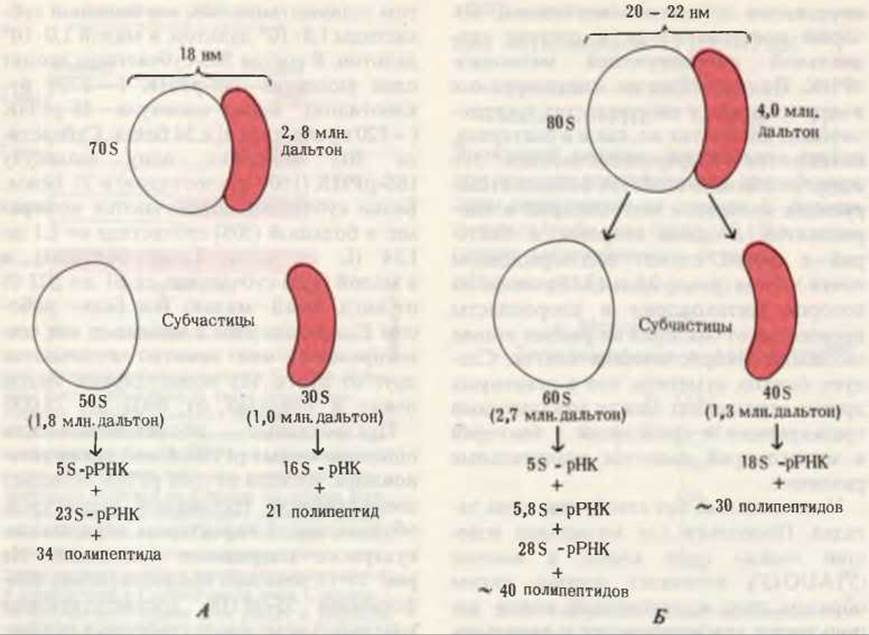
Рис. 29-11. Состав прокариотических (A) и эукариотических (Б) рибосом (цитоплазматических). Рибосомы митохондрий и хлоропластов эукариот напоминают рибосомы прокариотических клеток.
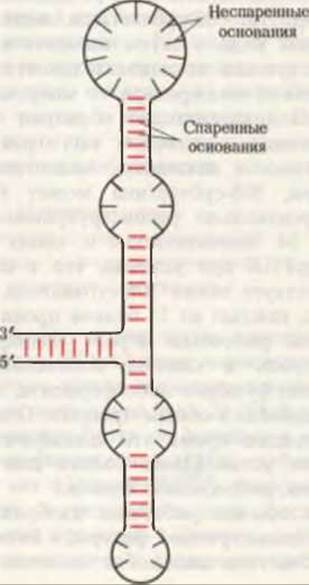
Рис. 29-12 Схематическое изображение одной из возможных моделей вторичной структуры 5S-pPHK прокариот, соответствующей максимальному числу внутримолекулярных пар оснований (они указаны красными черточками).