Основы биохимии Том 3 - А. Ленинджер 1985
Молекулярные механизмы передачи генетической информации
Синтез белка и его регуляция
Элонгация полипептидной цепи - это повторяющийся процесс
Присоединение каждого аминокислотного остатка к растущей полипептидной цепи происходит в три стадии. Этот цикл повторяется столько раз, сколько остатков следует присоединить. Для осуществления элонгации необходимы: 1) описанный выше инициирующий комплекс; 2) следующая аминоацил-тРНК, соответствующая следующему триплету мРНК; 3) три растворимых белка цитозоля, называемых факторами элонгации EF-Tu, EF-Ts и EF-G; 4) GTP. Факторы элонгации часто обозначают просто Tu, Ts и G.
На первой стадии цикла элонгации (рис. 29-15) сначала происходит связывание следующей аминоацил-тРНК с комплексом, состоящим из фактора элонгации Tu и молекулы GTP. Образующийся тройной комплекс аминоацил-тРНК-Tu-GTP соединяется с 70S-инициирующим комплексом. Одновременно происходит гидролиз GTP, и комплекс Tu-GDP покидает 70S-рибосому, после чего с помощью GTP и фактора Ts комплекс Tu-GDP восстанавливается до Tu-GTP.
Далее с A-участком рибосомы связывается новая аминоацил-тРНК. Это происходит за счет антипараллельного комплементарного взаимодействия между антикодоном новой аминоацил-тРНК и соответствующим кодоном матричной РНК (структуру различных кодонов и антикодонов мы рассмотрим позже). Однако кодон-антикодонового взаимодействия недостаточно, чтобы обеспечить связывание правильной аминоацил-тРНК. Точное соответствие последней кодону мРНК проверяется с помощью еще одного специфического контакта внутри A-участка между другой частью молекулы тРНК и рРНК. Следующая стадия элонгации наступает только в том случае, если оба контакта оказываются правильными.
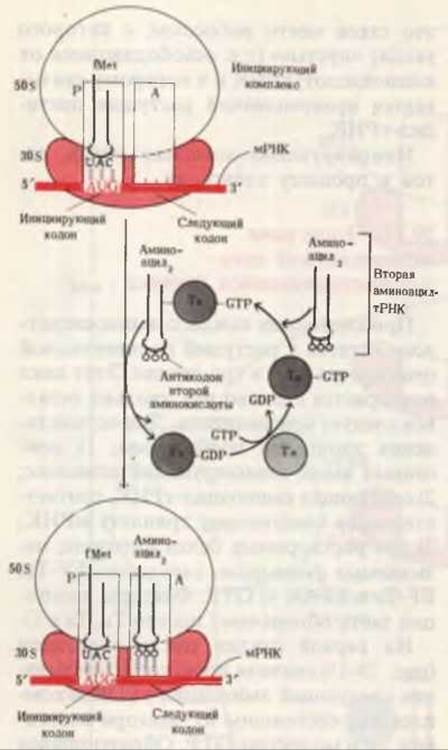
Рис. 29-15. Первая стадия элонгации - связывание второй аминоацил-тРНК, которая поступает в рибосому в комплексе с фактором элонгации Tu, содержащим связанный GTP. Присоединение второй аминоацил-тРНК сопровождается гидролизом связанного GTP. Образующийся при этом связанный GDP вновь превращается в GTP в ходе реакции, катализируемой фактором элонгации Ts. Нуклеотиды антикодона следующей аминокислоты обозначены кружками.
На второй стадии цикла элонгации образуется новая пептидная связь между аминокислотами, чьи тРНК расположены в А- и P-участках рибосомы. Этот процесс осуществляется в результате переноса инициирующего N-формилметионинового остатка от несущей его тРНК к аминогруппе новой аминокислоты, которая только что попала в А-участок. Этот перенос катализируется пептидилтрансферазой, особым белком, входящим в состав 50S-субчастицы (рис. 29-16). В результате этой реакции в A-участке образуется дипептидил-тРНК, а в P-участке остается “пустая”, ненагpyженная инициирующая тРНКfMet.
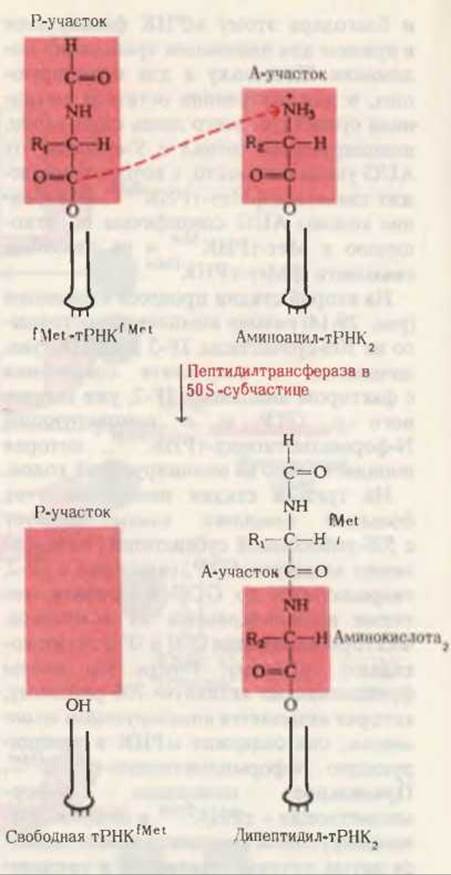
Рис. 29-16. Образование первой пептидной связи. N-формилметионильная группа переносится на аминогруппу второй аминоацил-тРНК; в результате в A-участке оказывается дипептидил-тРНК.
На третьей стадии цикла элонгации рибосома перемещается вдоль мРНК по направлению к ее 3'-концу на расстояние в один кодон (т. е. на три нуклеотида). Поскольку дипептидил-тРНК по-прежнему остается связанной со вторым кодоном мРНК, движение рибосомы приводит к перемещению дипептидил-тРНК из A-участка в P-участок, в результате чего предыдущая, уже свободная тРНК отделяется от P-участка и уходит обратно в цитозоль. Теперь в A-участке находится третий кодон мРНК, а второй кодон оказывается в P-участке. Передвижение рибосомы вдоль мРНК называется транслокацией; на этой стадии необходим фактор элонгации G (называемый также транслоказой) и гидролиз еще одной молекулы GTP (рис. 29-17). На этой стадии, вероятно, происходит изменение конформации всей рибосомы, способствующее передвижению ее по мРНК к следующему кодону в направлении к 3'-концу матрицы. Процесс транслокации обеспечивается энергией за счет гидролиза GTP.
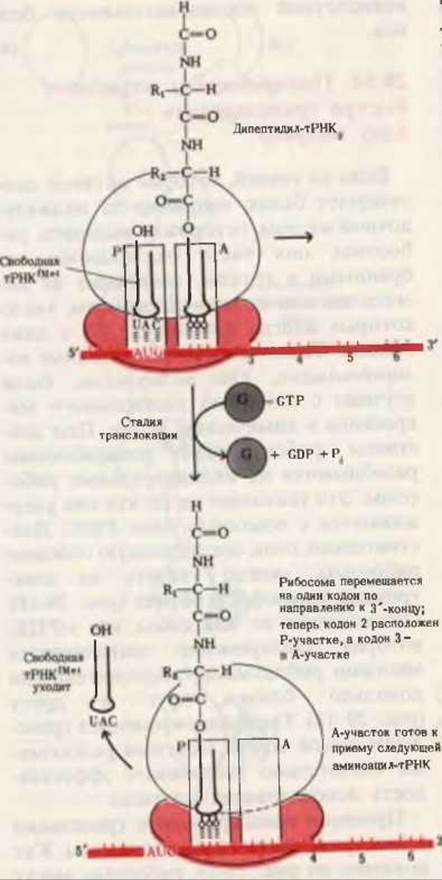
Рис. 29-17. Стадия транслокации. Рибосома передвигается на один кодон вперед в направлении 3'-конца мРНК за счет энергии, выделяющейся при гидролизе GTP, связанного с фактором элонгации G. Дипептидил-тРНК2 перемещается в P-участок рибосомы, освобождая A-участок для следующей аминоацил-тРНК3.
Теперь рибосома вместе с прикрепленными к ней дипептидил-тРНК и мРНК готова к следующему циклу элонгации, т. е. к присоединению третьего аминокислотного остатка; осуществляется это точно так же, как присоединение второго остатка. На присоединение каждой аминокислоты затрачиваются две молекулы GTP, которые гидролизуются до GDP и Рі. По мере движения рибосомы от кодона к кодону вдоль мРНК к ее 3'-концу аминокислотные остатки один за другим добавляются к растущей полипептидной цепи, которая все это время остается связанной с тРНК, соответствующей последней включенной аминокислоте.