Основы биохимии Том 3 - А. Ленинджер 1985
Молекулярные механизмы передачи генетической информации
Синтез белка и его регуляция
Полипептидные цепи претерпевают сворачивание и процессинг
Как мы видели в гл. 7 и 8, белок остается биологически неактивным до тех пор, пока он не свернется с образованием присущей ему нативной конформации, которая определяется аминокислотной последовательностью. В какой-то момент — во время синтеза полипептидной цепи или после его завершения - белок самопроизвольно принимает свою нативную конформацию (разд. 8.6 и 8.7), т. е. линейная или одномерная генетическая информация, содержавшаяся в матричной РНК, преобразуется в специфическую трехмерную структуру новосинтезированного полипептида. Однако часто новообразованная полипептидная цепь не может принять окончательную биологически активную конформацию, пока она не подвергнется процессингу или ковалентной модификации. Изменения в ходе этих процессов получили название посттрансляционной модификации.
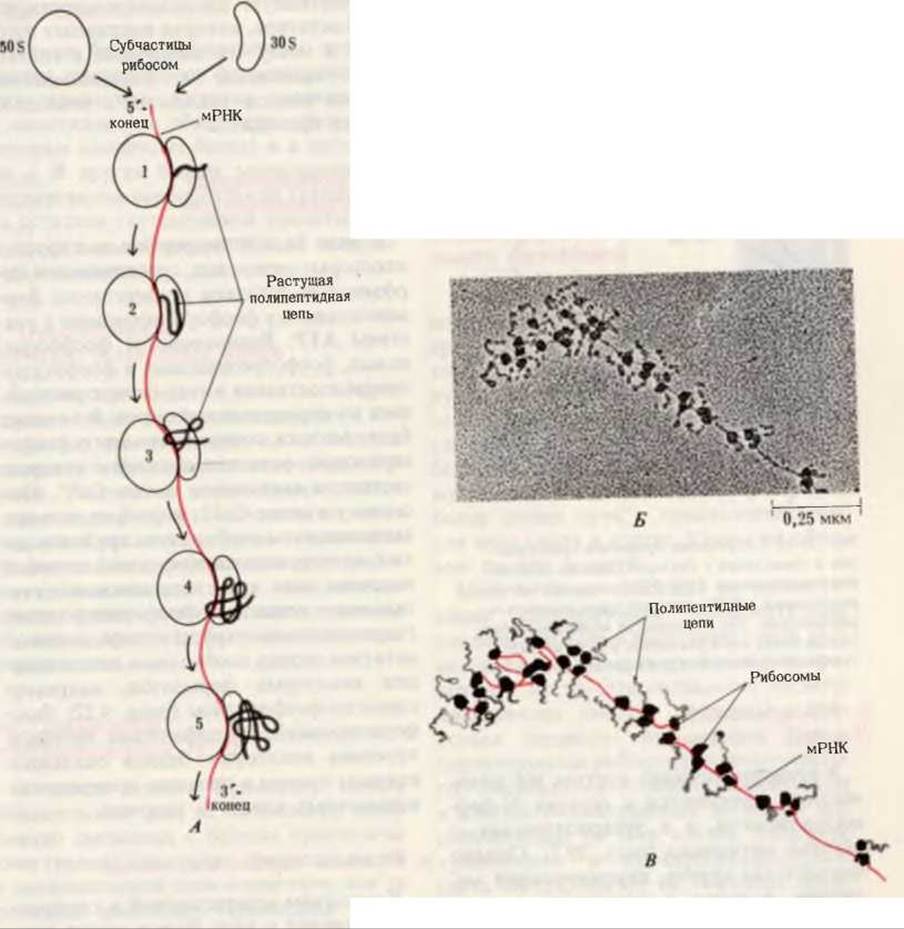
Рис. 29-18. Полирибосома. А. Пять рибосом одновременно считывают информацию, содержащуюся в молекуле мРНК, передвигаясь по ней от 5'- к 3'-концу. Б. Электронная микрофотография полирибосомы из прядильной железы тутового шелкопряда. мРНК, кодирующая фиброин шелка, транслируется одновременно большим числом рибосом. По мере движения рибосом к 3'-концу мРНК полипептидные цепи становятся все длиннее. В. Схема, поясняющая электронную микрофотографию Б.
У различных белков процессинг протекает по-разному.
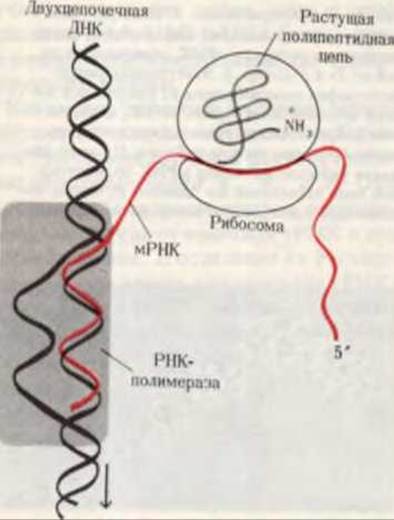
Рис. 29-19. Сопряжение процессов транскрипции и трансляции у бактерий. Еще до окончания транскрипции ДНК РНК-полимеразой образующаяся мРНК начинает транслироваться рибосомами. Это оказывается возможным благодаря тому, что в бактериях мРНК не надо транспортировать из ядра в цитоплазму.
а. Модификация N-конца и С-конца
В прокариотических клетках все полипептиды начинаются с остатка N-формилметионина, а в эукариотических - с остатка метионина (разд. 29.7). Однако формильная группа, инициирующий метионин, а часто и несколько следующих за ним аминокислотных остатков иногда удаляются с помощью особых ферментов и, таким образом, не обнаруживаются в окончательно сформированном белке.
В некоторых белках после трансляции ацетилируется аминогруппа N-концевого остатка, в других модификации подвергается С-концевой остаток.
б. Удаление сигнальных последовательностей
Как мы увидим ниже, некоторые белки содержат на N-конце дополнительную полипептидную последовательность из 15-30 остатков, которая направляет этот белок к месту его назначения в клетке. Такие сигнальные последовательности в конце концов удаляются с помощью особых пептидаз.
в. Фосфорилирование гидроксиаминокислот
В ряде белков гидроксильные группы некоторых сериновых, треониновых и тирозиновых остатков подвергаются ферментативному фосфорилированию с участием АТР. Возникновение фосфосериновых, фосфотреониновых и фосфотирозиновых остатков в этих белках увеличивает их отрицательный заряд. В казеине, белке молока, содержится много фосфосериновых остатков, функция которых состоит в связывании ионов Са2+. Поскольку и ионы Са2+, и фосфат, а также аминокислоты необходимы грудным детям, казеин молока представляет собой источник этих трех незаменимых питательных веществ. Фосфорилирование гидроксильных групп определенных остатков серина необходимо для активации некоторых ферментов, например гликоген-фосфорилазы (разд. 9.22). Фосфорилирование специфических остатков тирозина некоторых белков оказалось важным этапом в процессе превращения нормальных клеток в раковые.
г. Реакции карбоксилирования
К остаткам аспарагиновой и глутаминовой кислот в ряде белков могут присоединяться дополнительные карбоксильные группы. Например, белок системы свертывания крови протромбин содержит в своей N-концевой области несколько остатков у-карбоксиглутаминовой кислоты (гл. 24), которые включаются в белок при помощи фермента, зависимого от витамина К. Карбоксильные группы связывают ионы Са2+, необходимые для запуска механизма свертывания крови.
д. Метилирование групи
В ряде белков определенные остатки лизина подвергаются ферментативному метилированию. Остатки монометил- и диметиллизина обнаруживаются в некоторых мышечных белках и в цитохроме с. В других белках метилированию подвергаются карбоксильные группы ряда остатков глутаминовой кислоты, что приводит к нейтрализации их отрицательных зарядов.
е. Присоединение боковых углеводных цепей
Боковые углеводные цепи гликопротеинов ковалентно присоединяются к полипептиду во-время или после синтеза последнего. В одних гликопротеинах боковая углеводная цепь прикрепляется с помощью ферментов к остаткам аспарагиновой кислоты, в других - серина или треонина. Многие белки, которые работают вне клетки, а также “смазочные” протеогликаны, покрывающие слизистые оболочки, содержат боковые олигосахаридные цепи.
ж. Подавление простатических групп
В состав многих ферментов входят обязательные для их активности ковалентно связанные с белком простетические группы; они также присоединяются к полипептидной цепи после того, как та покидает рибосому. Примерами таких простетических групп могут служить молекула биотина, ковалентно связанная с ацетил-СоА-карбоксилазой (разд. 21.2), и гемовая группа цитохрома с (разд. 17.10).
з. Образование бисульфидных мостиков
Во многих белках, предназначенных для выхода из эукариотической клетки, в процессе формирования их нативной конформации появляются поперечные сшивки в результате ферментативного образования дисульфидных мостиков между остатками цистина; эти мостики соединяют друг с другом две полипептидные цепи или две части одной цепи (разд. 6.8). Поперечные дисульфидные мостики помогают уберечь нативную конформацию белковой молекулы от денатурации.