Основы биохимии Том 3 - А. Ленинджер 1985
Некоторые аспекты биохимии человека
Гормоны
Адреналин стимулирует образование циклического аденозинмонофосфата
В начале 50-х годов Сэзерленд обнаружил, что добавление адреналина к интактным срезам печени, суспендированным в буферной среде, увеличивает скорость распада гликогена и способствует высвобождению свободной глюкозы в среду. Когда он подверг экстракции обработанную адреналином печеночную ткань и измерил активность ферментов, участвующих в распаде гликогена до глюкозы, оказалось, что активность гликоген-фосфорилазы в этом экстракте резко возросла по сравнению с экстрактом интактных срезов печени. Исходя из этих данных, Сэзерленд заключил, что скорость гликогенолиза лимитируется активностью гликоген-фосфорилазы, катализирующей процесс расщепления гликогена до глюкозо-1-фосфата, и что активность этого фермента возрастает при воздействии адреналина на ткань печени. Однако, когда он добавил адреналин к препарату очищенной гликоген-фосфорилазы, никакого повышения активности фермента обнаружить не удалось. Отсюда следовало, что стимулирующий эффект адреналина на фосфорилазу был не прямым, а зависел от каких-то факторов, присутствующих в интактных печеночных клетках.
Вместе с тем активность гликоген-фосфорилазы в гомогенате значительно возрастала при добавлении адреналина к гомогенату ткани печени в присутствии АТР и ионов Mg2+. Было показано, что этот эффект реализуется в две стадии. На первой стадии, требующей присутствия АТР и ионов Mg2+, адреналин, воздействуя на мембранную фракцию гомогената печени, вызывает образование в ней растворимого термостабильного стимулирующего фактора. На второй стадии, также требующей участия АТР, под действием термостабильного фактора, образующегося на первой стадии, неактивная форма фосфорилазы - фосфорилаза b (разд. 15.12), локализованная в растворимой части гомогената печени, превращается в активную форму - фосфорилазу а. Этот фактор, стимулирующий активацию фосфорилазы и в нормальных условиях присутствующий в клетках в ничтожных количествах, был в конце концов выделен в кристаллическом виде. Анализ показал, что он содержит аденин, рибозу и фосфат в соотношении 1:1:1. Напрашивалось предположение, что он возникает непосредственно из того АТР, присутствие которого необходимо для его образования. В 1960 г. было установлено, что этот фактор является не чем иным, как 3',5'-циклической адениловой (аденозинмонофосфорной) кислотой, т. е. производным адениловой кислоты, которое до тех пор никогда не обнаруживалось в биологическом материале. В циклическом аденозинмонофосфате единственная фосфатная группа образует эфирные связи с двумя гидроксильными группами рибозы, а именно с 3'- и 5'-гидроксилами. Следовательно, это соединение представляет собой циклический фосфодиэфир (рис. 25-9). Было показано, что добавление очень малых количеств циклического аденозинмонофосфата (сАМР) к растворимым экстрактам печени действительно вызывает в присутствии АТР образование фосфорилазы а из менее активной фосфорилазы b.
Как показали дальнейшие исследования Сэзерленда и сотрудников, адреналин резко стимулирует Mg2+-зависимое превращение АТР во фракции плазматических мембран печеночных клеток. Это превращение состоит в отщеплении неорганического пирофосфата и образовании сАМР:
![]()
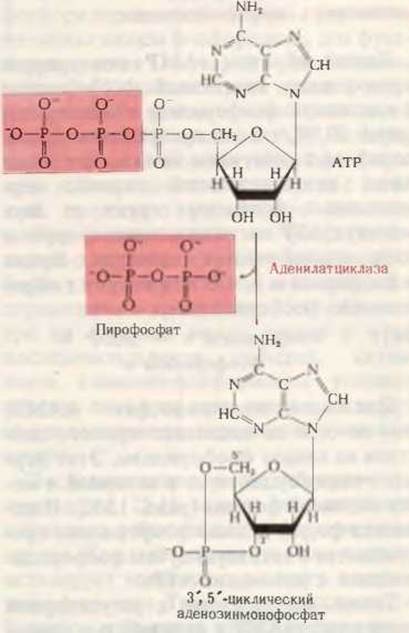
Рис. 25-9. Ферментативное образование 3',5'- циклического аденозинмонофосфата (сАМР) из АТР. Отщепление пирофосфата от АТР приводит к замыканию шестичленного кольца, включающего а-фосфатную группу. В итоге фосфатная группа образует сложноэфирные связи с 3'- и 5'-гидроксильными группами рибозы.
Фермент, катализирующий эту реакцию,- аденилатциклаза - был обнаружен затем во многих животных тканях. Он прочно связан с внутренней поверхностью плазматической мембраны и поэтому с трудом поддается экстракции и переходу в растворенную форму. Итак, связывание адреналина (первичного передатчика) с рецепторными участками на поверхности клетки способствует образованию в клетке сАМР (вторичного передатчика сигнала), который в свою очередь способствует активации гликоген-фосфорилазы.