Основы биохимии Том 3 - А. Ленинджер 1985
Некоторые аспекты биохимии человека
Гормоны
Фосфодиэстераза инактивирует циклический аденозинмонофосфат
До тех пор пока животное чувствует себя в опасности и мозговой слой его надпочечников выбрасывает в кровь адреналин, аденилатциклазная система печени остается полностью активированной. В результате концентрация сАМР в клетках-мишенях поддерживается на относительно высоком уровне, что обеспечивает высокую скорость распада гликогена. Но как только опасность исчезает, секреция адреналина прекращается и его содержание в крови быстро падает в результате ферментативного расщепления в печени. По мере того как рецепторы адреналина становятся незанятыми, аденилатциклаза возвращается в неактивное состояние и образование сАМР прекращается. Оставшийся в клетке сАМР разрушается под действием фосфодиэстеразы (рис. 25-13)-фермента, катализирующего гидролиз 3'-фосфатной связи в сАМР с образованием свободного 5'-аденозин- монофосфата (5'-АМР):
![]()
По мере уменьшения содержания сАМР в цитозоле происходит высвобождение сАМР, связанного с регуляторными субъединицами протеинкиназы. В результате регуляторные субъединицы соединяются вновь с каталитическими и протеинкиназа переходит в неактивную форму. Фосфорилированная форма киназы фосфорилазы далее подвергается дефосфорилированию так же, как фосфорилаза а, под действием фосфатазы фосфорилазы. Все это возвращает систему гликогенолиза в исходное состояние. Одновременно происходит реактивация гликоген-синтазы путем ее дефосфорилирования.
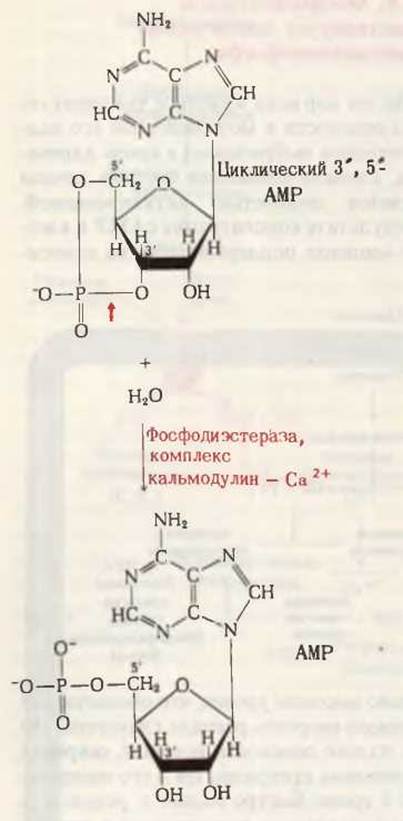
Рис. 25-13. Действие фосфодиэстеразы на сАМР. Фосфодиэстераза многих тканей активируется ионами Са2+. Этот эффект непрямой; сначала ионы Са2+ связываются с регуляторным белком кальмодулином, а затем комплекс Са2+ - кальмодулин присоединяется к фосфодиэстеразе, вызывая активацию фермента.
Характерной особенностью фосфодиэстеразы является то, что она ингибируется кофеином и теофиллином - алкалоидами, содержащимися в небольших количествах в кофе и чае соответственно. Эти алкалоиды пролонгируют или усиливают действие адреналина путем снижения скорости распада сАМР. В ряде тканей фосфодиэстераза активируется ионами Са2+. Этот эффект обусловлен связыванием ионов Са2+ со специфическим Са2+-связывающим белком, называемым кальмодулином. Комплекс Са2+-кальмодулин присоединяется к фосфодиэстеразе и активирует ее. Кальмодулин представляет собой недавно открытый Са2+-связывающий белок, широко распространенный во всем животном мире. Почти у всех видов животных кальмодулин имеет одну и ту же аминокислотную последовательность, т.е. в эволюционном смысле это один из наиболее древних и в высшей степени консервативных животных белков. Концентрация ионов Са2+ в цитозоле регулирует многие функции клетки; в силу этого ионы Са2+, подобно сАМР, играют важную регуляторную роль как вторичный посредник. Кальмодулин участвует в передаче сигнала, вызывающего увеличение концентрации ионов Са2+ в цитозоле, путем образования комплекса Са2+ - кальмодулин; далее этот комплекс связывается со специфическим Са2+-регулируемым белком, стимулируя его активность (рис. 25-14).
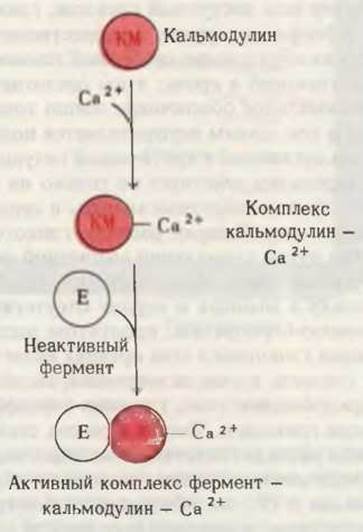
Рис. 25-14. Кальмодулин играет роль медиатора во многих ферментативных реакциях и системах мембранного транспорта, активируемых ионами Са2+.
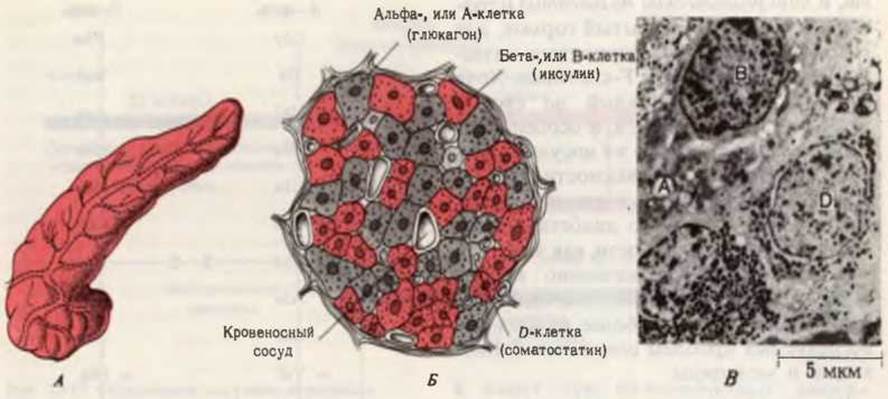
Рис. 25-15. Эндокринная ткань поджелудочной железы. Помимо экзокринных, или ацинарных, клеток, синтезирующих пищеварительные ферменты в форме их зимогенов (гл. 24), в поджелудочной железе имеется эндокринная ткань, называемая островками Лангерганса. Островковая ткань состоит из клеток разных типов, выделяющих специфические полипептидные гормоны. А. Общий вид поджелудочной железы. Б. Схематическое изображение островка Лангерганса; показаны типы клеток, перечисленные в табл. 25-5. В. Электронная микрофотография участка островка Лангерганса из поджелудочной железы человека. Видны А- Ви D-клетки.