ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
26. МЕТАБОЛИЗМ РНК
26.2. Процессинг РНК
Многие молекулы РНК бактерий и практически все молекулы РНК эукариот после синтеза подвергаются в той или иной степени процессингу. В метаболизме РНК интересные превращения происходят именно в ходе постсинтетического процессинга. Удивительно, что некоторые ферменты, катализирующие эти реакции, состоят из РНК, а не из белка. Открытие таких каталитических РНК, называемых рибозимами, произвело революцию в наших представлениях о функции РНК и о происхождении жизни.
Вновь синтезированная молекула РНК называется первичным транскриптом. Вероятно, наиболее интенсивному процессингу подвергаются первичные транскрипты мРНК эукариот и тРНК бактерий и эукариот. Молекулы РНК со специфическими функциями также подвергаются процессингу.
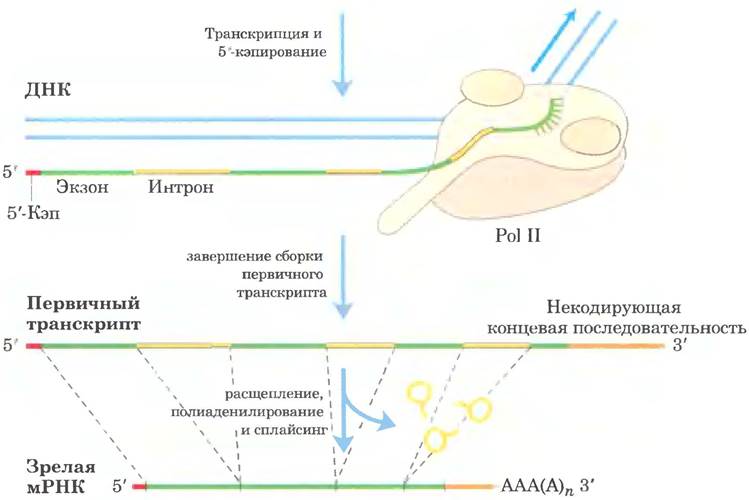
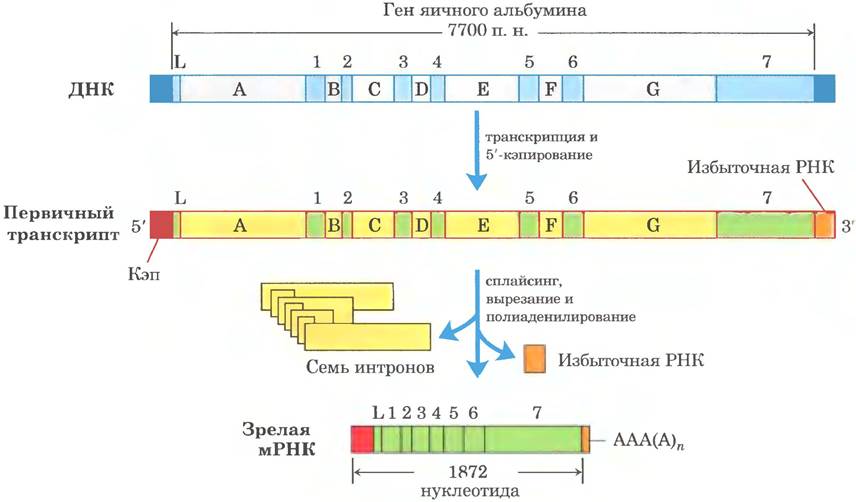
Первичные транскрипты эукариотических мРНК обычно содержат один ген, но последовательности, кодирующие полипептид, могут быть разделены другими фрагментами. Эти некодирующие участки, которые прерывают кодирующие последовательности, называют интронами, а кодирующие участки — экзонами (об интронах и экзонах в ДНК см. в гл. 24). В процессе сплайсинга интроны удаляются из первичного транскрипта, а экзоны соединяются с образованием непрерывной последовательности, которая соответствует функциональному полипептиду. Кроме того, модифицируются концы эукариотической мРНК. К 5'-концу присоединяется модифицированный остаток, называемый 5'-кэпом. 3'-Конец отщепляется, а взамен присоединяется последовательность из 80-250 остатков А, образующая поли(А)- «хвост». Иногда сложные белковые комплексы, которые принимают участие в каждой из этих трех реакций процессинга мРНК, действуют не самостоятельно, а связываются друг с другом и с фосфорилированной CTD-последовательностью Pol II; каждый комплекс влияет на функции других. Другие белки, участвующие в транспорте мРНК в цитоплазму, связаны с мРНК и в ядре, и процессинг транскрипта связан с его транспортом. В сущности, синтезированная эукариотическая мРНК находится в сложном многокомпонентном комплексе, состоящем из десятков белков. Состав комплекса изменяется по ходу процессинга первичного транскрипта, транспорта в цитоплазму и высвобождения мРНК на рибосоме для трансляции. Эти белковые комплексы модулируют активность и перемещение мРНК. Данные процессы отражены на рис. 26-12 и подробнее описаны ниже.
Рис. 26-12. Образование первичного транскрипта и его процессинг в ходе созревания мРНК в эукариотических клетках. Перед завершением синтеза первичного транскрипта на 5'-конце появляется кэп (показан красным цветом). Некодирующая последовательность (интрон), расположенная за последним экзоном, выделена оранжевым цветом. Сплайсинг может происходить либо до, либо после стадий расщепления и полиаденилирования. Все изображенные здесь процессы происходят в ядре.
Первичные транскрипты прокариотических и эукариотических тРНК в результате процессинга теряют концевые последовательности (отщепление), а иногда и интроны (сплайсинг). Многие основания и сахара в тРНК модифицируются; зрелая тРНК содержит много необычных оснований, которые не были обнаружены в других нуклеиновых кислотах (см. рис. 26-23). Многие РНК со специальной функцией также подвергаются сложному процессингу, часто с удалением фрагментов с одного или обоих концов последовательности.
Рис. 26-13. 5'-Кэп на мРНК. а — почти во всех молекулах эукариотической мРНК к 5'-концу необычной 5',5'-трифосфатной связью присоединен остаток 7-метилгуанозина (m7G). Часто в положении 2' первого и второго нуклеотидов также обнаруживаются метильные группы (показаны розовым цветом). Молекулы РНК в клетках дрожжей не имеют 2'-метильных групп. Во втором нуклеотиде 2'-метильная группа обычно встречается только в РНК у позвоночных. б — формирование 5'-кэпа происходит за 4-5 отдельных стадий (adoHcy — S-аденозилгомоцистеин). в — синтез кэпа осуществляют ферменты, связанные с С-концевой последовательностью (CTD) полимеразы II. Кэп связан с CTD через кэп- связывающий комплекс (СВС).

Итак, все молекулы РНК подвергаются полному регулируемому расщеплению. Скорость оборота молекул РНК определяет их стационарное содержание в клетке и скорость, с которой клетки могут остановить экспрессию гена, в продукте которого больше не нуждаются. Например, в ходе развития многоклеточных организмов определенные белки экспрессируются только на одной стадии развития, и молекулы мРНК, кодирующие эти белки, образуются и разрушаются в строго определенное время.
К 5'-концу эукариотической мРНК присоединяется кэп
У эукариот в большинстве молекул мРНК имеется 5'-кэп — остаток 7-метилгуанозина, связанный с 5'-концевым остатком мРНК через необычную 5', 5'-трифосфатную связь (рис. 26-13). Функция 5'-кэпа — защита мРНК от рибонуклеаз. Кроме того, кэп соединяется со специфическим кэп-связывающим комплексом белков и участвует во взаимодействии мРНК с рибосомой для инициации трансляции (гл. 27).
5'-Кэп образуется путем конденсации молекулы GTP с трифосфатом на 5'-концс транскрипта. Затем гуанин метилируется по положению N-7, кроме того, метилированию часто подвергаются 2'-гидроксильные группы двух соседних с кэпом нуклеотидов (рис. 26-13, а). Метальные группы предоставляет S-аденозилметионин. Эти реакции происходят в самом начале транскрипции после присоединения первых 20-30 нуклеотидов транскрипта. Пока кэп не синтезирован, все три осуществляющих копирование фермента и через них 5'-конец самого транскрипта ассоциированы с С-концевым доменом РНК-полимеразы II. Затем копированный 5'-конец освобождается от ферментов и соединяется с кэп- связывающим комплексом (рис. 26-13, в).
Из ДНК в РНК транскрибируются и интроны, и экзоны
У бактерий полипептидная цепь обычно коллинеарна кодирующей ее последовательности ДНК, которая составляет непрерывный отрезок матрицы ДНК, необходимый для точного воспроизведения полипептида. Однако идея о том, что все гены непрерывны, была опровергнута еще в 1977 г., когда Филипп Шарп и Ричард Робертс независимо друг от друга установили, что многие гены эукариот имеют прерывистое строение и содержат некодирующие последовательности (интроны).
Подавляющее большинство генов позвоночных содержат интроны; среди немногих исключений — гены гистонов. В других эукариотах ситуация может быть различной. Во многих генах дрожжей Saccharomyces cerevisiae интронов нет, но в других видах дрожжей интроны встречаются довольно часто. Интроны также обнаружены в нескольких генах бактерий и архей. Интроны в ДНК транскрибируются РНК-полимеразами вместе с остальными частями генов. Затем интроны вырезаются из первичного транскрипта в процессе сплайсинга, а экзоны соединяются с образованием зрелой функциональной РНК. В молекулах мРНК эукариот длина большинства экзонов не превышает 1000 нуклеотидов, размер многих составляет всего лишь от 100 до 200 нуклеотидов; эти экзоны кодируют фрагменты из 30-60 аминокислот в составе более длинного полипептида. Интроны имеют размер от 50 до 20 000 нуклеотидов. Гены высших эукариот, включая человека, обычно содержат гораздо больше ДНК в составе интронов, чем в составе экзонов. Многие гены содержат интроны, в некоторых генах они исчисляются десятками.
РНК катализирует сплайсинг интронов
Существует четыре группы интронов. Интроны, относящиеся к группам I и II. различаются деталями механизма сплайсинга, но имеют одно общее удивительное свойство: они осуществляют аутосплайсинг, т. е. сплайсинг без участия ферментов белковой природы. Интроны группы I присутствуют в некоторых ядерных и митохондриальных генах и в генах хлоропластов, которые кодируют рРНК, мРНК и тРНК. Интроны группы II обычно обнаруживаются в первичных транскриптах мРНК митохондрий и хлоропластов у грибов, водорослей и растений. Интроны групп I и II также обнаружены у некоторых бактерий. Таким нитронам для сплайсинга не требуются высокоэнергетические кофакторы (такие, как АТР). Механизм сплайсинга в группах I и II включает две стадии трансэтерификации (рис. 26-14), в процессе которых 2'- или 3'-гидроксильные группы рибозы осуществляют нуклеофильную атаку на атом фосфора, и вместо старой фосфодиэфирной связи образуется новая, поддерживая энергетический баланс. Эти реакции очень напоминают реакции разрыва и воссоединения ДНК, катализируемые топоизомеразами (см. рис. 24-21) и сайт-специфическими рекомбиназами (см. рис. 25-40).
Рис. 26-14. Реакция трансэтерификации. Первая стадия сплайсинга интронов группы I. В данном примере 3'-ОН-группа молекулы гуанозина выступает в роли нуклеофила и атакует фосфодиэфирную связь между остатками U и А на стыке экзон-интрон в молекуле мРНК (см. рис. 26-15).
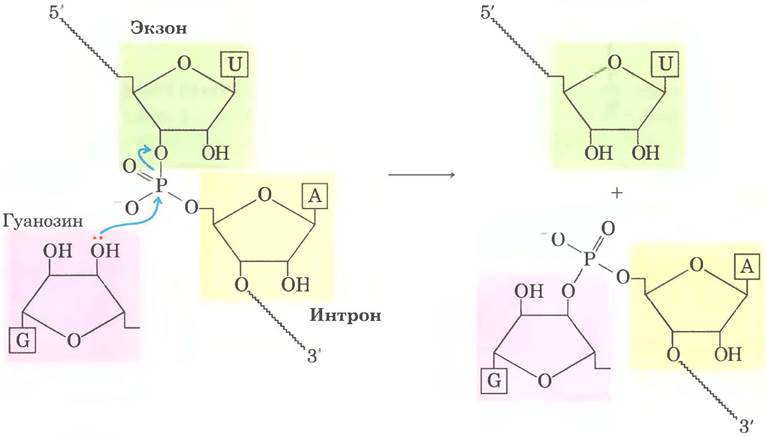
Реакция сплайсинга интронов группы I протекает с участием гуанидинового нуклеозида или нуклеотидного кофактора, но кофактор используется не в качестве источника энергии: 3'-гидроксильная группа гуанозина выступает в роли нуклеофила на первом этапе сплайсинга. 3'-Гидроксильная группа гуанозина образует обычную 3',5'-фосфодиэфирную связь с 5'-концом интрона (рис. 26-15). Затем 3'-гидроксильная группа экзона, которая на этой стадии вытесняется, выступает в роли нуклеофила в похожей реакции на 3'-конце интрона. В результате происходит точное вырезание интрона и соединение концов экзонов.
Рис. 26-15. Механизм сплайсинга интронов группы I. Нуклеофилом на первой стадии может быть гуанозин, GMP, GDP или GTP. Вырезанный интрон полностью распадается.

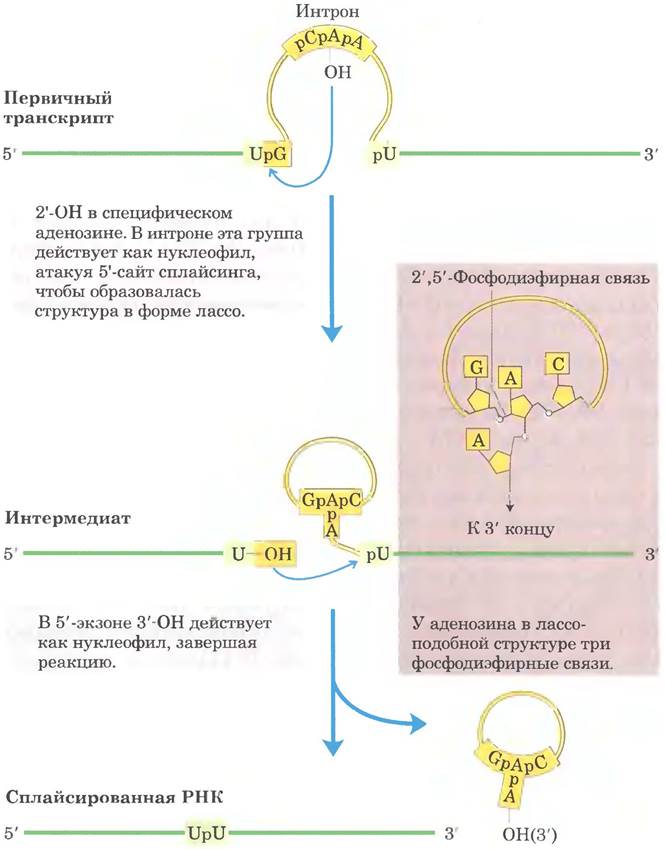
Сплайсинг интронов группы II происходит по тому же принципу, только в качестве нуклеофила на первой стадии выступает 2'-гидроксильная группа остатка А внутри интрона (рис. 26-16). В качестве интермедиата образуется разветвленная структура в форме лассо (лариат).
Рис. 26-16. Механизм сплайсинга интронов группы II. Химические принципы механизма в данном случае такие же, как и при сплайсинге интронов группы I. Отличие заключается в нуклеофиле на первой стадии и в образовании лассоподобного интермедиата, одна из ветвей которого представляет собой 2', 5'-фосфодиэфирную связь.
Аутосплайсинг интронов впервые был обнаружен Томасом Чеком с сотрудниками в 1982 г. при изучении механизма сплайсинга интрона группы I в рРНК ресничного простейшего Tetrahymena thermophila. Исследователи транскрибировали содержащую нитрон ДНК Tetrahymena in vitro, используя очищенную бактериальную РНК-полимеразу. Сплайсинг РНК происходил с высокой точностью без участия ферментов Tetrahymena. Открытие молекул РНК с каталитическими функциями стало важным этапом в формировании нашего понимания устройства биологических систем.

Большинство интронов не подвергаются аутосплайсингу и не обозначаются групповыми номерами. Третья и самая обширная группа интронов обнаружена в первичных транскриптах ядерной мРНК. Они называются сплайсосомными нитронами, поскольку их удаление происходит внутри крупного белкового комплекса сплайсосомы и катализируется ею. Внутри сплайсосомы интроны вырезаются по тому же механизму, что и нитроны группы II (через образование лариата). Сплайсосомы состоят из специализированных РНК-белковых комплексов — малых ядерных рибонуклеопротеинов (мяРНП). Каждый мяРНП содержит одну молекулу эукариотической РНК длиной 100-200 нуклеотидов, называемых малыми ядерными РНК (мяРНК). В реакциях сплайсинга участвуют пять мяРНК (Ul, U2, U4, U5 и U6), которые обычно в большом количестве обнаруживаются в ядрах эукариот. Белки и РНК в мяРНП высококонсервативны у всех эукариот (от дрожжей до человека).
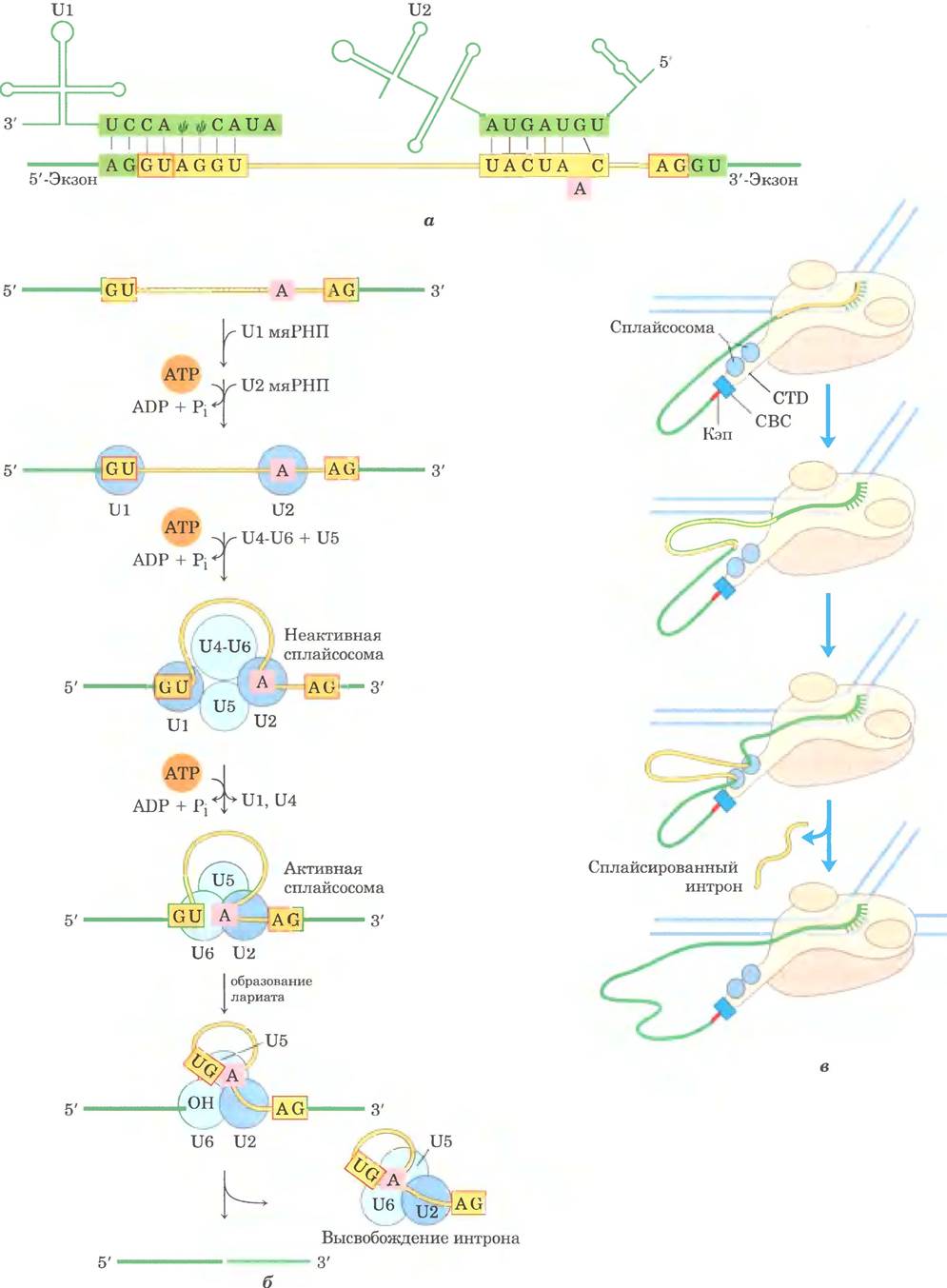
Сплайсосомные нитроны обычно имеют GU- последователыгость на 5'-конце и AG-последо- вательность на 3'-конце. Эти последовательности указывают место сплайсинга. Молекула U1- мяРНК содержит последовательность, комплементарную последовательностям вблизи 5'-концевого сайта сплайсинга интронов ядерной мРНК (рис. 26-17, а), и U1-мяРНП связывается с этой областью в первичном транскрипте. Присоединение U2, U4, U5 и U6 приводит к формированию сплайсосомы (рис. 26-17, в). За счет мяРНП сплайсосома получает пять молекул РНК и примерно 50 белков, надмолекулярная структура сплайсосомы почти такая же сложная, как у рибосомы (см. гл. 27). Еще примерно 50 белков связываются со сплайсосомой на разных стадиях сплайсинга, причем многие из этих белков участвуют в нескольких процессах, таких как сплайсинг, перенос мРНК в цитоплазму, трансляция и расщепление мРНК. Для сборки сплайсосомы требуется АТР, но реакции расщепления-лигирования РНК, по-видимому, в АТР не нуждаются. Некоторые нитроны в мРНК удаляются с помощью, менее распространенной сплайсосомы, в которой U1 и U2 заменены на U11 и U12. Сплайсосомы, содержащие U1 и U2, удаляют нитроны с (5') GU- и АС (3')-концевыми последовательностями (см. рис. 26-16), а сплайсосомы, содержащие U11 и
U12, вырезают редкие интроны группы с (5') AU- и АС (3')-концевыми последовательностями. Сплайсосомы, участвующие в сплайсинге ядерной РНК, могли эволюционировать из более древних интронов II группы, а мяРНП заменили каталитические домены их самосплайсирующихся предков.
Некоторые элементы аппарата сплайсинга, вероятно, связаны с CTD РНК-полимеразы II, и это очень интересный механизм реакции (рис. 26-17, в). Когда синтезируется первый участок сплайсинга, он соединяется с CTD- «хвостом» сплайсосомы. Затем этим комплексом захватывается второй синтезированный участок сплайсинга, что облегчает сближение концов интрона и его вырезание. После сплайсинга интрон остается в ядре и в конце концов разрушается.
Рис. 26-17. Механизм сплайсинга в первичных транскриптах мРНК. а — спаривание участков РНК при формировании сплайсосомных комплексов. Вблизи 5'-конца U1-мяРНК есть последовательность, комплементарная сайту сплайсинга на 5'-конце интрона. Спаривание оснований U1 с этим участком первичного транскрипта помогает выявить 5'-сайт сплайсинга при сборке сплайсосомы (Ψ — псевдоуридин; см. рис. 26-24). Затем U2 связывается с участком интрона, содержащим остаток А (розовый), который осуществляет нуклеофильную атаку в реакции сплайсинга. При связывании U2-мяРНК создается петля, которая перемещается и помогает активировать аденилат, 2'-OН-группа которого может формировать лассоподобную структуру через 2', 5'-фосфодиэфирную связь, б — сборка сплайсосомы. Сначала соединяются U1- и U2-мяРНП, затем с ними связываются остальные мяРНП (комплекс U4/U6 и U5) с образованием неактивной сплайсосомы. После внутренних перестроек этот комплекс преобразуется в активную сплайсосому, из которой исключаются U1 и U4, а U6 соединяется одновременно с 5'-сайтом сплайсинга и с U2. Затем следуют каталитические стадии, аналогичные каталитическим стадиям сплайсинга интронов II группы (см. рис. 26-15). в — координация сплайсинга с транскрипцией обеспечивает механизм сближения двух сайтов сплайсинга. Подробности см. в тексте.
Интроны IV группы, найденные в некоторых тРНК, отличаются от интронов I и II групп тем, что для их сплайсинга требуются АТР и эндонуклеаза. Сплайсирующая эндонуклеаза расщепляет фосфодиэфирные связи на двух концах интрона, и два экзона соединяются по механизму, напоминающему реакцию ДНК-лигазы (см. рис. 25-17).
Сплайсосомные интроны встречаются, по- видимому, только у эукариот, а интроны других групп повсеместно. Гены с нитронами I и II групп в настоящее время обнаружены и у бактерий, и у бактериальных вирусов. Бактериофаг Т4, например, содержит несколько генов с нитронами I группы. Возможно, интроны чаще встречаются у архей, чем у бактерий.
На 3'-конце молекулы мРНК имеются характерные структуры
У эукариот в большинстве молекул мРНК на 3'-конце располагается последовательность из 80-250 остатков аденина, образующих так называемый поли(А)-«хвост» (последовательность полиаденилирования). Этот «хвост» служит для связывания одного или нескольких специфических белков. Поли(А)-«хвост» и ассоциированные с ним белки, вероятно, помогают защитить мРНК от ферментативного расщепления. Многие молекулы мРНК прокариот также имеют поли(А)- «хвосты», но эти «хвосты» скорее стимулируют распад мРНК, чем защищают ее от расщепления.
Присоединение поли(А)-«хвоста» — многостадийный процесс. Транскрипт синтезируется дальше границы участка, к которому должен быть добавлен «хвост», а потом расщепляется по этому положению с помощью эндонуклеазной активности крупного ферментного комплекса, связанного с CTD РНК-полимеразы 11 (рис. 26-18). Участок мРНК, по которому происходит расщепление, содержит два характерных элемента: консервативную последовательность (5') AAIJAAA (3'), расположенную на 10 -30 нуклеотидов выше точки расщепления (ближе к 5'-концу), и менее охарактеризованную последовательность, содержащую много остатков G и U, на расстоянии 20 40 нуклеотидов ниже точки расщепления. При расщеплении образуется свободная 3'-гидроксильная группа на конце мРНК, к которому полиаденилатполимераза немедленно присоединяет остатки А по реакции
РНК + n АТР —> РНК-(АМР)n + n РРi
где n = 80 ÷ 250. Этот фермент не нуждается в матрице, но в качестве праймера использует расщепленную мРНК.
Рис. 26-18. Добавление поли(А)-«хвоста» к первичному транскрипту РНК у эукариот. Pol II синтезирует РНК, продвигаясь дальше сигнальных последовательностей, указывающих участок расщепления, включая консервативную последовательность (5') AAUAAA, расположенную выше точки расщепления. ① Сигнальная последовательность связывается с ферментным комплексом, в состав которого входит эндонуклеаза, полиаденилатпо- лимераза и несколько других мультисубъединичных белков, участвующих в распознавании последовательности, облегчении расщепления и регуляции длины поли(А)- «хвоста». ② РНК ниже (в направлении к 3'-концу) последовательности AAUAAA расщепляется эндонуклеазой на 10-30 нуклеотидов. ③ Полиаденилатполимераза синтезирует поли(А)-«хвост» длиной 80-250 нуклеотидов, начиная с места расщепления транскрипта.

Весь комплекс реакций процессинга типичной эукариотической мРНК представлен на рис. 26-19. В некоторых случаях кодирующая область мРНК тоже подвергается «редактированию» (подробнее см. разд. 27.1). Это Moгут быть реакции внесения или удаления оснований в кодирующих областях первичных транскриптов или изменения последовательности (например, ферментативное дезаминирование остатка С. приводящее к образованию остатка U). Один из удивительных примеров процессинг у паразитических простейших трипаносом: длинные последовательности их мРНК синтезируются вообще без уридилата, а остатки U встраиваются позднее в процессе редактирования.
Рис. 26-19. Схема процессинга эукариотической мРНК. Ген яичного альбумина содержит интроны от А до G и экзоны от 1 до 7, а также последовательность L (L кодирует сигнальный пептид, направляющий белок за пределы клетки; см. рис. 27-34). В ходе процессинга удаляется примерно три четверти РНК. До остановки транскрипции Pol II успевает синтезировать первичный транскрипт значительно дальше участка расщепления и сайта полиаденилирования (избыточная РНК). Сигналы терминации для Pol II пока не обнаружены.
Альтернативный процессинг РНК приводит к образованию нескольких продуктов одного гена
Один из парадоксов современной геномики заключается в том, что сложность организмов никак не коррелирует с количеством генов, кодирующих белки, или даже с количеством геномной ДНК (с. 460 вт. 1). Однако при традиционном подходе, когда основное внимание уделяется генам белков, не учитывается сложность транскриптома организма. По мере расширения наших знаний о функциях РНК в строении генома выявляются новые сложные элементы.
Из некоторых транскриптов эукариотических мРНК образуется только одна зрелая мРНК и один соответствующий полипептид, но процессинг других может происходить несколькими способами и приводить к образованию различных мРНК и различных полипептидов. Первичный транскрипт содержит молекулярные сигналы для всех альтернативных путей процессинга, а предпочтительный для данной клетки путь определяется факторами процессинга — РНК-связывающими белками, которые запускают один конкретный путь.
Сложные транскрипты могут иметь либо более одного сайта расщепления и полиаденилирования, либо альтернативные сайты сплайсинга, либо и то, и другое. При наличии двух или нескольких сайтов расщепления и полиаденилирования, чем ближе к 5'-концу выбирается сайт, тем большая часть последовательности первичного транскрипта удаляется (рис. 26-20, а). Такой механизм, называемый выбором сайта поли(А), создает разнообразие вариабельных доменов тяжелых цепей иммуноглобулинов (см. рис. 25-46). Путем альтернативного сплайсинга на разных стадиях развития плодовой мушки (рис. 26-20, б) из общего первичного транскрипта образуются три разные формы тяжелой цепи миозина. Альтернативные варианты процессинга РНК могут использоваться одновременно для синтеза двух разных гормонов: регулирующего кальциевый обмен гормона кальцитонина в щитовидной железе крысы и пептида, связанного с геном кальцитонина (СGRР) в мозге крысы (рис. 26-21). Существует множество других вариантов альтернативного сплайсинга (рис. 26-22). Многие гены в геноме млекопитающих (возможно, большинство) подвергаются альтернативному сплайсингу, что значительно увеличивает количество кодируемых генами белков. Этот процесс у низших эукариот играет гораздо менее заметную роль, к примеру, у дрожжей лишь несколько генов подвергаются альтернативному сплайсингу.
Рис. 26-20 Два механизма альтернативного процессинга сложных транскриптов у эукариот. а — альтернативные варианты расщепления и полиаденилирования. Показаны два сайта по- лиаденилирования — А1 и А2. б — альтернативные способы сплайсинга. Показаны два разных 3'-концевых сайта расщепления. Оба механизма позволяют получить разные зрелые мРНК с одного и того же транскрипта.
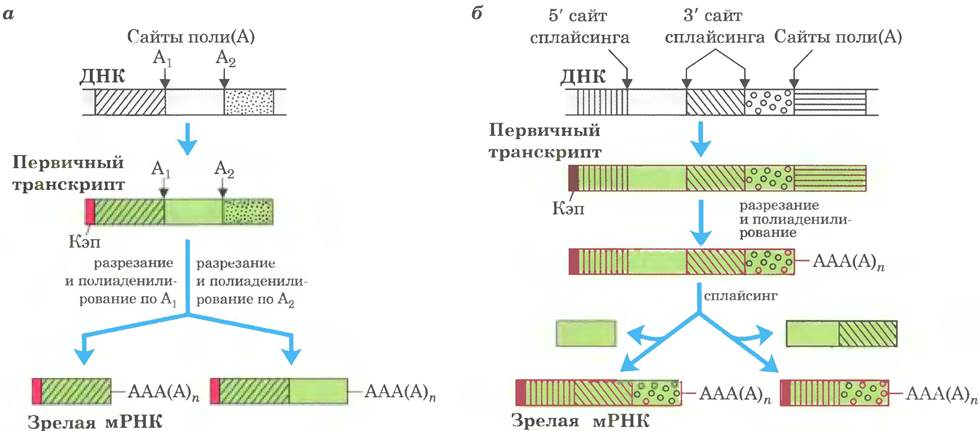
Рис. 26-21. Альтернативный процессинг транскрипта гена кальцитонина у крыс. Первичный транскрипт содержит два сайта полиаденилирования; один чаще используется в клетках мозга, другой — в щитовидной железе. В мозге при сплайсинге элиминируется экзон кальцитонина (экзон 4); в щитовидной железе этот экзон остается. Образующиеся пептиды процессируются далее с образованием конечных гормонов: связанного с геном кальцитонина пептида (СGRР) в мозге крысы и кальцитонина в щитовидной железе.

Рис. 26-22. Общая схема альтернативного сплайсинга. Экзоны изображены в виде светло- и темно-зеленых прямоугольников, а интроны и нетранслируемые области - в виде желтых линий. Звездочками отмечены позиции, по которым должен присоединяться полиаденозин. Черными линиями в левой части схемы обозначены возможные варианты соединения экзонов, приводящие к соответствующим мРНК (в правой части схемы). Варианты соединения, показанные выше и ниже транскрипта, образуют верхний или нижний продукт соответственно. Красными и оранжевыми прямоугольниками обозначены 5'-кэпы и 3'-нетранслируемые области соответственно.
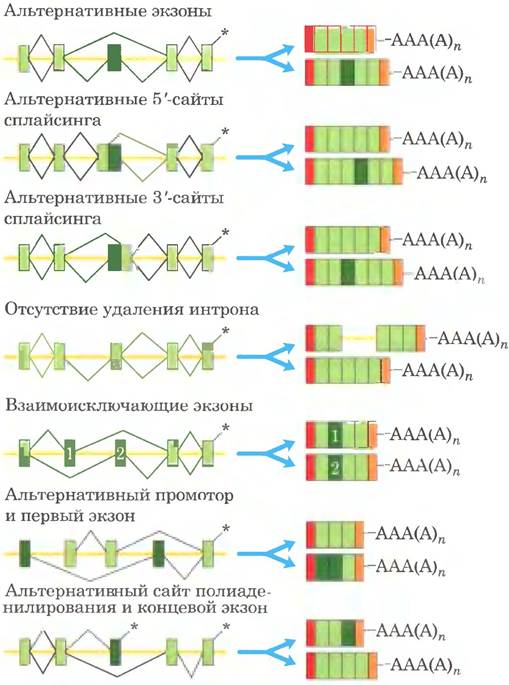
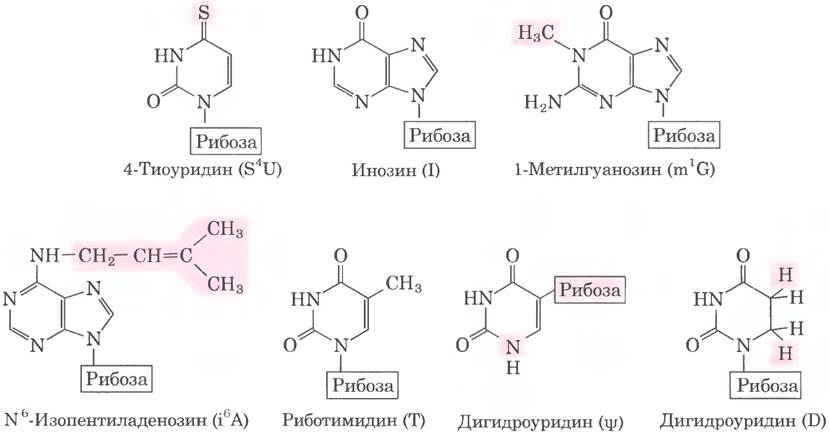
Рис. 26-23. Некоторые модифицированные основания в рРНК и тРНК, возникающие в ходе посттранскрипционных реакций. В скобках указаны сокращенные названия оснований. Обратите внимание на необычное место присоединения рибозы в псевдо- уридине. Здесь представлено лишь несколько примеров из 96 известных модификаций нуклеотидов, обнаруженных в различных РНК (на данный момент известен 81 тип модификаций в тРНК и 30 типов в рРНК). Полный список модифицированных оснований можно найти в базе данных по модификациям РНК (http://mods.rna.albany.edu/mods/).
Молекулы рРНК и тРНК также подвергаются процессингу
Посттранскрипционному процессингу подвергается не только мРНК. Рибосомные РНК в клетках прокариот, архей и эукариот образуются из более длинных предшественников, называемых прерибосомными РНК или пре-рРНК. Транспортные РНК тоже происходят из более длинных предшественников. Эти молекулы РНК также могут содержать различные модифицированные нуклеозиды; некоторые примеры представлены на рис. 26-23.
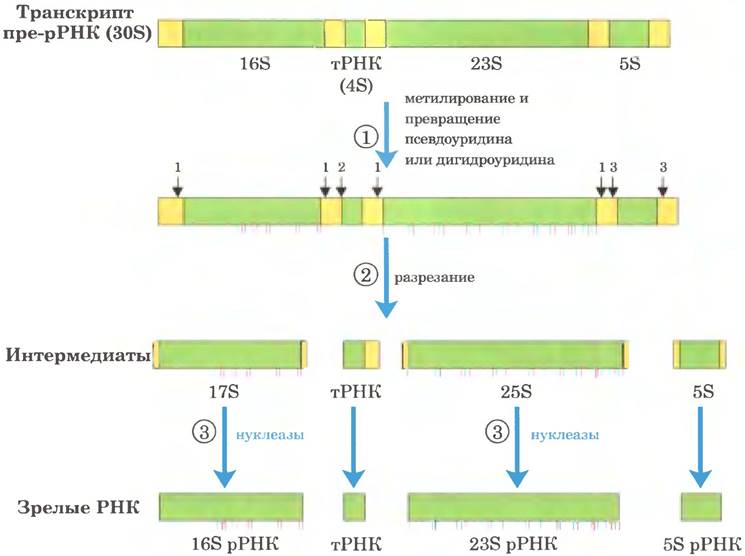
Рис. 26-24. Процессинг транскриптов пре-РНК у бактерий. ① Перед расщеплением предшественник ЗОБ РНК метилируется по определенным основаниям (красные черточки), а некоторые остатки уридина превращаются в псевдоуридин (синие черточки) или дигидроуридин (черные черточки). Метилированию иногда подвергаются основания или же 2'-гидроксильные группы. ② При расщеплении высвобождаются предшественники рРНК и тРНК. Расщепление в точках 1,2 и 3 осуществляют ферменты РНКаза III, РНКаза Р и РНКаза Е соответственно. Как объясняется далее, РНКаза Р представляет собой рибозим. ③ Конечные продукты 16S, 23S и 5S рРНК образуются в результате действия разных специфических нуклеаз. Семь копий гена пре-рРНК в хромосоме Е. соli различаются числом, расположением и типом входящих в первичный транскрипт тРНК. Некоторые копии гена несут дополнительные участки гена тРНК между сегментами 16S и 23S рРНК, а также на 3'-конце первичного транскрипта.
Рибосомные РНК.
У бактерий 16S, 23S и 5S рРНК (а также некоторые тРНК, хотя большинство тРНК кодируются в другом месте) образуются из единого предшественника — 30S РНК длиной около 6500 нуклеотидов. При процессинге от 30S РНК удаляются концевые фрагменты, а также участки между последовательностями рРНК (рис. 26-24). В 16S и 23S рРНК содержатся модифицированные нуклеозиды. У Е. coli обнаружено 11 модификаций в последовательности 16S рРНК: один псевдоуридин и 10 нуклеозидов, метилированных по основанию и/или по 2'-гидроксильной группе. В 23S рРНК содержится 10 псевдоуридинов, один дигидроуридин и 12 метилированных нуклеозидов. У бактерий каждую модификацию обычно катализирует особый фермент. В реакции метилирования в качестве кофактора используется S-аденозинметионин. Для образования псевдо- уридина кофакторов не требуется.
В геноме Е. coli закодировано семь молекул пре-рРНК. Все эти гены имеют похожие рРНК- кодирующие области, но участки, расположенные между ними, различаются. На участке между генами 16S и 23S рРНК обычно закодирована одна или две молекулы тРНК. причем из разных пре-рРНК транскриптов получаются разные тРНК. Последовательности, кодирующие молекулы тРНК, также были обнаружены на 3'-конце 5S рРНК в некоторых первичных транскриптах.
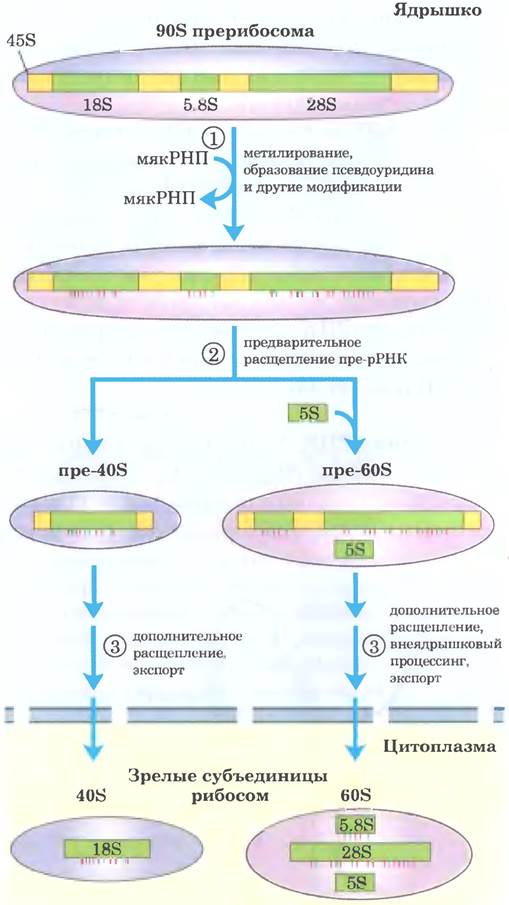
У эукариот ситуация сложнее. РНК-полимераза I синтезирует транскрипт 45S пре-рРНК, который в ядрышке расщепляется на 18S, 28S и 5,8S рРНК, характерные для эукариотических рибосом (рис. 26-25). Как и у бактерий, процессинг включает в себя реакции расщепления под действием эндо- или экзонуклеаз, а также реакции модификации нуклеозидов. В некоторых пре-рРНК есть интроны, которые нужно вырезать. Процесс в целом инициируется в ядрышке, в больших комплексах, собирающихся на предшественнике рРНК по мере его синтеза под действием Pol I. Существует тесная связь между транскрипцией рРНК, созреванием рРНК и сборкой рибосом в ядрышке. В каждом комплексе содержатся рибонуклеазы, расщепляющие предшественников рРНК, ферменты, модифицирующие определенные основания, большое количество малой ядрышковой РНК (мякРНК), направляющей модификацию нуклеозидов и некоторые реакции расщепления, а также рибосомные белки. У дрожжей в процессе участвуют пре-рРНК, более 170 нерибосомных белков, мякРНК для модификации каждого нуклеозида (всего ~70. поскольку некоторые опосредуют два типа модификаций), а также 78 рибосомных белков. У человека обнаружено еще больше модифицированных нуклеозидов — около 200, и, следовательно, больше соответствующих мякРНК. В ходе сборки рибосом состав комплексов может изменяться, и многие промежуточные комплексы не уступают по сложности самой рибосоме и мяРНК. У большинства эукариот 5S рРНК образуется другой полимеразой (Pol III) в виде независимого транскрипта.
Рис. 26-25. Процессинг транскриптов пре-РНК у позвоночных. В ходе транскрипции первичный транскрипт 45S включается в ядрышковый прерибосомный комплекс 90S, в котором происходит сопряжение процессинга рРНК и сборки рибосом. ① Предшественник 45S метилируется более чем по 100 нуклеотидам из 14 000 (по основаниям или по 2'-ОН-группам), несколько остатков уридина превращаются в псевдоуридин, а также происходят некоторые другие модификации. ② Серия ферментативных расщеплений 45S приводит к образованию 18S, 5,8S и 28S рРНК, и постепенно при присоединении рибосомных белков начинают формироваться субъединицы рибосом. В реакциях расщепления и всех реакциях модификации участвует малая ядрышковая РНК (мякРНК), входящая в состав белковых комплексов (мякРНП) в ядрышке, напоминающих сплайсосомы. Молекулы 5S рРНК образуются независимо.
При модификации нуклеозидов в эукариотической рРНК чаще всего происходят превращения уридина в псевдоуридин и adoMet- зависимое метилирование (как правило, по 2'-гидроксильной группе). Эти реакции опосредованы комплексами мякРНП — комплексами белков с мякРНК, состоящими из мякРНК и четырех или пяти белков, в том числе и осуществляющего модификацию фермента. Существует два класса таких комплексов, различающихся ключевыми консервативными элементами последовательности (боксами). Комплексы с боксом Н/АСА участвуют в образовании псевдоуридина, а комплексы с боксом С/D — в метилировании по 2'-ОН-группе. В отличие от бактерий у эукариот один и тот же фермент может участвовать в модификациях различных участков под руководством соответствующих мякРНК.
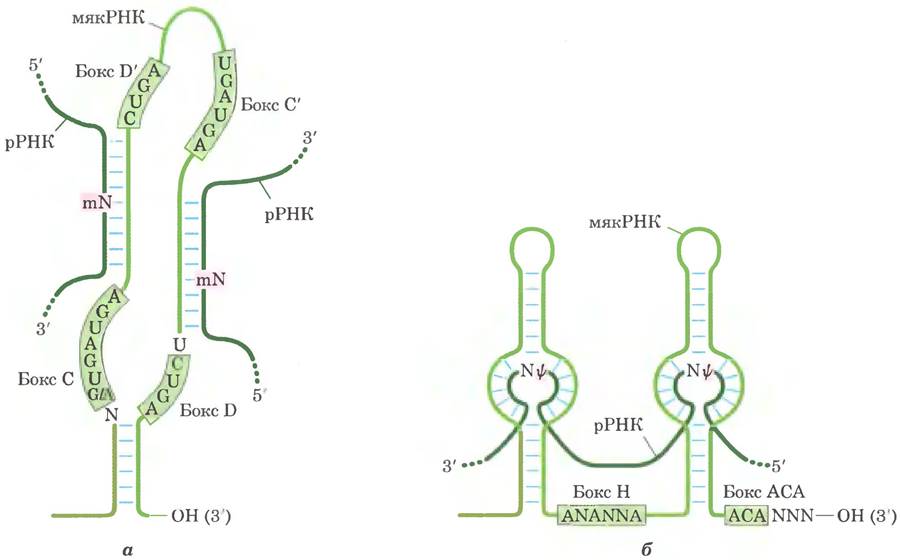
Эти мякРНК состоят из 60-300 нуклеотидов. Многие закодированы в нитронах других генов и транскрибируются совместно с этими генами. Каждая мякРНК содержит последовательность из 10-21 нуклеотидов, которая полностью комплементарна определенному участку рРНК. Консервативные последовательности в остальной части мякРНК образуют структуры, которые связываются с соответствующими белками в мякРНП (рис. 26-26).
Рис. 26-26. Роль мякРНК в модификации рРНК. а — для осуществления реакций метилирования РНК спаривается с мякРНК с боксом С/D. Участки метилирования в рРНК-мишени (темнозеленые) расположены в области спаривания с С/D-боксом мякРНК. Высококонсервативные последовательности боксов С и D (а также С' и D') являются участками связывания белков, составляющих наиболее крупный комплекс мякРНП. б — РНК спаривается с мякРНК с боксом Н/АСА для превращения уридина в псевдоуридин. Участки превращения уридина в псевдо- уридин в рРНК-мишени (зеленые) также находятся в областях, спаривающихся с мякРНК, а консервативные последовательности Н/АСА-боксов являются участками связывания белков.
Транспортные РНК.
В большинстве клеток синтезируется от 40 до 50 различных тРНК, причем эукариотические клетки содержат множество копий многих генов тРНК. Молекулы транспортной РНК образуются из более длинных предшественников путем ферментативного удаления нуклеотидов с 5'- и 3'-концов (рис. 26-27). У эукариот в транскриптах нескольких тРНК присутствуют интроны, которые должны быть удалены. Если в одном первичном транскрипте содержатся две или несколько разных тРНК, они разделяются путем ферментативного расщепления. Эндонуклеаза РНКаза Р, обнаруженная у всех организмов, удаляет РНК с 5'-конца молекул тРНК. Этот фермент содержит и белок, и РНК. РНК- компонент необходим для проявления ферментативной активности, и в бактериальных клетках фермент может осуществлять процессинг даже без участия белкового компонента. Таким образом, РНКаза Р — еще один пример каталитических РНК, действие которых более подробно рассматривается ниже. 3'-Конец молекул тРНК модифицируется одной или несколькими нуклеазами, в том числе экзонуклеазой РНКазой D.
Рис. 26-27. Процессинг тРНК у бактерий и эукариот. Проиллюстрируем важные этапы процессинга на примере дрожжевой тРНКTуr (тРНК, специфически связывающая тирозин; см. гл. 27). Нуклеотидная последовательность, показанная желтым цветом, удаляется из первичного транскрипта. Сначала происходит процессинг концов: в первую очередь 5'-конца, затем 3'-конца. Потом к 3'-концу присоединяется последовательность ССА; эта стадия необходима в процессинге эукариотической тРНК и тех бактериальных тРНК, которые не имеют этой последовательности в первичном транскрипте. Одновременно с процессингом концов происходит модификация специфических оснований в оставшейся части транскрипта (рис. 26-23). Для показанной здесь эукариотической тРНК заключительная стадия — сплайсинг интрона из 14 нуклеотидов. Интроны встречаются в некоторых эукариотических тРНК, но не обнаружены в бактериальной тРНК.

Предшественники тРНК могут подвергаться дальнейшему посттранскрипционному процессингу. 3'-Концевой тринуклеотид ССА (3'), к которому в ходе синтеза белка присоединяется аминокислота (гл. 27), отсутствует у некоторых бактериальных и у всех эукариотических предшественников тРНК и поэтому добавляется в ходе процессинга (рис. 26-27). Эту функцию выполняет тРНК-нуклеотидилтрансфераза — необычный фермент, который связывает три рибонуклеозид- трифосфата в отдельных активных центрах и катализирует формирование фосфодиэфирных связей с образованием последовательности ССА (3'). Синтез этой последовательности, таким образом, не нуждается в матрице ДНК или РНК — матрицей служит сайт связывания фермента.
Последний тип процессинга тРНК заключается в модификации некоторых оснований в реакциях метилирования, дезаминирования или восстановления (рис. 26-23). В случае псевдоуридина основание (урацил) удаляется и вновь присоединяется к остатку сахара по положению С-5. Некоторые из модифицированных оснований находятся в специфических позициях во всех молекулах тРНК (рис. 26-27).
РНК со специализированными функциями подвергаются различным вариантам процессинга
Число идентифицированных классов, специализированных РНК быстро растет, и параллельно с этим расширяются наши знания об их функциях. Многие из этих молекул РНК подвергаются процессингу.
Малая ядерная и малая ядрышковая РНК не только облегчают процессинг РНК, но и сами синтезируются в виде более крупных предшественников, а затем подвергаются процессингу. Многие мякРНК кодируются в нитронах других генов. По мере вырезания интронов из пре- мРНК белки комплекса мякРНП связываются с последовательностями мякРНК. а рибонуклеазы удаляют лишние участки РНК с 5'- и 3'-концов. Направляющиеся в сплайсосомы мяРНК синтезируются в виде пре-мяРНК с помощью РНК- полимеразы II, а рибонуклеазы удаляют лишние фрагменты РНК с обоих концов. Определенные нуклеозиды в мяРНК могут быть подвергнуты 11 разным модификациям, причем чаще всего происходит 2'-0-метилирование и превращение уридина в псевдоуридин.
МикроРНК это специализированный класс РНК, участвующих в регуляции экспрессии генов. Некодирующие последовательности этих РНК длиной около 22 нуклеотидов комплементарны определенным участкам мРНК. Они регулируют функции мРНК путем ее расщепления или подавления ее трансляции. МикроРНК обнаружены у многих многоклеточных эукариот — от червей и плодовых мушек до растений и млекопитающих. Возможно, до 1% генома человека кодирует микроРНК, причем микроРНК могут взаимодействовать с третью человеческих мРНК. Их функция в регуляции генов обсуждается в гл. 28.
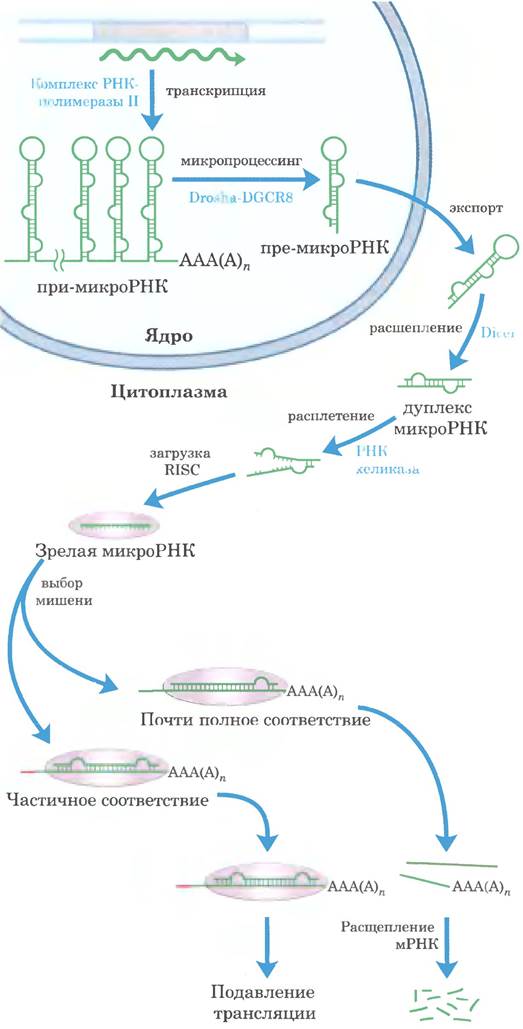
МикроРНК синтезируются из гораздо более крупных предшественников за несколько стадий (рис. 26-28). Первичные транскрипты для микроРНК (при-микроРНК) значительно различаются по размеру: некоторые закодированы в интронах других генов и экспрессируются совместно с этими генами. Их роль в регуляции генов также подробно обсуждается в гл. 28.
Рис. 26-28. Синтез и процессинг микроРНК. Первичный транскрипт микроРНК представляет собой более длинную последовательность РНК вариабельного размера, называемую при-микроРНК. В ее процессинге активную роль принимают две эндорибонуклеазы из семейства РНКаз III Drosha и Dicer. В ядре при-микроРНК сначала сокращается до предшественника микроРНК из 70-80 нуклеотидов (пре-микроРНК) в результате действия белкового комплекса, состоящего из Drosha и белка DGCR8. Далее пре- микроРНК переносится в цитоплазму, где на нее действует белок Dicer, в результате чего образуется практически зрелая микроРНК, спаренная с коротким фрагментом РНК. Эта комплементарная последовательность РНК удаляется РНК- хеликазой, и зрелая микроРНК включается в белковые комплексы, такие как RISC (от англ. RNA-induced silencing complex), которые затем связываются с мРНК-мишенью. При достаточной комплементарности микроРНК и ее мишени происходит расщепление мРНК-мишени, а если комплементарность лишь частичная, образовавшийся комплекс блокирует трансляцию мРНК-мишени.
Каталитические РНК осуществляют некоторые реакции метаболизма РНК
Исследование посттранскрнпционного процессинга молекул РНК привело к одному из самых захватывающих открытий в современной биохимии — открытию каталитических РНК (рибозимов). Лучше других охарактеризованы такие рибозимы, как аутосплайсирующиеся интроны группы I, РНКаза Р и молотоголовый рибозим (см. ниже). Активность этих рибозимов связана с двумя основными реакциями — реакцией трансэтерификации (рис. 26-14) и гидролизом фосфодиэфириых связей. Часто субстратом рибозимов является молекула РНК, которая может быть даже частью самого рибозима. Между РНК- субстратом и РНК-катализатором может происходить спаривание оснований, наилучшим образом подготавливающее субстрат к реакции.
Рис. 26-29. Молотоголовый рибозим. Вирусоподобные элементы, называемые вирусоидами, имеют маленький РНК-геном и обычно нуждаются в другом вирусе, который помогает им реплицироваться и/или упаковываться. Некоторые молекулы вирусоидных РНК содержат небольшие участки, которые запускают реакции сайт- специфического расщепления РНК, связанные с репликацией. Эти участки называются молотоголовыми рибо- зимами, поскольку их вторичная структура напоминает головку молотка, а — минимальная последовательность рибозима, обладающего каталитической активностью. Обведенные рамкой консервативные нуклеотиды необходимы для проявления каталитической активности. Стрелка указывает сайт саморасщепления. б — трехмерная структура (РDВ ID1MME, на рис. 8-25, б в т. 1 представлена в виде СРК-модели). Цепи окрашены так же, как на рис. а. Молотоголовые рибозимы относятся к металлоферментам; для проявления активности им необходимы ионы Мg2+. Фосфодиэфирная связь в сайте саморасщепления показана стрелкой. Молотоголовый рибозим
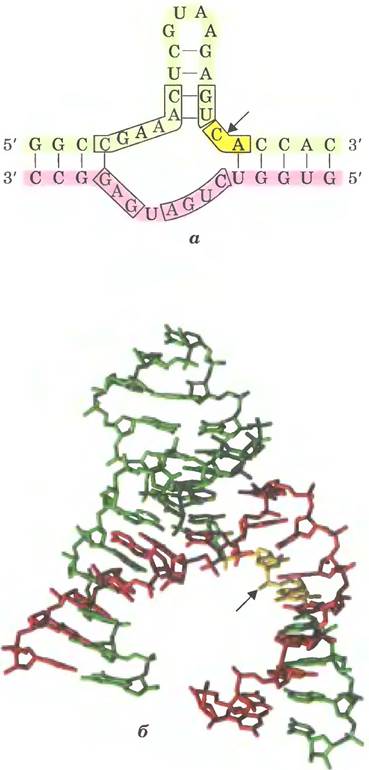
Рибозимы значительно различаются по размерам. Аутосплайсирующиеся нитроны группы I могут содержать более 400 нуклеотидов. Молотоголовый рибозим состоит из двух цепей РНК и содержит всего 41 нуклеотид (рис. 26-29). Как и в случае белковых ферментов, для функций рибозимов важное значение имеет их трехмерная структура. Рибозимы инактивируются при нагревании выше температуры плавления, в присутствии денатурующих агентов или комплементарных олигонуклеотидов, которые нарушают нормальное спаривание оснований. Рибозимы также могут инактивироваться при модификации некоторых важных нуклеотидов в их составе. Вторичная структура аутосплайсирующихся интронов группы I из предшественника 265 рРНК у Тetrahymena изображена на рис. 26-30.
Рис. 26-30. Вторичная структура аутосплайсирующегося интрона рРНК из Tetrahymena. Последовательности интрона отмечены желтым цветом, экзона — зеленым. Желтыми линиями обозначены связи между соседними нуклеотидами в последовательности (это вынужденная мера, позволяющая представить объемную молекулу в двух измерениях; длинная голубая линия между остатками С и G - нормальное спаривание оснований); изображены все нуклеотиды последовательности. Каталитическое ядро, обладающее аутосплайсирующей активностью, выделена серым прямоугольником. Некоторые участки со спаренными основаниями пронумерованы (Р1, Р3, Р2.1, Р5а и т. п.) в соответствии с принятыми договоренностями для данной молекулы РНК. В области Р1, которая содержит внутреннюю адаптерную последовательность (в рамке), находится 5'-конец интрона (красная стрелка). Часть этой последовательности спаривается с 3'-концом экзона, что приводит к непосредственному контакту 3'- и 5'-сайтов сплайсинга (красная и голубая стрелки). Трехмерная структура крупного фрагмента этого интрона показана на рис. 8-25, в т. 1.

Ферментативные свойства интронов группы I
Кроме способности повышать скорость реакции, аутосплайсирующиеся нитроны группы I имеют и другие общие с ферментами свойства, в том числе кинетическое поведение и специфичность. Связывание гуанозинового кофактора (рис. 26-14) с интроном I группы из рРНК Тetrahymena (рис. 26-26) достигает насыщения (Км ≈ 30 мкмоль/л) и подвержено конкурентному ингибированию 3'-дезоксигуанозином. Интрон очень точно осуществляет реакцию расщепления, в основном благодаря так называемой внутренней адаптерной последовательности, которая может спариваться с последовательностями экзона вблизи 5'-сайта сплайсинга (рис. 26-30). Такое спаривание способствует правильному расположению специфических связей, которые подвергаются расщеплению и воссоединению.
Поскольку интрон сам химически изменяется во время реакции сплайсинга (его концы расщепляются), казалось бы, он лишен важнейшей характеристики фермента — способности многократно осуществлять катализ. Детальное исследование показало, что нитрон из 414 нуклеотидов, вырезанный из рРНК Tetrahymena, может (in vitro) действовать как истинный фермент (in vivo он быстро разрушается). Серия внутримолекулярных реакций циклизации и расщепления в вырезанном интроне приводит к удалению 19 нуклеотидов с его 5'-конца. Линейная РНК из оставшихся 395 нуклеотидов (названная L-19 IVS от англ. intervening sequence lacking 19 nucleotides) способствует реакциям переноса нуклеотидов, в которых некоторые олигонуклеотиды удлиняются за счет других (рис. 26-31). Самыми хорошими субстратами этой РНК являются такие олигонуклеотиды, как синтетический олигомер (С)5, который может спариваться с такой же богатой гуанином внутренней адаптерной последовательностью, которая ориентировала 5'-конец экзона для аутосплайсинга.
Рис. 26-31. Каталитическая активность L-19 IVS in vitro, a — L-19 IVS образуется путем аутокаталитического удаления 19 нуклеотидов с 5'-конца, вырезаемого интрона у Tetrahymena. Сайт расщепления во внутренней адаптерной последовательности (в рамке) показан стрелкой. Остаток G (на розовом фоне), присоединенный на первой стадии реакции сплайсинга (см. рис. 26-15), входит в удаляемую последовательность. Часть внутренней адаптерной последовательности остается на 5'-конце L-19 IVS. б — L-19 IVS удлиняет некоторые олигонуклеотиды РНК за счет других в цикле реакций трансэтерификации (стадии ①-④). Ключевую роль в этом цикле играет группа 3'-ОН в остатке G на 3'-конце L-19 IVS (следует подчеркнуть, что это не остаток G, добавленный в процессе сплайсинга). Одним из лучших субстратов рибозима оказывается (С)5, поскольку он может связываться с адаптерной последовательностью, сохраняющейся в интроне. Хотя такая каталитическая активность не реализуется в клетке, она имеет большое значение для формирования современной гипотезы эволюции, которая обсуждается в конце данной главы.

Ферментативная активность рибозима L-19 IVS проявляется в цикле реакций трансэтерификации, по механизму напоминающих аутосплайсинг. Каждая молекула рибозима может обработать примерно 100 молекул субстрата в час и не изменяется в ходе реакции; таким образом, интрон действует как катализатор. Его действие соответствует кинетике Михаэлиса-Ментен, специфично по отношению к олигонуклеотидным РНК в качестве субстратов и может быть полностыо блокировано ингибитором. Отношение Ксаt/Км (константа специфичности) составляет 103 м-1 • с-1, что меньше, чем у многих ферментов, но по сравнению с некатализируемой реакцией рибозим повышает скорость гидролиза примерно в 1010 раз. Такое ускорение достигается благодаря ориентации субстрата, ковалентного катализа и катализа ионом металла — так действуют и белковые ферменты.
Характеристика других рибозимов.
РНКаза Р Е. coli состоит из РНК (М1 РНК из 377 нуклеотидов) и белка (Мr = 17 500). В 1983 г. Сидней Олтман и Норман Пейс с коллегами обнаружили, что при определенных условиях М1 РНК способна сама осуществлять катализ, расщепляя предшественников тРНК в совершенно определенном месте. Белковый компонент, вероятно, стабилизирует РНК или облегчает ее функционирование in vivo. Рибозим РНКаза P распознает трехмерную форму субстрата (пре-тРНК), а также последовательность ССА, и таким образом может отщепить 5'-концевые последовательности от разных молекул тРНК (рис. 26-27).
Список известных рибозимов продолжает расти. Некоторые вирусоиды, мелкие молекулы РНК, ассоциированные с РНК-содержащими вирусами растений, содержат структуру, которая запускает реакцию саморасщепления. К этому классу каталитических молекул относится изображенный на рис. 26-29 молотоголовый рибозим, катализирующий гидролиз внутренней фосфодиэфирной связи. Реакция сплайсинга в сплайсосоме, по-видимому, осуществляется в каталитическом центре, сформированном U2, U5 и U6 мяРНК (рис. 26-17). И, вероятно, самое главное — РНК-компонент рибосом катализирует синтез белка (см. гл. 27).
Обнаружение каталитических молекул РНК расширило наши представления о каталитической функции в целом и сыграло важную роль в формировании наших представлений о происхождении и эволюции жизни на нашей планете (см. разд. 26.3).
мРНК в клетке разрушаются с разной скоростью
Экспрессия генов регулируется на многих уровнях. Решающий фактор, управляющий экспрессией генов, — концентрация в клетке, соответствующей мРНК. Концентрация любой молекулы зависит от двух факторов: скорости синтеза и скорости распада. Когда скорости синтеза и распада мРНК становятся равными, мРНК находится в стационарной концентрации. Изменение скорости синтеза или скорости распада приводит к накоплению или исчерпанию мРНК. Метаболические пути расщепления предотвращают накопление мРНК в клетке и синтез ненужных белков.
Скорости расщепления мРНК разных эукариотических генов в значительной степени различаются. Время полужизни мРНК тех продуктов, которые нужны недолго, может составлять несколько минут или даже секунд. Напротив, мРНК тех генов, чьи продукты требуются постоянно, могут быть стабильны на протяжении многих клеточных генераций. Среднее время полужизни мРНК в клетках позвоночных составляет примерно 3 часа, а пул каждого типа мРНК на протяжении одной клеточной генерации оборачивается примерно 10 раз. Время полужизни бактериальной мРНК намного меньше — лишь около 1,5 мин; возможно, это обусловлено регуляцией метаболизма.
Матричная РНК разрушается рибонуклеазами, присутствующими во всех клетках. В Е. coli процесс начинается с одного или нескольких разрывов, которые вносит эндорибонуклеаза, с последующим 3' —> 5'-расщеплением экзорибонуклеаза- ми. У низших эукариот основной метаболический путь начинается с укорочения поли(А)-«хвоста» с последующим «декэпированием» 5'-конца и расщеплением мРНК в направлении 5' —> 3'. Путь расщепления в направлении 3' —> 5' также существует и, возможно, является основным путем у высших эукариот. У всех эукариот существует комплекс, называемый экзосомой, содержащий до 10 консервативных 3' —> 5'-экзорибонуклеаз, которые участвуют в процессинге 3'-конца рРНК и тРНК, а также в расщеплении мРНК.
Напоминающая шпильку структура бактериальной мРНК с р-независимым терминатором (рис. 26-8) обеспечивает защиту от расщепления. Схожие шпилечные структуры стабилизируют некоторые части первичного транскрипта, что является причиной неравномерного расщепления транскриптов. В клетках эукариот важное значение для стабильности многих молекул мРНК имеют 3'-поли(А)-«хвост» и 5'-кэп.
Полинуклеотидфосфорилаза создает случайные РНК-подобные полимеры
В 1955 г. Марианна Грюнберг-Манаго и Северо Очоа открыли бактериальный фермент полинуклеотидфосфорилазу, которая in vitro катализирует реакцию:


Полинуклеотидфосфорилаза была обнаружена первой среди всех ферментов, синтезирующих нуклеиновые кислоты (вскоре после этого Артур Кориберг открыл ДНК-полимеразу). Реакция, катализируемая полинуклеотидфосфорилазой, принципиально отличается от всех упомянутых выше полимеразных реакций тем, что не зависит
от матрицы. Этот фермент использует в качестве субстратов 5'-дифосфаты рибонуклеозидов и не действует на гомологичные 5'-трифосфаты или на дезоксирибонуклеозид-5'-дифосфаты. Полимер РНК, синтезированный полинуклеотидфосфорилазой, содержит обычные 3', 5'-фосфодиэфирные связи, которые расщепляются рибонуклеазой. Эта реакция легко обратима, и равновесие смещается в сторону расщепления полирибонуклеотида при повышении концентрации фосфата. Предполагаемая роль фермента в клетке заключается в разрушении молекул мРНК до нуклеозиддифосфатов.
Поскольку реакция фосфорилирования полинуклеотидов не нуждается в матрице, создаваемый полимер не содержит специфических последовательное гей оснований. Реакция протекает одинаково хорошо с любым из четырех или со всеми четырьмя нуклеотиддифосфатами, а состав образующегося полимера зависит лишь от относительной концентрации 5'-дифосфатов (субстратов) в среде.
Полинуклеотидфосфорилаза может применяться в лаборатории для синтеза полимеров РНК с самыми разными последовательностями оснований. Синтетические полимеры РНК такого рода сыграли важнейшую роль при выяснении генетического кода аминокислот (гл. 27).
Краткое содержание раздела 26.2 Процессинг РНК
■ Эукариотические молекулы мРНК модифицируются путем присоединения остатка 7-метилгуанозина на 5'-конце, а также расщепления и полиаденплирования З'-конца с формированием длинного поли(А)-«хвоста».
■ Многие первичные транскрипты мРНК содержат нитроны (некодирующие области), которые удаляются сплайсингом. Вырезание интронов группы I, обнаруженных в некоторых молекулах рРНК, нуждается в гуанозиновом кофакторе. Некоторые нитроны групп I и II способны к аутосплайсингу без участия белковых ферментов. Ядерные предшественники мРНК содержат нитроны III группы (самой многочисленной), которые вырезаются с помощью РНК-белковых комплексов, называемых мяРНП, организованных в сплайсосомы. Нитроны IV группы осуществляют сплайсинг белковых ферментов; эти интроны обнаружены в некоторых молекулах тРНК.
■ Функционирование многих эукариотических мРНК регулируется комплементарной микроРНК. Молекулы микроРНК образуются из более длинных предшественников в результате серии реакций процессинга.
■ Молекулы рибосомной и транспортной РНК образуются из более длинных молекул предшественников, расщепляемых нуклеазами. В ходе созревания некоторые основания модифицируются ферментами. Некоторые модификации нуклеозидов регулируются мякРНК в белковых комплексах мякРНП.
■ Аутосплайсирующиеся интроны и РНК- компонент РНКазы Р (отщепляет 5'-конец предшественников тРНК) — примеры рибозимов. Эти биологические катализаторы обладают свойствами истинных ферментов. Обычно они катализируют гидролитическое расщепление и трансэтерификацию, используя в качестве субстрата РНК. Сочетанию таких реакций способствует вырезанный интрон группы I из рРНК Tetrahymena, образующийся в ходе реакции РНК- полимеризации.
■ Полинуклеотидфосфорилаза в обратимой реакции синтезирует РНК-подобные полимеры из рибонуклеозид-5'-дифосфатов. добавляя или удаляя рибонуклеотиды на 3'-гидроксильном конце полимера. Фермент разрушает РНК in vivo.