ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
26. МЕТАБОЛИЗМ РНК
Вопросы и задачи
1. РНК-полимераза.
(а) Сколько времени потребуется РНК-полимеразе Е. coli для синтеза первичного транскрипта генов Е. coli, кодирующих ферменты метаболизма лактозы (laс-оперон размером 5300 п. н., рассмотрен в гл. 28)? (б) На какое расстояние вдоль цепи ДНК может продвинуться транскрипционный «пузырек», образованный РНК-полимеразой, за 10 секунд?
2. Коррекция ошибок РНК-полимеразой.
ДНК-полимеразы могут корректировать ошибки, а корректирующая способность РНК-полимеразы весьма ограниченна. Учитывая, что замена единственного основания при репликации или транскрипции может привести к ошибке в синтезе белка, приведите возможное биологическое объяснение такого поразительного различия.
3. Посттранскрипционный процессинг РНК.
Предскажите вероятные последствия мутации в последовательности (5')-AAUAAA в транскрипте эукариотической мРНК.
4. Кодирующая и матричная последовательности.
РНК-геном фага Qβ представляет собой нематричную, или кодирующую, цепь, и при попадании в клетку он функционирует в качестве мРНК. Предположим, что РНК-репликаза фага Qβ синтезирует главным образом матричную цепь РНК и включает именно ее, а не кодирующую цепь, в состав вирусных частиц. Что будет с матричными цепями, когда они попадут в новую клетку? Какой фермент нужно включить в состав вирусных частиц для успешного инфицирования клетки-хозяина?
5. Химия биосинтеза нуклеиновых кислот.
Опишите три общих свойства реакций, катализируемых ДНК-полимеразой, РНК-полимеразой, обратной транскриптазой и РНК-репликазой. Чем фермент полинуклеотидфосфорилаза похож на эти три фермента и чем отличается от них?
6. Сплайсинг РНК.
Каково минимальное число реакций трансэтерификации, необходимое для сплайсинга интрона из транскрипта мРНК? Поясните ответ.
7. Процессинг РНК.
Если в клетках позвоночных блокируется сплайсинг мРНК, блокируются и реакции модификации рРНК. Объясните это наблюдение.
8. РНК -геномы.
У РНК-содержащих вирусов относительно маленькие геномы. Например, одноцепочечные молекулы РНК ретровирусов состоят примерно из 10 000 нуклеотидов, а РНК фага Qβ содержит лишь 4220 нуклеотидов. Зная свойства обратной транскриптазы и РНК-репликазы, описанные в этой главе, объясните, почему у этого вируса такой маленький геном.
9. Скрининг молекул РНК методом SELEX.
Максимальное число разных последовательностей РНК, которые можно подвергнуть скринингу методом SELEX, составляет 1015. (а) Предположим, вы работаете с олигонуклеотидами длиной 32 нуклеотида. Сколько вариантов этих молекул может быть в их случайном наборе, содержащем все возможные последовательности? (б) Какую часть из них (в %) можно проанализировать методом SELEX? (в) Предположим, вы хотите выбрать молекулу РНК, которая катализирует гидролиз определенного эфира. На основании того, что вам известно о катализе (гл. 6 в т. 1), предложите стратегию, которая позволит вам выбрать подходящий катализатор.
10. Отравление бледной поганкой.
Бледная поганка (Amanita phalloïdes) содержит несколько опасных соединений, включая смертельный яд α-аманитин. Этот токсин блокирует элонгацию РНК путем связывания с эукариотической РНК- полимеразой II с очень высоким сродством; он смертельно опасен уже в такой низкой концентрации, как 10-8 М. Сначала у человека, съевшего этот гриб, проявляется желудочно-кишечное расстройство (вызываемое некоторыми другими токсинами). Потом эти симптомы исчезают, но через 48 ч человек умирает, обычно от поражения печени. Объясните, почему α-аманитину нужно столько времени, чтобы погубить человека?
11. Выявление штаммов возбудителя туберкулеза, устойчивых к рифампицину.
Рифампицин — важный антибиотик, применяемый для борьбы с туберкулезом и другими заболеваниями, вызываемыми микобактериями. Некоторые штаммы Mycobacterium tuberculosis (возбудитель туберкулеза) устойчивы к рифампицину. Эти штаммы приобрели устойчивость в результате мутации гена rроВ, кодирующего β-субъединицу РНК-полимеразы. Рифампицин не может связаться с мутантной PHК-полимеразой и поэтому не блокирует инициацию транскрипции. Было обнаружено, что последовательности ДНК из большого числа рифампицин-устойчивых штаммов М. tuberculosis несут мутации в специфической области из 69 пар оснований гена rроВ. В одном хорошо изученном штамме с устойчивостью к рифампицину заменена одна пара оснований в гене rроВ, и это привело к единичной аминокислотной замене в кодирующий β-субъединице: вместо остатка His появился остаток Asp.
а) Основываясь на знаниях химии белков (гл. 3 и 4 в т. 1), предложите способ, который позволяет выявить рифампицин-устойчивый штамм, содержащий этот конкретный мутантный белок.
б) Основываясь на знаниях химии нуклеиновых кислот (гл. 8 в т. 1), предложите способ идентификации мутантного гена rроВ.
Биохимия в Интернете
12. Ген рибонуклеазы.
Рибонуклеаза поджелудочной железы человека состоит из 128 аминокислотных остатков.
а) Какое минимальное число пар нуклеотидов требуется для кодирования данного белка?
б) мРНК из клеток поджелудочной железы копировали обратной транскриптазой для создания библиотеки ДНК человека. Последовательность мРНК, кодирующую панкреатическую рибонуклеазу человека, определяли путем секвенирования комплементарной ДНК (кДНК) из этой библиотеки, которая включает открытую рамку считывания для этого белка. Используйте базу данных Entrez database System (www.ncbi.nlm.nih.gov/Entrez), чтобы найти опубликованную последовательность этой мРНК (изучите базу данных CoreNucleotide для учетного номера D26129). Какова длина этой мРНК?
в) Как объяснить несоответствие между размером, который определили вы (пункт а), и реальным размером мРНК?
Анализ экспериментальных данных
13. Пример редактирования РНК.
Рецептор АМРА (α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) — важный компонент нервной системы человека. Он присутствует в нескольких формах в разных нейронах, причем отчасти это разнообразие объясняется посттранскрипционными модификациями. Данная задача посвящена изучению механизмов такого редактирования РНК.
В 1991 г. Соммер с соавторами анализировали последовательность, кодирующую важный остаток Arg в молекуле рецептора АМРА. В последовательности кДНК (см. рис. 9-14 в т. 1) рецептора АМРА остатку аргинина соответствовал кодон CGG (см. рис. 27-7). Однако в геномной ДНК в этой позиции стоял кодон CAG (Gin).
а) Объясните, как такой результат согласуется с наличием посттранскрипционной модификации мРНК рецептора АМРА. Рютер с коллегами (1995) подробно исследовали данный вопрос. Сначала они разработали метод, позволяющий различать модифицированные и немодифицированные транскрипты с помощью секвенирования ДНК по Сенгеру (см. рис. 8-33 вт. 1). Они модифицировали метод, чтобы определить, было ли это основание А (как в CAG) или нет. Они синтезировали два ДНК-праймера на основе последовательности геномной ДНК в этом участке гена рецептора АМРА. Ниже представлены праймеры, а также последовательность геномной ДНК нематричной цепи для соответствующего участка гена рецептора АМРА; модифицированное основание А выделено красным цветом.
Чтобы определить, сохранилось ли основание А или было заменено на какое-то другое, Рютер с соавторами использовали описанную ниже процедуру.
1. Готовили кДНК, комплементарную мРНК, используя праймер 1, обратную транскриптазу, dATP, dGTP, dCTP и dTTP
2. Удаляли мРНК.
3. Отжигали праймер 2, меченный 32Р, с кДНК и проводили реакцию с ДНК-полимеразой, dGТР, dСТР, dТТР и ddATP (дидезокси-АТР; см. рис. 8-33).
4. Денатурировали образующиеся дуплексы и разделяли их с помощью электрофореза в полиакриламидном геле (с. 136 в т. 1).
5. Детектировали меченную 32Р ДНК методом авторадиографии.
Ученые обнаружили, что из модифицированной мРНК образовалась [32Р] ДНК длиной 22 нуклеотида, тогда как из немодифицированной мРНК образовалась [32Р]ДНК длиной 19 нуклеотидов.
б) Используя представленные ниже последовательности, объясните, почему модифицированная и немодифицированная мРНК давали разные продукты.
Используя тот же подход для измерения доли транскриптов, подвергающихся редактированию при различных условиях, исследователи обнаружили, что в экстрактах культуры эпителиальных клеток (так называемых клеток НеLа) происходит активное редактирование мРНК. Для изучения механизмов этого процесса ученые приготовили активный экстракт клеток НеLа, как описано в таблице, и определяли его способность модифицировать мРНК рецептора АМРА. Протеиназа К расщепляет только белки, а микрококковая нуклеаза — только ДНК.
Образец |
Предобработка |
Доля редактированной мРНК, % |
1 |
Нет |
18 |
2 |
Протеиназа К |
5 |
3 |
Нагревание до 65 °С |
3 |
4 |
Нагревание до 85 °С |
3 |
5 |
Микрококковая нуклеаза |
17 |
в) Используйте эти данные для доказательства того, что в процессах редактирования мРНК принимают участие белки. В чем заключается наиболее слабое место этого доказательства?
Для точной идентификации редактированного основания Рютер с коллегами использовали описанную ниже процедуру.
1. Синтезировали мРНК, добавляя в реакционную смесь [α-32Р] АТР.
2. Модифицировали меченую мРНК путем инкубации с экстрактом клеток HeLa.
3. Гидролизовали модифицированную мРНК до отдельных нуклеотидмонофосфатов с помощью нуклеазы Р1.
4. Разделяли нуклеотидмонофосфаты методом тонкослойной хроматографии (см. рис. 10-24 в т. 1).
5. Идентифицировали образующиеся 32Р-мече- ные нуклеотидмонофосфаты методом авторадиографии.
В неизмененной мРНК исследователи обнаружили только [32Р] АМР, а в модифицированной мРНК содержался главным образом [32Р] АМР, но также некоторое количество [32Р] IМР (инозин монофосфат, см. рис. 22-34 в т. 2).
г) Почему в этом эксперименте использовали [α-32Р] АТР, а не [β-32Р] АТР или [y-32Р] АТР?
д) Почему использовали [α-32Р] АТР, а не [α-32P] GTP, [α-32Р] СТР или [α-32P] UTP?
е) Как полученные результаты исключают возможность удаления всего нуклеотида А (сахар, основание и фосфат) и его заменены на нуклеотид I?
Далее исследователи модифицировали мРНК, меченную [2,8-3Н] АТР, и повторили описанную выше процедуру. Метка 3Н содержалась лишь в мононуклеотидах АМР и IMP.
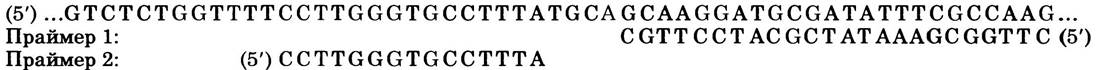
ж) Как этот результат исключает возможность удаления основания А (при сохранении сахарофосфатного остова) при замене на основание I? Каков в этом случае наиболее вероятный механизм редактирования?
з) Как замена остатка А на I в мРНК объясняет замену Gln на Arg в белковой последовательности двух форм рецептора AMРА? (Подсказка. См. рис. 27-8).