ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
27. МЕТАБОЛИЗМ БЕЛКА
Вопросы и задачи
1. Трансляция матричной РНК.
Определите аминокислотные последовательности пептидов, синтезируемых рибосомами на основе последовательностей мРНК, при условии, что рамка считывания начинается с первых трех оснований в каждой последовательности.
а) GGUСАGUСGСUССUGАUU
б) UUGGАUGСGССAUAАUUUGСU
в) САUGАUGССUGUUGСUАС
г) АUGGАСGАА
2. Скольким разным последовательностям мРНК может соответствовать одна аминокислотная последовательность?
Напишите все возможные последовательности мРНК, кодирующие трипептид Lеu-Меt:-Туr. На основании вашего ответа вы сможете оценить, сколько вариантов мРНК могут кодировать один полипептид.
3. Можно ли предсказать последовательность мРНК исходя из аминокислотной последовательности ее полипептидного продукта?
Определенная последовательность оснований мРНК будет кодировать одну и только одну последовательность аминокислот в полипептиде, если определена рамка считывания. Можно ли, исходя из определенной последовательности остатков аминокислот в белке, например, цитохроме с, предсказать последовательность оснований в единственной мРНК, кодирующей этот белок? Ответ обоснуйте.
4. Кодирование полипептида ДНК-дуплексом.
Матричная цепь участка ДНК-дуплекса содержит последовательность
(5') CTTAACACCCCTGACTTCGCGCCGTCG (3')
а) Какая последовательность оснований мРНК может транскрибироваться с этой цепи?
б) Какая аминокислотная последовательность может кодироваться молекулой мРНК, определенной вами в пункте (а) (начиная с 5'-конца)?
в) Если комплементарная (нематричная) цепь этой ДНК транскрибируется и транслируется, будет ли образуемая аминокислотная последовательность такой же, как в (б)? Объясните биологическое значение своего ответа.
5. Метионину соответствует только один кодон.
Метионин — одна из двух аминокислот, которым соответствует только по одному кодону. Как единственный кодон для метионина может кодировать и первый аминокислотный остаток, и внутренние остатки метионина в пептидах, синтезируемых клетками Е. coli.
6. Синтетические молекулы мРНК.
Генетический код был расшифрован благодаря полирибонуклеотидам, синтезированным в лаборатории ферментативным или химическим путем. Учитывая современные знания о генетическом коде, как бы вы синтезировали полирибонуклеотид, который мог бы служить в качестве мРНК, кодирующий большое количество остатков Phe и немного остатков Leu и Ser? Какие еще аминокислоты кодировал бы этот полирибонуклеотид, но в еще меньшем количестве?
7. Энергетическая стоимость биосинтеза белка.
Определите минимальную энергетическую стоимость (в эквивалентах АТР) биосинтеза β-цепи гемоглобина (146 остатков) при наличии всех необходимых аминокислот, АТР и GTP. Сравните результат с энергетическими затратами на биосинтез линейной цепи гликогена из 146 остатков глюкозы, связанных α1 —> 4-связью, при наличии глюкозы, UTP и АТР (см. гл. 15 в т. 2). Исходя из полученного результата оцените дополнительные энергетические затраты на образование пептида, в котором все остатки выстраиваются в определенной последовательности, по сравнению с затратой энергии на синтез полисахарида, содержащего то же количество остатков, но не несущего информационного содержания?
Помимо прямой затраты энергии на синтез белка, есть и косвенные затраты — на производство ферментов, необходимых для синтеза белка. Сравните уровень косвенных затрат эукариотической клетки на биосинтез линейных (α1 —> 4) цепей гликогена и на биосинтез полипептидов с учетом количества участвующих ферментов.
8. Зная кодоны, определите антикодоны.
Большинство аминокислот кодируется несколькими кодонами и связывается с несколькими тРНК — каждая со своим антикодоном. Напишите все возможные антикодоны для четырех кодонов глицина: (5’) GGU, GGC, GGA и GGG.
а) На основании своего ответа определите, какие положения в антикодонах наиболее важны для определения соответствующих кодонов в случае глицина?
б) Какие основания кодона и антикодона образуют «качающиеся» пары?
в) В каких парах кодон/антикодон все три позиции связаны уотсон-криковскими водородными связями?
9. Влияние однонуклеотидной замены на аминокислотную последовательность белка.
Многие важные подтверждения генетического кода были получены путем анализа изменений аминокислотной последовательности мутантных белков после замены единственного основания в генах этих белков. Какие из следующих аминокислотных замен могут быть вызваны заменой одного основания? Какие изменения не могут быть вызваны заменой одного основания? Почему?
а) Phe —> Leu д) Ile —> Leu
б) Lys —> Ala е) His —> Glu
в) Ala —> Thr ж) Pro —> Ser
г) Phe —> Lys
10. Причина серповидноклеточной мутации.
Гемоглобин серповидных эритроцитов содержит остаток Val в положении 6β-цепи вместо остатка Glu, содержащегося в нормальном гемоглобине А. Какое изменение произошло в кодоне для глутамата, в результате которого остаток Glu был заменен на Val?
11. Корректирующая функция аминоацил- тРНК-синтетаз.
Изолейцил-тРНК-синтетаза имеет корректирующую активность, которая обеспечивает точность аминоацилирования, а гистидил-тРНК-синтетаза такой активности не имеет. Объясните этот факт.
12. Значение «второго генетического кода».
Некоторые аминоацил-тРНК-синтетазы не распознают и не связывают антикодон соответствующих тРНК, и специфичность их связывания основана на распознавании других элементов молекул тРНК. По-видимому, к этой категории относятся тРНК для аланина.
а) Какие элементы тРНКAlа распознаются Аlа-тРНК-синтетазой?
б) Опишите последствия замены C —> G в третьей позиции антикодона тРНКAlа.
в) Какие другие типы мутаций могут оказывать аналогичное действие?
г) Мутации такого типа не были обнаружены в естественных популяциях организмов. Почему? Подсказка. Подумайте, что может произойти с отдельными белками и с организмом в целом.
13. Точность синтеза белка.
Химические механизмы, обеспечивающие точность синтеза белка, отличаются от механизмов, обеспечивающих точность репликации ДНК. ДНК-полимеразы имеют корректирующую 3' —> 5'-экзонуклеазную активность, позволяющую удалить аномально встроенные основания из растущей цепи ДНК. У рибосом нет аналогичной корректирующей функции, и присоединяющиеся с помощью тРНК аминокислоты никогда не идентифицируются. Гидролиз пептидной связи уже после того, как неправильная аминокислота встроилась в растущий полипептид (по аналогии с этапом коррекции последовательности ДНК- полимеразами), оказался бы невыгодным. Почему? Подсказка. Вспомните, как в процессе элонгации поддерживается связь между растущим полипептидом и мРНК. См. рис. 27-20 и 27-30.
14. Предсказание клеточной локализации белка.
Ген эукариотического полипептида из 300 аминокислотных остатков изменен таким образом, что распознаваемая SRP сигнальная последовательность находится на N-конце полипептида, а сигнал ядерной локализации (NLS) находится внутри, начиная с позиции 150. В каком отделе клетки может оказаться этот белок?
15. Что требуется для переноса белка через мембрану?
У секретируемого бактериального белка ОmрА есть предшественник, ProOmpA, который содержит необходимую для секреции N-концевую сигнальную последовательность. Если денатурировать очищенный ProOmpA с помощью 8 М мочевины и затем мочевину удалить (например, быстро пропустить раствор белка через колонку для гель-фильтрации), белок переносится через выделенные внутренние бактериальные мембраны in vitro. Однако транслокация не происходит, если ProOmpA предварительно инкубировать несколько часов в отсутствие мочевины. Кроме того, способность к транслокации сохраняется дольше, если ProOmpA предварительно инкубировать в присутствии другого бактериального белка, называемого триггерным фактором. Опишите возможную функцию этого фактора.
16. Способность вирусной ДНК кодировать белок.
Геном бактериофага φХ 174, состоящий из 5386 п. н., содержит 10 белков, обозначаемых от А до К, их размеры приведены ниже в таблице. Сколько ДНК нужно для кодирования этих 10 белков? Как соотносится размер генома φХ174 с объемом его кодирующих последовательностей?
Белок |
Количество остатков аминокислот |
Белок |
Количество остатков аминокислот |
А |
455 |
F |
427 |
В |
120 |
G |
175 |
С |
86 |
Н |
328 |
D |
152 |
J |
38 |
Е |
91 |
К |
56 |
Анализ экспериментальных данных
17. Конструирование белков на основании случайных последовательностей генов.
Изучение аминокислотных последовательностей и соответствующих трехмерных структур природных и мутантных белков позволило многое узнать о тех закономерностях, которые лежат в основе сворачивания белков. Для тестирования полученной информации полезно было сконструировать белок на основании этих закономерностей и проверить, соответствует ли его трехмерная структура предсказанной структуре.
Камтекар с коллегами (1993) использовали знание генетического кода для конструирования случайных белковых последовательностей с определенным расположением гидрофильных и гидрофобных остатков. Их подход к изучению факторов, определяющих трехмерную структуру белка, был основан на знании свойств аминокислот и генетического кода.
Исследователи сконструировали ряд белков с простой структурой, состоящей из четырех α-спиралей (см, ниже, справа; α-спирали изображены в виде цилиндров), соединенных участками с неупорядоченной спиральной структурой (розовые). Каждая α-спираль обладала амфифильными свойствами: на одной стороне спирали R-группы были только гидрофобными (желтые), а на другой стороне только гидрофильными (голубые). Предполагалось, что белок, состоящий из четырех таких спиралей, соединенных нерегулярными спиральными последовательностями, образует трехмерную структуру, в которой гидрофильные поверхности спиралей обращены в сторону раствора.
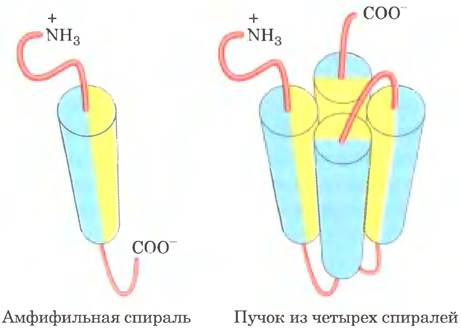
а) Какие силы или взаимодействия удерживают вместе четыре α-спирали в данном пучке?
На рис. 4-4, а (т. 1) представлен участок α-спирали, состоящий из 10 аминокислотных остатков.
б) Пронумеруйте R-группы на рис. 4-4, а сверху (N-конец; 1) вниз (С-конец; 10). R-группы с какими номерами выступают слева, а какие справа?
в) Предположим, вам нужно сконструировать участок амфифильной спирали из 10 аминокислотных остатков, в котором слева были бы расположены гидрофильные остатки, а справа — гидрофобные. Предложите последовательность из 10 аминокислот, которые могли бы образовать такую спираль. Учтите, что правильных ответов на этот вопрос может быть несколько.
г) Приведите пример последовательности двухцепочечной ДНК, которая могла бы кодировать аминокислотную последовательность, предложенную вами в ответе на вопрос (в). (Это внутренняя последовательность, так что нет необходимости вводить в нее стартовый кодон и стоп-кодон.)
Камтекар с коллегами синтезировали белки не с определенной последовательностью, а с почти случайной последовательностью, в которой в определенных позициях находились гидрофобные и гидрофильные аминокислотные остатки. Для этой цели ученые воспользовались интересными особенностями генетического кода, что позволило им создать библиотеку искусственных молекул ДНК с почти случайными последовательностями, выстроенными определенным образом.
Для создания последовательности ДНК, которая кодировала бы случайную последовательность гидрофобных аминокислотных остатков, исследователи начали с вырожденного кодона NТN, в котором N может означать А, G, С или Т. Для синтеза молекул ДНК с различными нуклеотидами в позиции N они использовали эквимолярную смесь оснований А, G, С и Т (см. рис. 8-35 вт. 1). Аналогичным образом, для создания случайной последовательности полярных аминокислот они начали с вырожденного кодона NAN и использовали для синтеза эквимолярную смесь А, G и С (в этом случае без Т).
д) Какие аминокислоты может кодировать триплет NTN? Все ли аминокислоты из этого набора гидрофобные? Входят ли в этот набор все гидрофобные аминокислоты?
е) Какие аминокислоты может кодировать триплет NAN? Все ли они полярные? Входят ли в этот набор все полярные аминокислоты?
ж) Почему при синтезе кодонов NAN реакционная смесь не должна содержать основание Т?
Камтекар с коллегами клонировали библиотеку случайных последовательностей ДНК на плазмидах, отобрали 48 вариантов с правильным расположением гидрофильных и гидрофобных аминокислотных остатков и экспрессировали их в клетках Е. coli. Далее предстояло определить, соответствует ли укладка белков предсказанной структуре. Экспрессировать и кристаллизовать каждый белок, а затем определять его трехмерную структуру было бы слишком трудоемким делом. Вместо этого исследователи использовали процессинг в клетках Е. coli для отсева наиболее дефектных вариантов белков. После этого первичного скрининга они сохранили лишь те клоны, в которых по данным SDS-электрофореза в полиакриламидном геле была белковая полоса с ожидаемой молекулярной массой (см. рис. 3-18 в т. 1).
з) Почему белки с очень сильными нарушениями структуры не образуют при электрофорезе полосу с ожидаемой молекулярной массой?
Этот первичный тест прошли несколько белков, и дальнейшие исследования показали, что они имели предсказанную структуру из четырех спиралей.
и) Почему не все белки со случайной последовательностью, прошедшие первичный скрининг, могли образовывать структуру из четырех спиралей?