ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
24. ГЕНЫ И ХРОМОСОМЫ
24.2. Сверхспирализация ДНК
Клеточная ДНК. как мы видели, чрезвычайно компактна и, следовательно, обладает высокой степенью структурной организации. Механизм укладки служит не только для упаковывания ДНК, но и для обеспечения доступа к содержащейся в ней информации. Прежде чем рассмотреть работу этого механизма в таких клеточных процессах, как репликация и транскрипция, мы должны обсудить важную структурную особенность ДНК - сверхспирализацию.
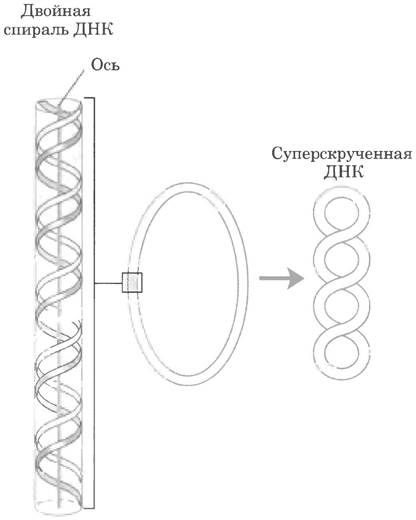
Сверхспирализация — скручивание уже существующей спирали. Примером такой структуры является скрученный телефонный шнур. На пути между трубкой и аппаратом часто образуется одна или несколько сверхспиралей (рис. 24-10). Молекула ДНК скручена в двойную спираль, в которой обе цепи ДНК закручены вокруг единой оси. Дальнейшее закручивание такой оси вокруг самой себя (рис. 24-11) приводит к образованию сверхспирализованной ДНК. Как мы увидим далее, сверхспирализация обычно является результатом структурного напряжения. Если ДНК не закручена вокруг своей оси, ее называют релаксированной.
Рис. 24-10. Сверхспирализация. Обычный телефонный шнур закручен в спираль, как ДНК, и сам может образовывать дополнительные петли сверхспирали. Эта аналогия уместна еще и по той причине, что именно телефонный шнур помог Джерому Винограду и его коллегам понять, что многие свойства маленьких кольцевых молекул ДНК могут объясняться суперскручиванием. Впервые они обнаружили явление сверхспирализации ДНК в 1965 г. в образцах маленьких молекул вирусной ДНК.
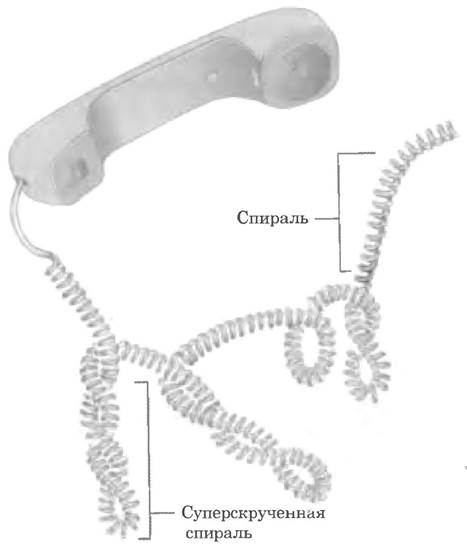
Рис. 24-11. Сверхспирализация ДНК. Когда двойная спираль ДНК закручивается вокруг своей оси, образуется новая спираль (сверхспираль). Суперскрученную ДНК обычно называют сверхспиралью.
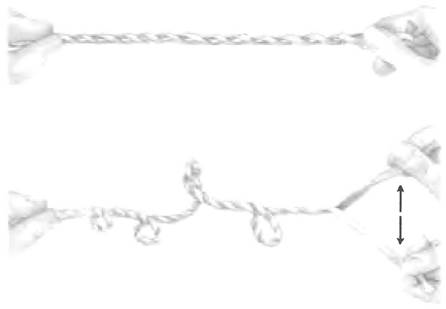
Логично предположить, что при упаковывании ДНК возникают различные варианты сверхспирализации. Менее очевидно, что репликация и транскрипция ДНК тоже влияют на сверхспи- рализацию и сами зависят от нее. Оба процесса связаны с разделением нитей ДНК, способствующим образованию дополнительных витков спирали (как показано на рис. 24-12).
Рис. 24-12. При разделении нитей спиральной структуры происходит сверхспирализация. Закрутите две резинки в правозакрученную двойную спираль, как показано на верхнем рисунке. Попросите кого-нибудь подержать один конец и попробуйте разделить нить с другого конца. Вы будете наблюдать суперскручивание.
То, что плотно упакованная клеточная ДНК закручивается вокруг самой себя, приобретая сверхспиральную структуру, кажется логичным и даже тривиальным, если бы не одно наблюдение: многие клеточные кольцевые молекулы ДНК остаются в высокой степени суперскрученными даже после того, как их экстрагируют и очищают, освобождая от белков и других клеточных компонентов. Из этого следует, что сверхспирализация неотъемлемое свойство четвертичной структуры ДНК. Оно характерно для всех молекул клеточной ДНК и строго регулируется каждой клеткой.
Сверхспирали характеризуются несколькими параметрами, которые можно измерить; на основе этих данных были глубже поняты структуру и функции ДНК. Исследования во многом базируются на концепциях топологии — одного из разделов математики; топология исследует свойства объекта при непрерывной деформации. В случае ДНК непрерывная деформация включает изменения конформации из-за теплового движения и взаимодействия с белками или другими молекулами; прерывистая деформация приводит к разрыву цепей ДНК. Для кольцевых молекул ДНК топологические свойства — это те свойства, которые не меняются при деформации цепей ДНК до тех пор, пока не возникают разрывы. Топологические свойства изменяются только в результате разрыва и последующего соединения одной или обеих цепей ДНК.
Теперь рассмотрим фундаментальные свойства и физическую основу сверхспирализации.
Большинство клеточных ДНК раскручены
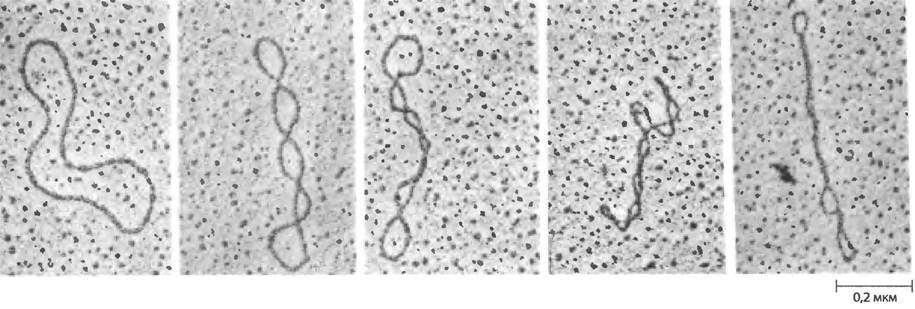
Чтобы понять суть сверхспирализации, сосредоточимся сначала на свойствах небольших кольцевых молекул ДНК, таких как плазмиды и небольшие ДНК-содержащие вирусы. Если такие молекулы ДНК не имеют разрывов ни в одной из цепей, они называются замкнутыми кольцевыми молекулами ДНК. Если форма замкнутой кольцевой ДНК близка по структуре В-форме ДНК (структуре Уотсона Крика; см. рис. 8-13 в т. 1) с одним оборотом двойной спирали на 10,5 п. н.. она скорее релаксирована, чем суперскручена (рис. 24-13). Суперскручивание происходит при некотором напряжении структуры. Очищенная замкнутая кольцевая ДНК редко бывает релаксированной, независимо от ее биологического происхождения. Более того, молекулы ДНК, полученные из определенного клеточного источника, имеют характерную именно для них степень сверхспирализации. Следовательно, ДНК напряжена в такой степени, чтобы в ней возникали супервитки, и это состояние регулируется клеткой.
Рис. 24-13 Релаксированная и сверхспирализованная плазмидная ДНК. На крайней левой электронной микрофотографии показана релаксированная молекула; степень сверхспирализации возрастает слева направо.
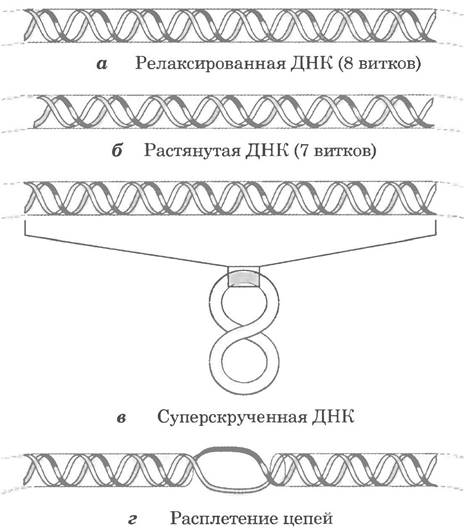
Практически в любой момент времени напряжения двойной спирали ДНК возникают из-за ее частичного раскручивания. Иначе говоря, в ДНК оказывается меньше витков спирали, чем в В-форме. Влияние частичного раскручивания обобщено на рис. 24-14. Участок кольцевой ДНК размером 84 п. н. в релаксированной форме может содержать восемь витков двойной спирали, или один виток на 10,5 п. н. Если один из таких витков удален, получается 84 п. н.: 7 = 12,0 п. н. на виток, т. е. больше, чем 10,5 — величина, характерная для В-ДНК (рис. 24-14, б). Это отклонение от наиболее стабильной формы ДНК приводит к термодинамическому напряжению в молекуле, т. е. к неустойчивой форме ДНК. Отчасти напряжение может быть снято при скручивании ДНК вокруг собственной оси с образованием сверхспирали (рис. 24-14, в; некоторая часть напряжения на участке из 84 п. н. может просто распределяться по раскрученной структуре более крупного фрагмента ДНК). В принципе напряжение может быть компенсировано при разделении двух цепей ДНК на расстоянии около 10 п. н. (рис. 24-14, г). В изолированной замкнутой кольцевой ДНК напряжение, вызванное частичным раскручиванием, обычно в большей степени компенсируется сверхспирализацией, чем при разделении цепей, поскольку скручивание оси ДНК, как правило, требует меньше энергии, чем разрыв водородных связей между парами нуклеотидов. Однако следует отметить, что после частичного раскручивания ДНК in vivo ее нити легче разделяются, что позволяет считывать содержащуюся в них информацию.
Рис. 24-14. Результаты раскручивания ДНК. а — участок ДНК замкнутой кольцевой молекулы длиной 84 п. н. в релаксированной форме с восемью оборотами спирали. 6 — удаление одного витка вызывает напряжение структуры. в — обычно напряжение сглаживается при суперскручивании. г — частичное раскручивание ДНК несколько облегчает разъединение цепей. Показано, что теоретически раскручивание на один оборот может облегчить разделение цепей на участке длиной около 10 п. н. Однако обычно разделению нитей на таком коротком участке препятствуют водородные связи между парами нуклеотидов, и эффект становится значимым только для более длинных участков ДНК и более сильного раскручивания.
Каждая клетка активно осуществляет раскручивание своей ДНК с помощью ферментативных процессов (описано ниже), и возникающее в результате напряженное состояние служит для запасания энергии. Клетки поддерживают ДНК в частично раскрученном состоянии для того, чтобы облегчить ее компактную упаковку. Раскручивание ДНК также важно для функционирования ферментов, участвующих в метаболизме ДНК, которые для выполнения своей задачи должны разделять две нити ДНК.
В таком раскрученном состоянии ДНК может существовать лишь в том случае, если она замкнута в кольцо или связана и стабилизирована белками таким образом, что цепи не могут свободно вращаться относительно друг друга. Если одна из цепей в изолированной, свободной от белка кольцевой ДНК разорвана, в этой точке спонтанно возникает свободное вращение и раскрученная ДНК переходит в релаксированное состояние. В молекуле замкнутой кольцевой ДНК число витков спирали нельзя изменить без хотя бы временного разрыва одной из цепей ДНК. По этой причине число витков спирали в молекуле ДНК является характеристикой сверхспирализации.
Степень скручивания ДНК определяется топологическим параметром — порядком зацепления
Топология предлагает некоторые концепции, которые помогут нам в обсуждении сверхспирализации ДНК, в частности концепцию порядка зацепления. Порядок зацепления — топологическое свойство двухцепочечной ДНК, поскольку оно не изменяется при сгибании или деформации ДНК до тех пор, пока целы обе цепи. Число зацеплений обозначают как Lr - от англ. linking number (рис. 24-15).
Рис. 24-15 Порядок зацепления (Lk). Здесь, как обычно, каждая голубая лента обозначает одну из цепей двухцепочечной ДНК. Для молекулы на рис. aLk = 1, для молекулы на рис. б Lk = 6. Одна из нитей на рис. б изображена незакрученной, чтобы яснее показать границу воображаемой поверхности (бледно-голубого цвета). Число пересечений данной поверхности спиральной нитью соответствует порядку зацепления.
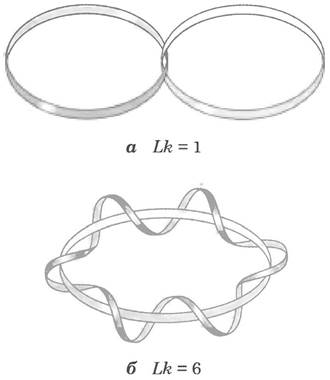
Давайте рассмотрим процесс разделения цепей двухцепочечной кольцевой ДНК. Если две цепи связаны так, как показано на рис. 24-15, а, их прочную связь можно назвать топологической связью. Даже если разрушаются все водородные связи и стэкинговые взаимодействия между основаниями, так что нарушается физический контакт между цепями, они по-прежнему остаются связанными топологическим образом. Представим себе, что одна из кольцевых цепей ограничивает некую поверхность (например, такую, как поверхность мыльной пленки внутри кольца перед тем, как из него выдувают мыльный пузырь). Порядок зацепления можно определить, как число пересечений этой поверхности второй цепью. В молекуле на рис. 24-15, a Lk = 1; в молекуле на рис. 24-15, б Lk = 6. Для замкнутой кольцевой ДНК порядок зацепления всегда описывается целым числом. Принято, что в правозакрученной спирали порядок зацепления — положительное число (+), а в левозакрученной спирали - отрицательное (-). В ДНК отрицательный порядок зацепления не встречается.
Применим эти рассуждения к молекуле замкнутой кольцевой ДНК, состоящей из 2100 п. н. (рис. 24-16, а). Когда молекула релаксирована, порядок зацепления найти просто: это отношению числа всех пар оснований к числу пар оснований, приходящихся на один оборот спирали (примерно 10,5 п. н.); следовательно, в данном случае Lk = 200. Чтобы кольцевая молекула ДНК могла быть характеризована определенным порядком зацепления, ни одна из ее цепей не должна содержать разрывов. Если хоть в одной цепи есть разрыв, спирали можно полностью разделить на две цепи. В этом случае топологические связи отсутствуют, и Lk нельзя определить (рис. 24-16, б).
Теперь мы можем описать скрученность ДНК, оперируя изменением порядка зацепления. За точку отсчета принимают порядок зацеления в релаксированной ДНК, Lк0. Для молекулы на рис. 24-16, a, Lк0 = 200; если из молекулы удалить два витка, к = 198.
∆Lk = Lk - Lk0 (24-1)
∆Lk = 198 - 200 = -2
Рис. 24-16. Порядок зацепления на примере молекул замкнутой кольцевой ДНК. Кольцевая ДНК размером 2100 п. н. показана в трех формах: а — релаксированная. Lk = 200; б — релаксированная с одноцепочечным разрывом (ником), Lk нельзя определить; в — частично, на два витка, раскрученная ДНК, Lk = 198. Частично раскрученная молекула обычно существует в суперскрученном состоянии, но частичное раскручивание также может облегчить разъединения цепей ДНК.

Обычно удобно выражать изменение порядка зацепления через параметр, не зависящий от длины молекулы ДНК. Этот параметр называют плотностью сверхспирализации (σ), или специфическим изменением порядка зацепления; плотность сверхспирализации равна отношению изменения числа витков спирали к их числу в релаксированной ДНК:
σ = ∆Lk/Lk0 (24-2)
В примере на рис. 24-16, в σ = -0,01; это означает, что удален 1% (2 из 200) витков спирали в ДНК (в В-форме). Обычно степень раскручивания клеточной ДНК составляет 5-7%; т. е. σ от - 0,05 до 0,07. Отрицательное значение показывает, что изменение порядка зацепления связано с раскручиванием ДНК. Таким образом, сверхспирализация, вызванная частичным раскручиванием, — это отрицательная сверхспирализация. И, наоборот, при некоторых обстоятельствах ДНК может быть перекручена, что выражается положительным значением сверхспирализации. Отметим, что в случае, когда ДНК частично расплетена (отрицательная сверхспирализация), закрученная вокруг оси часть спирали ДНК является зеркальным отражением перекрученной спирали ДНК (положительная сверхспирализация) (рис. 24-1). Сверхспирализация не случайный процесс; характер сверхспирализации по большей части описывается деформацией кручения, возникающей в ДНК при уменьшении или увеличении порядка зацепления по сравнению с В-формой ДНК.
Рис. 24-17. Отрицательная и положительная сверхспирализации. Для релаксированной молекулы ДНК, показанной на рис. 24-16, а, частичное раскручивание или перекручивание на два оборота спирали (Lk = 198 или 202) приводит к отрицательной или положительной сверхспирализации, соответственно. Заметьте, что ось спирали ДНК и в том и в другом случаях закручивается в противоположных направлениях.

Порядок зацепления может изменяться на ± 1 при разрыве одной цепи ДНК, поворота одного из концов на 360° вокруг второй цепи и соединения разорванных концов. Такое изменение не влияет на число пар нуклеотидов или число атомов в кольцевой молекуле ДНК. Две формы кольцевой ДНК, отличающиеся только таким топологическим свойством, как порядок зацепления, называются топоизомерами.
Пример 24-1 Определение плотности сверхспирализации
Какова плотность сверхспирализации о замкнутой кольцевой молекулы ДНК длиной 4200 п. н« для которой порядок зацепления Lk = 374? Какова плотность сверхспирализации ДНК той же длины при Lk = 412? Сверхвитки этих молекул положительны или отрицательны?
Решение. Найдем Lk0. Для этого длину кольцевой ДНК (в п. н.) делим на 10,5 п. н./виток: (4200 п. н.) / (10,5 п. н. / виток) = 400. Теперь по формуле 24-1 можно найти ∆Lk: ∆Lk = Lk - Lk0 = 374 - 400 = -26. Подставим значения ∆Lk и Lk0 в формулу 24-2: σ = ∆Lк/Lк0 = -26/400 = -0,065.
Поскольку сверхспирализация отрицательная, молекула ДНК несет отрицательные сверхвитки.
Если для той же молекулы ДНК Lк = 412, ∆Lк = 412 - 400 = 12, следовательно, σ = 12/ 400 = 0,03. Сверхспирализация положительная, молекула ДНК несет положительные сверхвитки.
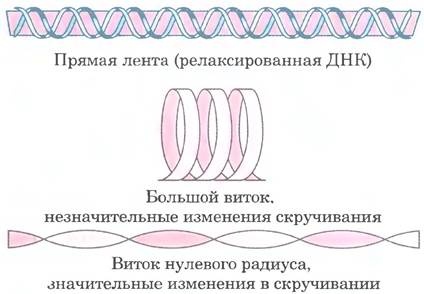
Порядок зацепления имеет две структурные составляющие кручение (коэффициент закрученности; Tw - от англ. twist) и райзинг (изгиб; Wr — от англ. writhe) (рис. 24-18). Их гораздо труднее описать, чем порядок зацепления, но кручение можно рассматривать как меру скручивания (число витков) оси спирали, а райзинг как меру локального изгиба или пространственной связи соседних пар оснований (число сверхвитков). При изменении порядка зацепления часть возникающего напряжения обычно компенсируется при закручивании (сверхспирализации) и изгибе, что выражается уравнением:
Lк = Tw + Wr
Рис. 24-18. Кручение и райзинг на модели резинового шнура. Розовый резиновый шнур изображает ось релаксированной молекулы ДНК. Напряжение, возникающее при закручивании резинки (как при частичном раскручивании ДНК), проявляется в виде кручения или райзинга. Топологические изменения порядка зацепления обычно сопровождаются изменением как кручения, так и райзинга.
Параметры Tw и Wr не обязательно целочисленные. Кручение и райзинг имеют скорее геометрическую, чем топологическую природу, поскольку изменяются при деформации замкнутой кольцевой молекулы ДНК.
Частичное раскручивание ДНК способствует сверхспирализации и в определенной мере упрощает разъединение цепей, а также облегчает ряд структурных изменений в молекуле. Физиологическое значение этих изменений не столь велико, но они помогают проиллюстрировать последствия частичного раскручивания. Напомним, что крестообразная структура (см. рис. 8-19 в т. 1) обычно содержит несколько неспаренных оснований, и именно недостаточная скрученность ДНК помогает сохранять разделение нитей (рис. 24-19). Частичное раскручивание нравозакрученной спирали ДНК также облегчает образование коротких отрезков левозакрученной Z-ДНК в тех местах, где последовательность нуклеотидов позволяет реализовать эту форму (гл. 8).
Рис. 24-19. Облегчение образования крестообразных структур при частичном раскручивании ДНК. В принципе, крестообразные структуры могут формироваться на палиндромных последовательностях (см. рис. 8-19 в т. 1), но они редко возникают в релаксированной ДНК, поскольку в линейной ДНК размещается больше пар оснований, чем в крестообразных структурах. Частичное раскручивание ДНК облегчает разделение цепей и формирование крестообразной структуры на соответствующих участках последовательности.

Топоизомеразы катализируют изменение порядка зацепления в ДНК
Сверхспирализация ДНК — строго регулируемый процесс, который влияет на разные аспекты метаболизма ДНК. В каждой клетке есть ферменты, функция которых заключается исключительно в частичном раскручивании и/или релаксации ДНК. Ферменты, повышающие или понижающие степень частичного раскручивания ДНК, называются топоизомеразами; они изменяют порядок зацепления в ДНК. Особенно важную роль эти ферменты играют в процессах репликации и упаковки ДНК. Существует два класса топоизомераз. Топоизомеразы I типа на короткое время разрывают одну из двух цепей ДНК, затем пропускают целую цепь сквозь разрыв и соединяют разорванные концы; они изменяют Lk с шагом в 1. Топоизомеразы II типа разрывают обе нити ДНК и изменяют Lk с шагом в 2.
Рис. 24-20. Обнаружение топоизомеров. В этом эксперименте все молекулы ДНК содержат одинаковое число пар оснований, но отличаются по степени сверхспирализации. Поскольку молекулы сверхспирализованной ДНК компактнее, чем релаксированные молекулы, они движутся быстрее при электрофорезе в геле. На представленных гелях разделены топоизомеры с близкими значениями плотности сверхспирализации (молекулы движутся сверху вниз). На дорожке 1 сильно сверхспирализованная ДНК движется в виде единой полосы, хотя, возможно, в ДНК присутствуют разные топоизомеры. На дорожках 2 и 3 видны результаты обработки сверхспирализованной ДНК топоизомеразой типа I; ДНК на дорожке 3 подвергалась воздействию фермента дольше, чем ДНК на дорожке 2. Когда плотность сверхспирализации снижается до значения, начиная с которого гель способен разделять отдельные топоизомеры, становятся видны дискретные полосы. В каждой полосе, выделенной скобкой справа от дорожки 3, содержатся кольцевые молекулы ДНК с одинаковым порядком зацепления; для двух соседних полос порядок зацепления различается на единицу.
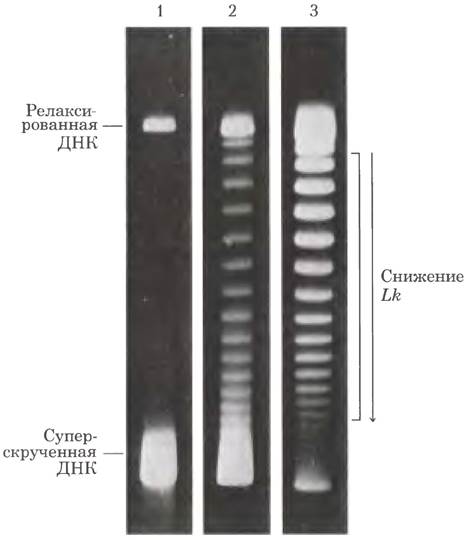
Рис. 24-21. Механизм реакции. Бактериальные топоизомеразы типа I изменяют порядок зацепления. Показана последовательность реакций топоизомеразы типа I. Фермент может находиться в закрытой и открытой конформации, а — молекула ДНК связывается с ферментом в закрытой конформации, и одна цепь ДНК разрезается. б — фермент переходит в открытую конформацию, и вторая цепь ДНК проникает через разрыв в первой цепи, в — фермент находится в закрытой конформации, цепь ДНК восстанавливается.

Действие этих ферментов можно продемонстрировать с помощью электрофореза в агарозном геле (рис. 24-20). Группа идентичных плазмид с одинаковым порядком зацепления движется в геле в виде дискретных полос. Метод позволяет разделить топоизомеры со значениями Lr, различающимися всего на 1, и обнаружить изменения порядка зацепления, вызванные топоизомеразами.
Клетки Е. coli имеют не менее четырех разных топоизомераз (от I до IV). Топоизомеразы типа I (топоизомеразы I и III) обычно релаксируют ДНК, удаляя отрицательные сверхвитки (повышают Lr). Механизм, с помощью которого бактериальные топоизомеразы типа I изменяют порядок зацепления, показан на рис. 24-21. Бактериальный фермент типа II (топоизомераза типа II, или ДНК-гираза) может вызвать отрицательное суперскручивание (уменьшает Lr). Этот фермент для осуществления реакции использует энергию АТР. Для изменения порядка зацепления ДНК топоизомеразы типа II разрывают обе цепи молекулы ДНК и пропускают в образовавшуюся брешь другой дуплекс. Степень сверхспирализации бактериальной ДНК поддерживается путем регуляции суммарной активности топоизомераз I и II.
В эукариотических клетках гоже есть топоизомеразы типов I и II. Топоизомеразы I и III — ферменты типа I, а единственный фермент типа II у позвоночных присутствует в двух изоформах — IIα и IIβ. Большинство топоизомераз тина II, включая ДНК-гиразу архей, похожи и принадлежат к одному семейству — к типу IIА. У архей. кроме того, есть необычные топоизомеразы IV, составляющие семейство типа IIВ. Эукариотические топоизомеразы типа II не могут частично раскручивать ДНК (формировать отрицательные с верх витки), но могут релаксировать как положительное, так и отрицательное суперскручивание (рис. 24-22).
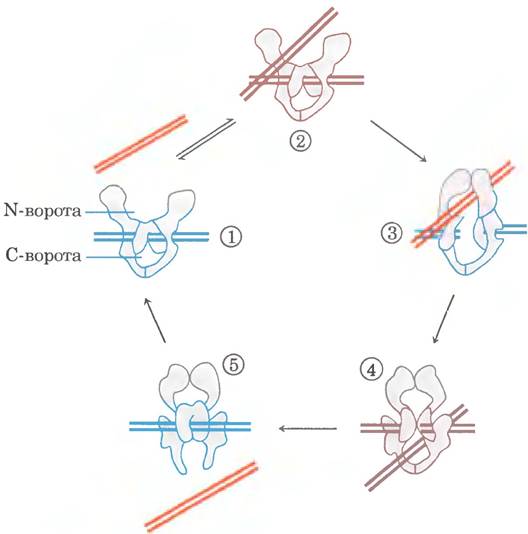
Рис. 24-22. Возможный механизм изменения порядка зацепления под действием эукариотических топоизомераз типа IIА. ① Фермент, состоящий из многих субъединиц, связывает одну молекулу ДНК (синие полосы). Раскрытые полости выше и ниже связанной ДНК называются N- и С-воротами. ② Второй сегмент той же молекулы ДНК (красные полосы) связывается в N-воротах и оказывается запертым ③. Обе цепи первого сегмента ДНК расщепляются (механизм этой реакции аналогичен механизму, изображенному на рис. 24-20, б), и ④ второй сегмент ДНК проходит сквозь разрыв. ⑤ Разорванная ДНК восстанавливается, и второй сегмент ДНК высвобождается через G-ворота. В ходе данного цикла связываются и гидролизуются две молекулы АТР; одна молекула АТР, вероятно, гидролизуется на стадии образования комплекса на этапе ④. Остальные подробности гидролиза АТР в данной реакции еще предстоит установить.
Как мы увидим в следующих главах, топоизомеразы играют ключевую роль в метаболизме ДНК, поэтому они важные мишени лекарств, предназначенных для борьбы с бактериальными инфекциями и новообразованиями (доп. 24-1).
Для компактной упаковки ДНК нужна особая форма сверхспирализации
У молекул сверхспирализованной ДНК есть несколько общих признаков. В молекуле с отрицательной сверхспирализацисй сверхвитки закручены вправо (рис. 24-17) и легче образуют не компактные, а тонкие и длинные петли, часто с множеством ответвлений (рис. 24-23). При характерной для клетки плотности сверхспирализации длина суперскрученных участков с учетом ответвлений составляет примерно 40% длины ДНК. Такой тип сверхспирализации называется плектонемическим (от греч. plektos — закрученный и пета — нить). Этим термином можно обозначить любую структуру с нитями, перекрученными неким простым и регулярным образом, и он хорошо объясняет общую структуру сверхспирализованной ДНК в растворе.
Рис. 24-23. Плектонемическая сверхспирализация. а — электронная микрофотография плектонемической сверхспирализованной плазмидной ДНК; б — интерпретация наблюдаемой картины; фиолетовыми линиями обозначены оси сверхвитков; обратите внимание на разветвления спирали, в — упрощенный вид данной структуры.

Плектонемическая сверхспирализация, а именно в такой форме выделяется ДНК в лабораторных условиях, недостаточно компактна для упаковки ДНК в клетке. В другой сверхспиральной форме, так называемой соленоидной форме (рис. 24-24), может существовать частично раскрученная ДНК. В отличие от вытянутой правозакрученной плектонемической формы сверхспирали для соленоидной формы характерны плотные левозакрученные петли. Эта структура напоминает по форме садовый шланг, аккуратно намотанный на катушку. Хотя плектонемическая и соленоидная формы сверхспирали принципиально отличаются по структуре, обе эти формы отрицательной сверхспирализации могут возникнуть на одном и том же участке частично раскрученной ДНК и могут переходить друг в друга. Плектонемическая форма более стабильна в растворе, соленоидная стабилизируется белками и встречается внутри хроматина. ДНК в этой форме гораздо более компактна (рис. 24-24. б). Соленоидная сверхспирализация — механизм, с помощью которого частичное раскручивание вносит свой вклад в компактную упаковку ДНК.
Рис. 24-24. Плектонемическая и соленоидная формы сверхспирали, а — в плектонемической сверхспирали ДНК имеет форму протяженных правозакрученных витков. В соленоидной отрицательной сверхспирали эта молекула по форме напоминает трубку из плотных левозакрученных витков. Обе формы могут переходить друг в друга, хотя соленоидная форма обычно не реализуется, пока ДНК не связывается с определенными белками. б — плектонемическая (верхняя) и соленоидная формы сверхспирали одной и той же молекулы ДНК различаются по размеру. ДНК в соленоидной форме гораздо компактнее.

Дополнение 24-1. МЕДИЦИНА. Лечение заболеваний путем ингибирования топоизомераз
Топология клеточной ДНК непосредственно связана с ее функцией. Без помощи топоизомераз клетки не могут реплицировать и упаковывать свою ДНК и экспрессировать гены и поэтому погибают. Следовательно, ингибиторы топоизомерз могут стать важными фармацевтическими средствами для борьбы с инфицирующими агентами и злокачественными клетками.
В качестве антибиотиков используются два класса ингибиторов бактериальных топоизомераз. Кумарины, среди которых можно назвать новобиоцин и кумермицин А1, представляют собой природные; продукты, выделяемые из стрептомицетов. Они ингибируют связывание АТР бактериальными топоизомеразами типа II, ДНК-гиразой и топоизомеразой IV. Эти антибиотики довольно редко используются для лечения инфекционных заболеваний человека, однако поиск эффективных антибиотиков такого рода для клинического применения продолжается.
Антибиотики хинолинового ряда, которые также ингибируют бактериальную ДНК-гиразу и топоизомеразу IV, впервые вошли в медицинскую практику в 1962 г., когда начала применяться налидиксовая кислота. Это вещество обладает ограниченной эффективностью и в США уже не применяется в клинической практике, однако активное изучение данного класса веществ привело к появлению фторхиполонов, примером которых может служить ципрофлоксацин (ципро). Действие хинолонов основано на ингибировании последней стадии топоизомеразной реакции, заключающейся в устранении разрывов в нитях ДНК. Циирофлоксацин — антибиотик широкого спектра действия. Это один из немногих препаратов, который эффективен против возбудителей сибирской язвы и рассматривается в качестве мощного средства защиты от биологического оружия. Хинолоны действуют исключительно на бактериальные топоизомеразы, а ингибирование эукариотических ферментов начинается при концентрации на несколько порядков выше терапевтической дозы.
Среди наиболее мощных химиотерапевтических препаратов для лечения онкологических больных есть ингибиторы топоизомераз человека. В опухолевых клетках обычно наблюдается повышенная концентрация топоизомераз, поэтому препараты, ингибирующие активность этих ферментов, гораздо более токсичны для опухолей, чем для здоровых тканей. В качестве противоопухолевых препаратов используются ингибиторы топоизомераз типа I и II.
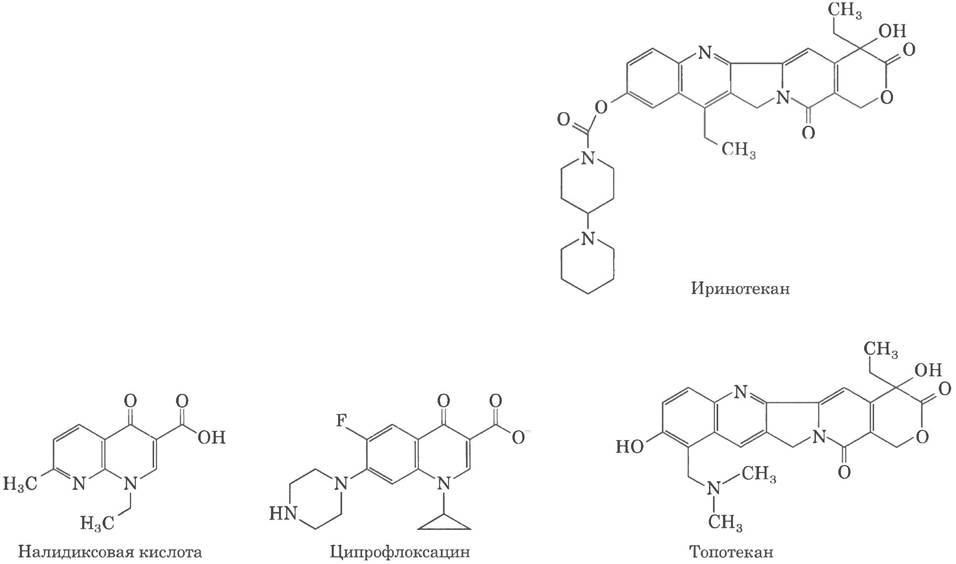
Камптотецин, выделенный из декоративного китайского растения и впервые испытанный в клинической практике в 1970-х гг., ингибирует эукариотическую топоизомеразу типа I. Клинические испытания выявили ограниченную эффективность препарата, хотя в доклинических испытаниях на мышах препарат показал хорошие результаты. Однако позднее, в 1990-х гг., были созданы два эффективных производных этого вещества — иринотекан (камнто) и топотекан (гикамтин), применяемые для лечения больных раком прямой и толстой кишки и раком яичников соответственно. Возможно, в ближайшее время будут выпущены другие родственные препараты. Все лекарства этой группы действуют за счет связывания комплекса топоизомеразы с ДНК, в котором ДНК находится в расщепленном состоянии, и ингибируют лигирование.

Целый ряд противоопухолевых препаратов действует на человеческие топоизомеразы типа II; среди них можно назвать доксорубицин (адриамицин), этопозид (этопофос) и эллиптицин. Доксорубицин, относящийся к классу антрациклинов, эффективен против нескольких видов рака. Большинство препаратов этой группы стабилизируют ковалентные связи в комплексе между топоизомеразой и расщепленной ДНК.
Обычно все перечисленные противоопухолевые препараты повышают количество повреждений ДЫК в быстро растущих опухолевых тканях. Однако, к сожалению, могут затрагиваться и здоровые ткани, что приводит к общему токсическому эффекту и нежелательному побочному действию, с которым приходится бороться в ходе курса химиотерапии. По мере повышения эффективности противоопухолевой терапии и улучшения прогноза для онкологических больных на передний план выступает проблема появления новых независимых опухолей. По-видимому, топоизомеразы останутся одним из интенсивно изучаемых объектов в поиске новых лекарственных препаратов для борьбы с раком.
Краткое содержание раздела 24.2 Сверхспирализация ДНК
■ Большая часть ДНК в клетке образует сверхспираль. При частичном раскручивании уменьшается общее число витков спирали ДНК по сравнению с релаксированной В-формой. Для поддержания состояния частичного раскручивания ДНК должна быть замкнута в кольцо или связана с белком. Частичное раскручивание количественно оценивается с помощью такого топологического параметра, как порядок зацепления Lk.
■ Частичное раскручивание измеряют с помощью плотности сверхспирализации σ (специфического изменения зацеплений), которое выражается как (Lk — Lk0) / Lk0. Для клеточной ДНК величина σ обычно составляет от -0,05 до -0,07, это означает, что в ДНК не хватает от 5% до 1% витков. Частичное раскручивание ДНК облегчает разделение цепей ферментами метаболизма ДНК.
■ Молекулы ДНК, отличающиеся только порядком зацепления, называются топоизомерами. Ферменты, обеспечивающие частичное раскручивание или релаксацию ДНК, называются топоизомеразами; они катализируют изменение порядка зацепления. Топоизомеразы тина I и II за один акт катализа изменяют Lk на одну или две единицы соответственно.