Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Метаболизм пуриновых и пиримидиновых нуклеотидов
Пурины
Биосинтез пуриновых нуклеотидов
У человека и других млекопитающих пуриновые нуклеотиды синтезируются для обеспечения потребностей организма в мономерных предшественниках нуклеиновых кислот, а также в соединениях, выполняющих другие функции, описанные в гл. 34. У некоторых позвоночных (птицы, земноводные, рептилии) синтез пуриновых нуклеотидов несет дополнительную функцию — является частью механизма, с помощью которого выводятся излишки азота в виде мочевой кислоты; такие организмы называют урикотелическими. Организмы, у которых конечным продуктом азотистого обмена является мочевина (как у человека), называют уреотелическими. Поскольку урикотелические организмы удаляют «излишки» азота в виде мочевой кислоты, синтез пуриновых нуклеотидов у них идет более интенсивно, чем у уреотелических. В то же время пути синтеза пуриновых нуклеотидов de novo — общие для обеих групп организмов.
Информация о происхождении каждого из атомов в молекуле пуринового основания получена в процессе радиоизотопных исследований, проведенных на птицах, крысах и человеке (рис. 35.2). На рис. 35.3 представлена схема пути биосинтеза пуриновых нуклеотидов. Первая стадия (реакция 1) — образование 5-фосфорибозил-1-пирофосфата (ФРПФ). Эта реакция не уникальна для биосинтеза пуриновых нуклеотидов. ФРПФ служит также предшественником в синтезе пиримидиновых нуклеотидов (см. рис. 35.15), он необходим для синтеза NAD и NADP — двух коферментов, в состав которых входит никотиновая кислота.
В реакции 2 (рис. 35.3), катализируемой фосфорибозил-пирофосфат-амидотрансферазой, из ФРПФ и глутамина образуются глутамат и 5-фосфорибозиламин. Хотя возможны и другие механизмы синтеза 5-фосфорибозиламина, реакция, катализируемая амидотрансферазой, имеет наиболее важное физиологическое значение в тканях млекопитающих.
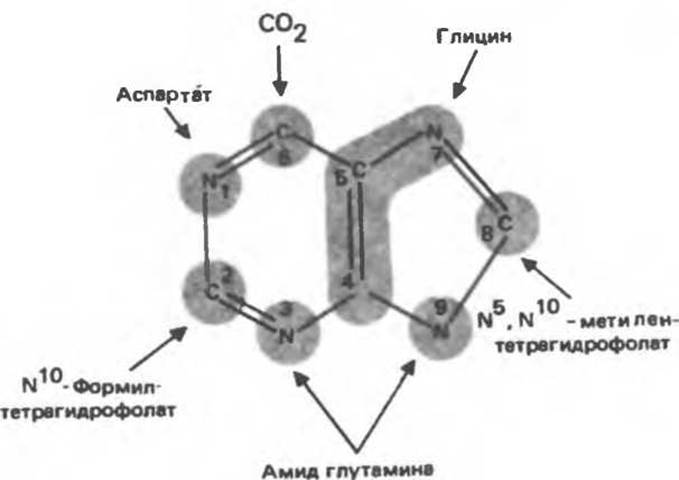
Рис. 35.2. Происхождение атомов азота и углерода пуринового кольца.
Далее 5-фосфорибозйламин вступает в реакцию с глицином (реакция 3); при этом образуется глицинамид-рибозилфосфат (глицинамидориботид, ГАР). Амидная группа глутамина служит источником атома азота в положении 9 молекулы пурина (N-9), а глицин — источником атомов углерода в положениях 4 и 5 (С-4 и С-5) пуринового кольца. Эту реакцию катализирует глицинамид-киносинтетаза. В реакции 4 атом азота N7 молекулы глицинамидрибозил фосфата формулируется N5, N10-Meтенилтетрагидрофолатом. В результате этой реакции, катализируемой глицинамид-рибозилфосфат-формилтрансферазой, поступающий одноуглеродный фрагмент займет положение С-8 в формирующемся пуриновом основании. В реакции 5 снова участвует глутамин — донор амидной группы. Амидирование происходит по атому С-4 формилглицинамид-рибозилфосфата и катализируется формилглицинамидин-рибозилфосфатсинтетазой. Присоединенный атом азота займет в молекуле пурина положение 3.
В результате замыкания имидазольного кольца, катализируемого аминоимидазолрибозилфосфатсинтетазой, образуется аминоимидазол-рибозилфосфат (реакция 6). Далее синтез проходит через стадию образования аминоимидазолкарбоксилат-рибозилфосфата (реакция 7). В результате реакции формируется карбонильная группа, источником которой служит молекула СО2, образующаяся в процессе дыхания.
Атом азота в положении 1 происходит из а-аминогруппы аспартата (реакция 8), остальная часть которого образует сукцинильный фрагмент в молекуле аминоимидазолсукцинилкарбоксиламид-рибозилфосфата (АИСКАР).
В реакции 9 сукцинильная группа АИСКАР удаляется в виде фумарата. Оставшийся аминоимидазолкарбоксиламид-рибозилфосфат формилируется (реакция 10) N10-формилтетрагидрофолатом (f10- Н4фолат) с образованием амидоимидазолкарбоксиламид-рибозилфосфата; реакция катализируется соответствующей формилтрансферазой. Вновь присоединенный атом углерода, подобно атому С-8, поступает из пула одноуглеродных фрагментов при участии тетрагидрофолата и занимает в молекуле пурина положение 2.
Замыкание кольца (реакция 11) происходит с помощью IMP-циклогидролазы, в результате образуется первый пуриновый нуклеотид — инозиновая кислота (инозинмонофосфат; IMP).

Рис. 35.3. Путь биосинтеза de novo пуринов из рибозо-5-фосфата и ATP (пояснения — в тексте). Р — Р02-3 или РО-2.
Значение метаболизма фолатов
В процессе биосинтеза пуриновых нуклеотидов (рис. 35.3) атомы углерода в положениях 8 и 2 поступают соответственно от N5, N10-метенилтетрагидрофолата и N10-формилтетрагидрофолата. Последний образуется из N5, N10-метенил тетрагидрофолата, который в свою очередь является продуктом NADP-зависимого дегидрогенирования N5, N10-метилентетрагидрофолата. Если N5, N10 метилентетрагидрофолат служит источником одноуглеродных фрагментов для многих акцепторов, то N5, N10-метенилтетрагидрофолат поставляет одноуглеродную группу (либо непосредственно, либо через стадию образования N10-формилтетрагидрофолата) только в пурины. Из приведенных сведений следует, что ингибирование процессов образования рассмотренных фолатов оказывает тормозящее влияние и на синтез пуринов de novo.
Образование АМР и GMP из IMP
Как показано на рис. 35.4 адениновые (реакции 12 и 73) и гуаниновые нуклеотиды (реакции 14 и 75) образуются путем аминирования и соответственно окисления и аминирования общего предшественника — инозинмонофосфата (IMP). Аминирование ГМР протекает через стадию образования промежуточного соединения, в котором аспартат присоединяется к инозиновой кислоте, образуя аденилосукцинат. Эта реакция напоминает реакцию 8 биосинтеза пуринов (рис. 35.3), в которой а-азот аспарагиновой кислоты поставляет атом N-1 пуринового кольца. Образование аденилосукцината катализируется аденилосукцинатсинтазой и происходит при участии GTP. Удаление остающейся части аспарагиновой кислоты в виде фумарата приводит к образованию адениловой кислоты (аденозинмонофосфат; АМР). Отщепление фумарата от аденилосукцината катализируется ферментом аденилосукциназой. Этот же фермент катализирует отщепление фумарата от аминоимидазолсукцинилкарбоксамидрибозилфосфата (реакция 9).
Так же, в две стадии, из IMP образуется гуанозинмонофосфат (GMP). В первой реакции на этом пути (реакция 14) при участии NAD и Н2O происходит окисление IMP с образованием ксантинмонофосфата (ХМР). Затем ХМР аминируется амидогруппой глутамина (реакция 75). Для этого процесса необходим АТР, что в какой-то мере напоминает потребность в GTP при превращении IMP в АМР.
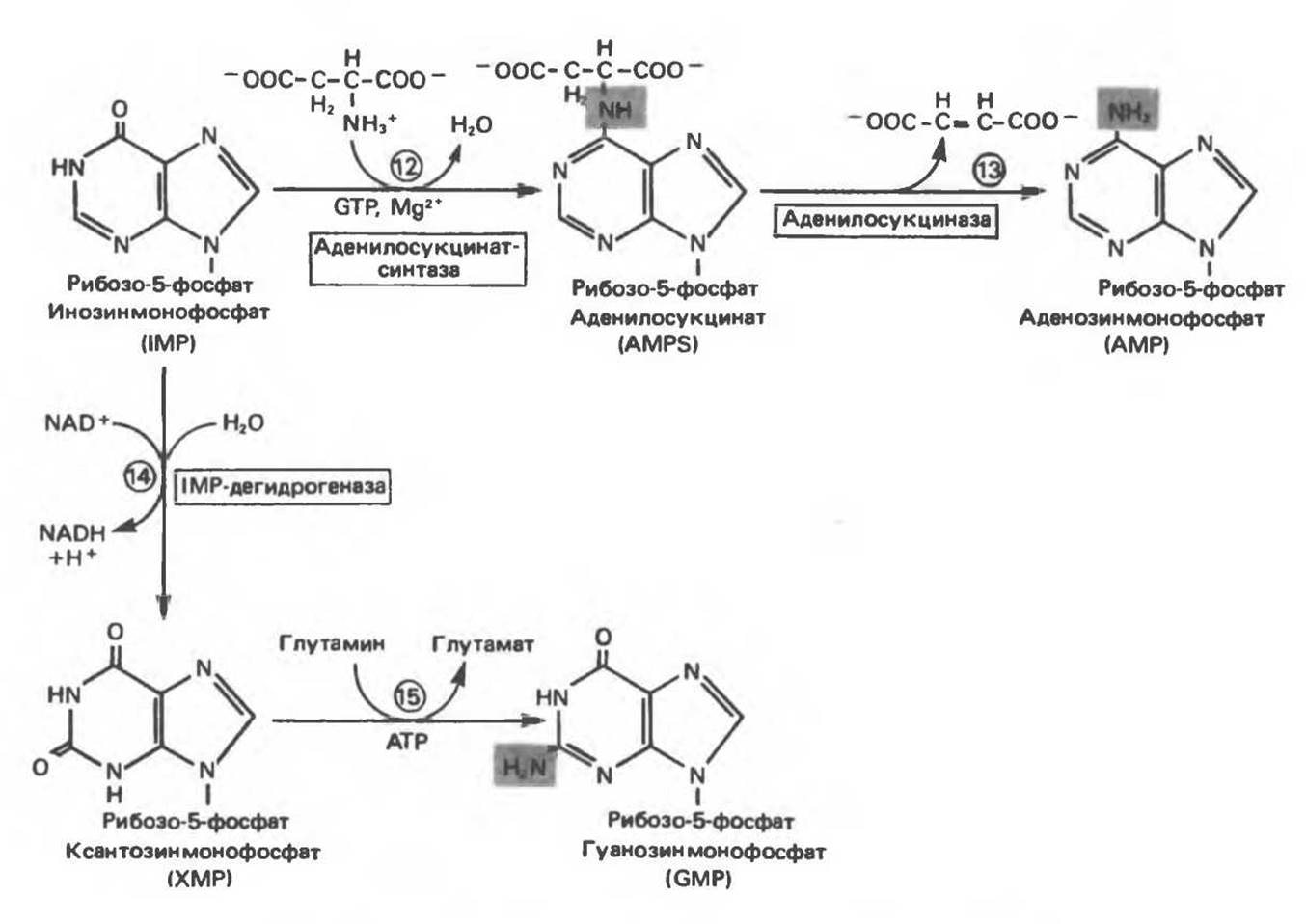
Рис. 35.4. Превращение IMP в АМР и GMP (пояснение в тексте).
Ингибиторы биосинтеза пуринов
Несколько антиметаболитов — аналогов глутамина оказывают сильное ингибирующее воздействие на биосинтез пуринов. Азасерин (О-диазоацетил-L-серин) выступает как антагонист глутамина, особенно в реакции 5. Диазонорлейцин ([6-диазо-5-оксо]-L-норлейцин) блокирует реакцию 2, а 6-меркаптонурин наряду с другими эффектами ингибирует реакции 13 и 14 синтеза АМР и GMP соответственно. Микофеноловая кислота подавляет реакцию 14.
Образование ди- и трифосфатов пуриновых нуклеозидов
Превращение АМР и GMP в соответствующие ди- и трифосфаты осуществляется в две стадии (рис. 35.5). Реакции фосфорилирования — переноса фосфатных групп от АТР—осуществляются нуклеозидмонофосфаз киназой и нуклеозиддифосфаткиназой.
Синтез пуриновых дезоксирибонуклеотидов
Синтез пуриновых и пиримидиновых дезоксирибонуклеотидов происходит путем прямого восстановления 2'-углерода рибозного остатка соответствующего рибонуклеотида, а не путем синтеза de novo из 2’-дезоксианалога ФРПФ. Восстановление 2'-углеродного атома рибозы происходит только после превращения пуриновых и пиримидиновых нуклеотидов в соответствующие нуклеозиддифосфаты. У некоторых бактерий в этом восстановительном процессе участвует кобаламин (витамин В12). У животных процесс восстановления идет и в отсутствие витамина В12. Восстановление рибонуклеозиддифосфатов в дезоксирибонуклеозиддифосфаты катализируется рибонуклеотидредуктазой и требует участия тиоредоксина (белковый кофактор), тиоредоксинредуктазы (флавопротеиновый фермент) и NADPH (кофактор). Непосредственным донором электронов для нуклеотида является тиоредоксин, который предварительно восстанавливается NADPH. Обратимое окислительно-восстановительное превращение тиоредоксина катализируется тиоредоксинредуктазой. Восстановление рибонуклеозиддифосфата восстановленным тиоредоксином катализируется рибонуклеозидредуктазой (рис. 35.6). Эта сложная ферментная система функционирует в клетках только в период активного синтеза ДНК и деления.
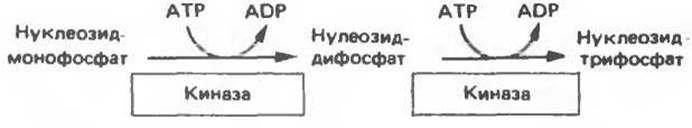
Рис. 35.5. Реакции фосфорилирования нуклеозидмонофосфата и нуклеозиддифосфата.
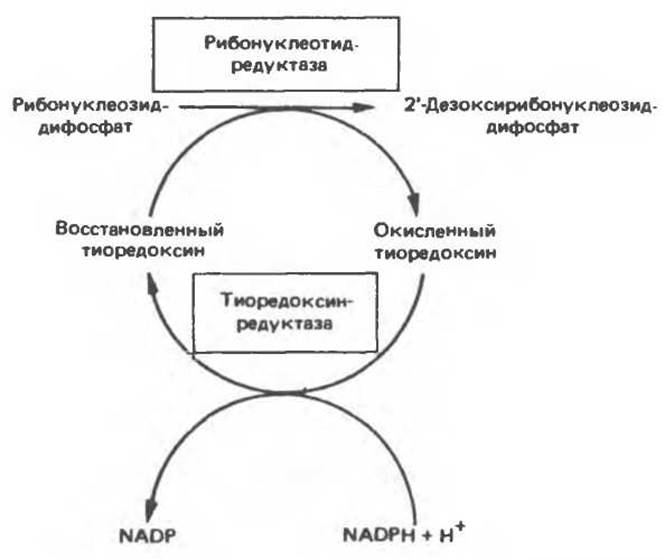
Рис. 35.6. Восстановление рибонуклеозиддифосфата до 2'-дезоксирибонуклеозиддифосфата.
Тканевая специфичность биосинтеза пуринов
Не во всех тканях человека происходит синтез пуриновых нуклеотидов de novo. Эритроциты и полиморфноядерные лейкоциты не способны синтезировать 5-фосфорибозиламин, и поэтому для образования пуриновых нуклеотидов им необходимы экзогенные пурины. Периферические лимфоциты способны синтезировать небольшие количества пуринов de novo. Установлено, что в клетках мозга млекопитающих содержатся очень малые количества ФРПФ-амидотрансферазы, на этом основании был сделан вывод о зависимости синтеза пуриновых нуклеотидов в мозге от поступления экзогенных пуринов. Оказалось, что основным местом синтеза пуриновых нуклеотидов в организме млекопитающих является печень. Из нее свободные основания или нуклеозиды попадают в другие ткани, не способные к синтезу пуринов de novo.
Пути регенерации пуриновых нуклеотидов
Регенерацию пуриновых нуклеотидов обеспечивают два основных механизма. В количественном отношении наиболее важен механизм фосфорибозилирования свободных пуриновых оснований ферментами, использующими ФРПФ в качестве донора фосфорибозы. Второй общий механизм — это фосфорилирование пуриновых нуклеозидов по 5'-гидроксильной группе.
1. Фосфорибозилирование пуриновых оснований
В тканях человека фосфорибозилирование пуриновых оснований осуществляют два фермента. Первый — аденин-фосфорибозилтрансфераза — переносит фосфорибозу с ФРПФ на аденин. При этом образуется АМР (рис. 35.7). Второй — гипокеантин-гуанин — фосфорибозилтрансфераза — катализирует фосфорибозилирование ксантина и гуанина с образованием IMP и GMP соответственно (рис. 35.8). Процесс с участием второго фермента, как будет показано ниже, протекает более активно, чем синтез АМР из аденина.
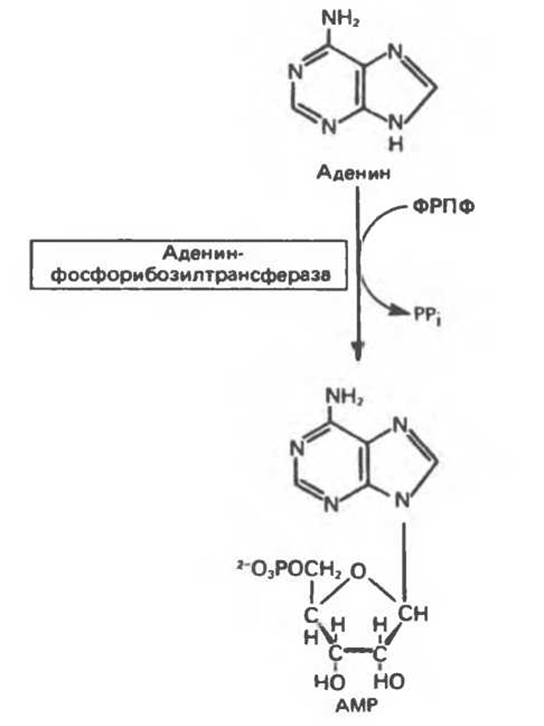
Рис. 35.7. Фосфорибозилирование аденина, катализируемое аденин-фосфорибозилтрансферазой.
2. Фосфорилирование пуриновых рибонуклеозидов
Превращение пуриновых рибонуклеозидов в пуриновые рибонуклеотиды у человека катализирует фермент аденозинкиназа (рис. 35.9). Аденозинкиназа, кроме того, фосфорилирует 2'-дезоксиаденозин, она проявляет также некоторую активность по отношению к гуанозину, инозину и их 2'-дезоксипроизводным. Дезоксицитидинкиназа в дополнение к фосфорилированию 2'-дезоксицитидина катализирует фосфорилирование 2'-дезоксиаденозина и 2'-дезоксигуанозина с образованием dAMP и dGMP.
Кроме того, в тканях человека функционирует цикл (рис. 35.10), в котором сначала IMP, GMP и их дезоксирибонуклеотидные аналоги при действии пурин-5’-нуклеотидазы превращаются в соответствующие нуклеозиды (инозин, дезоксинозин, гуанозин и дезоксигуанозин), а затем в результате реакции, катализируемой пуриннуклеозидфосфорилазой, образуются гипоксантин или гуанин и продукты фосфоролиза — рибозо-1-фосфат или 2'-дезоксирибозо-1-фосфат. Далее при участии ФРПФ цикл завершается фосфорибозилированием образовавшихся оснований до IMP или GMP. Функция этого цикла неизвестна, однако не вызывает сомнений, что потребление ФРПФ в организме человека в данном цикле выше, чем при синтезе пуриновых нуклеотидов de novo.
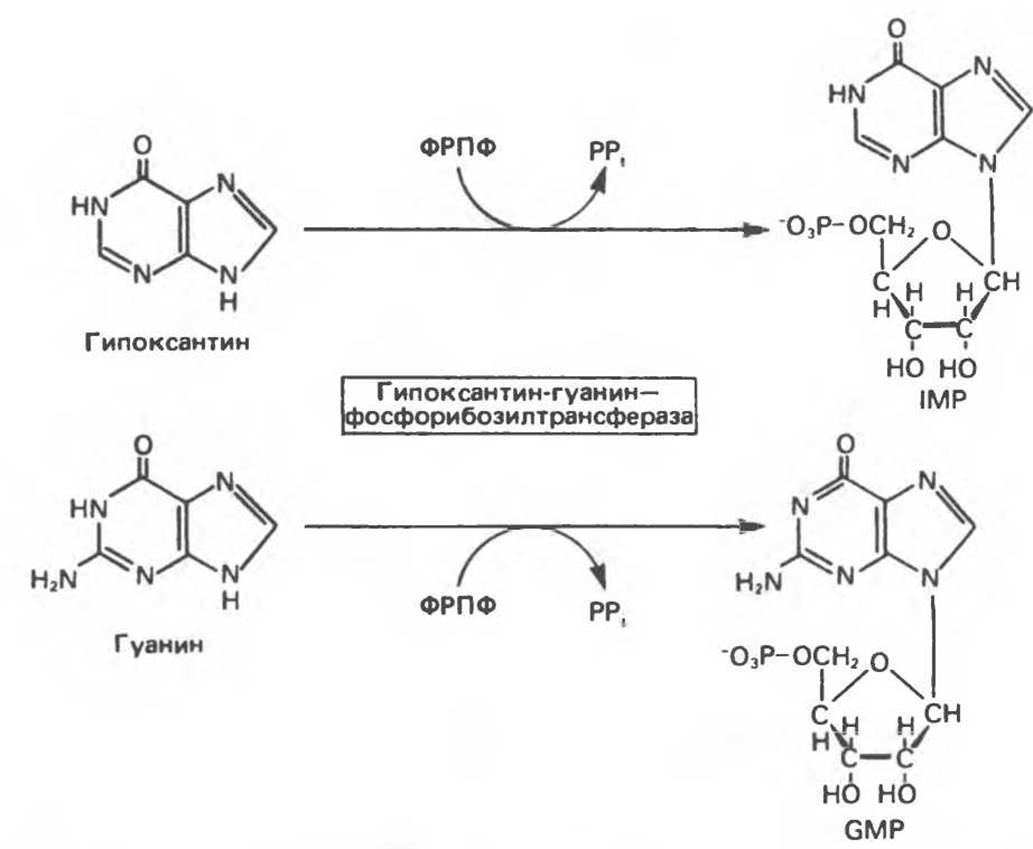
Рис. 35.8. Фосфорибозилирование гипоксантина и гуанина до IMP и GMP соответственно. Обе реакции катализируются гипоксантин-гуанин — фосфорибозилтрансферазой.
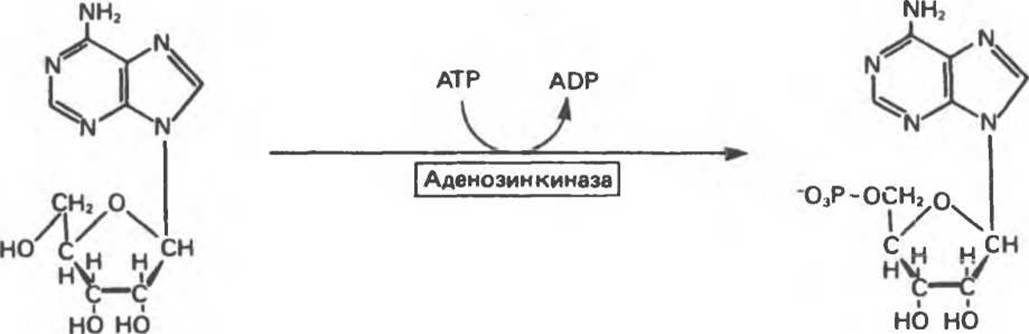
Рис. 35.9. Фосфорилирование аденозина до АМР аденозинкиназой.
Боковой путь этого цикла включает превращение IMP в АМР (реакция 12 и 13, рис. 35.4) и последующую реакцию образования аденозина из АМР. Эта реакция, по-видимому, катализируется той же пурин-5'-нуклеотидазой, которая гидролизует IMP доинозина. Образовавшийся аденозин затем либо фосфорилируется аденозинкиназой до АМР, либо под действием аденозиндезаминазы превращается в инозин. В количественном отношении эта «инозиновая петля» менее значима, чем описанный выше цикл, однако реакция дезаминирования аденозина весьма важна для функционирования иммунной системы.
Регуляция биосинтеза пуринов
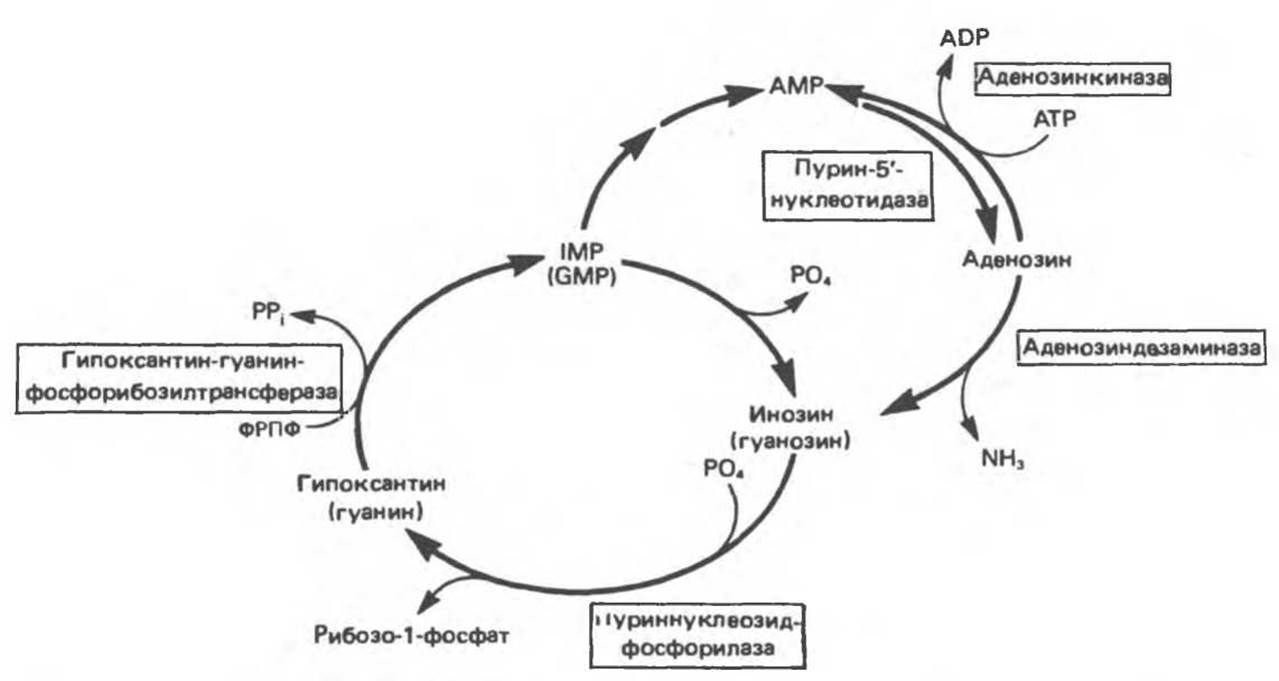
Рис. 35.10. Циклы реутилизации пуринов, включающие взаимные превращения AMP, IMP и, в меньшей степени, GMP; образование соответствующих рибонуклеозидов и их превращение в пуриновые рибонуклеотиды. Дезоксиаденозин, дезоксиинозин и дезоксигуанозин превращаются по тем же путям; дезоксиаденозин и дезоксигуанозин могут непосредственно фосфорилироваться до dAMP и dGMP соответственно.
На синтез молекулы IMP затрачивается энергия гидролиза шести макроэргических фосфодиэфирных связей АТР, при этом в качестве предшественников выступают глицин, глутамин, метенилтетрагидрофолат и аспартат. Для экономии энергетических и питательных ресурсов важна эффективная регуляция процесса биосинтеза пуринов de novo. Важнейшую роль в этом процессе играет внутриклеточная концентрация ФРПФ. Она определяется соотношением скоростей его синтеза, утилизации и деградации. Скорость синтеза ФРПФ зависит от 1) наличия субстратов синтеза, особенно рибозо-5-фосфата, и 2) каталитической активности ФРПФ-синтазы, которая в свою очередь связана с внутриклеточной концентрацией фосфатов, а также с концентрацией пуриновых и пиримидиновых рибонуклеотидов, выступающих в роли аллостерических регуляторов (рис. 35.11). Скорость утилизации ФРПФ в значительной степени зависит от интенсивности цикла реутилизации пуриновых оснований, в ходе которого ксантин и гуанин фосфорибозилируются до соответствующих рибонуклеотидов. В меньшей степени скорость утилизации ФРПФ зависит от интенсивности синтеза пуринов de novo. Этот вывод основан на следующем наблюдении: в эритроцитах и культивируемых фибробластах мужчин с наследственным нарушением активности гипоксантин-гуанин —фосфорибозилтрансферазы уровень ФРПФ повышается в несколько раз.
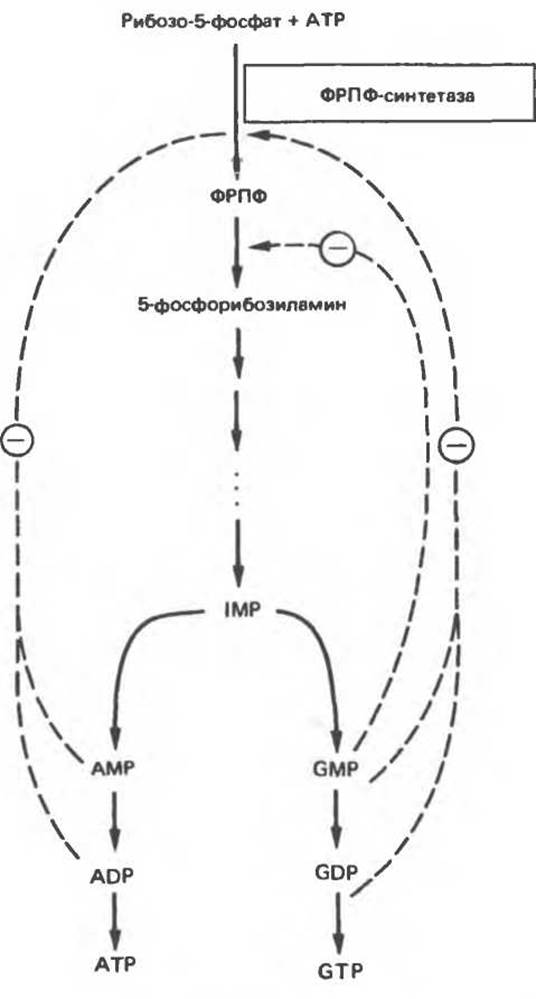
Рис. 35.11. Регуляция скорости синтеза пуринов de novo. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают ингибирование (⊝) конечными продуктами по принципу обратной связи.

Рис. 35.12. Регуляция превращений IMP в аденозиновые и гуанозиновые нуклеотиды. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную (⊕) и отрицательную (⊝) регуляцию по принципу обратной связи.
Показано, что ФРПФ-амидотрансфераза — первый из ферментов, участвующих в процессе синтеза пуриновых нуклеотидов de novo, ингибируется in vitro пуриновыми нуклеотидами (особенно аденозинмонофосфатом и гуанозинмонофосфатом) по принципу обратной связи. Эти ингибиторы конкурируют с субстратом — ФРПФ, последний, как выяснилось, занимает центральное место в регуляции синтеза пуринов de novo. Многие косвенные данные свидетельствуют о том, что роль амидотрансферазы в этом процессе менее существенна, чем ФРПФ-синтетазы.
Образование GMP или АМР из IMP регулируется двумя механизмами (рис. 35.12). АМР регулирует активность аденилосукцинатсинтетазы, влияя по принципу обратной связи на собственный синтез. GMP регулирует собственный синтез, действуя по тому же принципу на IМР-дегидрогеназу. Наряду с этим образование аденилосукцината из IMP на пути к АМР стимулируется GTP. Образование же GMP из ксантозинмонофосфата требует присутствия АТР. Таким образом, наблюдается существенная перекрестная регуляция дивергентных путей метаболизма IMP. Такая регуляция тормозит биосинтез одного из пуриновых нуклеотидов при недостатке другого. Гипоксантин-гуанин — фосфорибозилтрансфераза, катализирующая образование из ксантина и гуанина IMP и GMP соответственно, весьма чувствительна к ингибирующему действию этих нуклеотидов.
Восстановление рибонуклеозиддифосфатов до дезоксирибонуклеозидцифосфатов является объектом сложной регуляции. Этот процесс (рис. 35.13) обеспечивает сбалансированное образование дезоксирибонуклеотидов для синтеза ДНК.
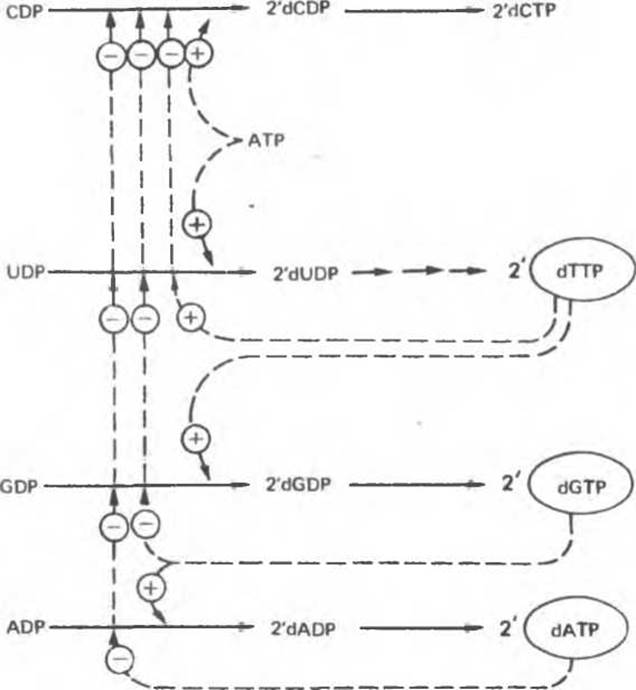
Рис. 35.13. Регуляция восстановления пуриновых и пиримидиновых рибонуклеотидов до соответствующих 2'-дезоксирибонуклеотидов. Сплошные линии указывают путь химических превращений Пунктирные линии обозначают положительную (⊕) и отрицательную (⊝) регуляцию по принципу обратной связи.
Катаболизм пуринов
Конечный продукт катаболизма пуринов у человека — мочевая кислота. При обследовании больных с наследственной формой недостаточности ферментных систем катаболизма пуринов установлено, что 99% мочевой кислоты образуется из субстратов нуклеозидфосфорилазы, функционирующей в цикле реутилизации пуринов. Пуриновые продукты нуклеозидфосфорилазной реакции — гипоксантин и гуанин — превращаются в мочевую кислоту; промежуточным продуктом является ксантин, образующийся в реакциях, катализируемых гуаназой и ксантиноксидазой (см. рис. 35.1) в печени, тонком кишечнике и почках.
Ксантиноксидаза представляет собой важную мишень для фармакологического вмешательства при гиперурикемии и подагре. У низших приматов и других млекопитающих (но не у человека) мочевая кислота гидролизуется уриказой до аллантоина (рис. 35.14) — соединения, хорошо растворимого в воде. У птиц и наземных рептилий уриказа отсутствует; в качестве конечных продуктов метаболизма азота (белков) и пуринов они экскретируют мочевую кислоту и гуанин.
У этих организмов сформировалась урикотелическая система, позволяющая сохранить воду, ассоциированную с мочевой кислотой, при выделении последней в виде преципитата. Если бы конечным продуктом метаболизма азота у них была мочевина, сохранить гидратационную воду было бы невозможно, поскольку растворимость мочевины в воде достигает 10 моль/л (концентрация значительно выше той, которая может быть достигнута при концентрировании мочевины почками).
Метаболизм мочевой кислоты у человека (подагра)
Метаболизм мочевой кислоты у человека был изучен с применением изотопно-меченных мочевой кислоты, а также ее предшественников — глицина и формиата. [15N]-Мочевую кислоту инъецировали внутривенно здоровым людям и больным подагрой, при которой в организме накапливаются значительные количества мочевой кислоты и ее натриевой соли. По разведению инъецированного изотопа рассчитывали общее количество мочевой кислоты, находящейся в водной фазе организма. Этот параметр получил название «растворимый уратный пул». Средняя величина данного показателя для 25 обследованных здоровых взрослых мужчин составляла 1200 мг (разброс 866—1578 мг), а у трех здоровых женщин он колебался от 541 до 687 мг. У больных подагрой растворимый уратный пул был значительно выше и варьировал от 2000 до 4000 мг для пациентов без подагрических узлов, т. е. без отложений урата натрия в мягких тканях. При тяжелой форме подагры, сопровождающейся образованием узлов, растворимый уратный пул достигал величины 31 000 мг. Скорость его обновления у здоровых людей составляет 600 мг за 24 ч. 18—20% удаляемой из организма мочевой кислоты распадается до СO2 и аммиака и выделяется через кишечник. Некоторое количество уратов экскретируется с желчью и подвергается деградации кишечной микрофлорой. Следует отметить, что распад мочевой кислоты до СO2 и NH3 у человека не связан с жизнедеятельностью кишечных бактерий.

Рис. 35.14. Образование аллантоина из мочевой кислоты.
Значение уратов для организма человека не ограничивается их ролью конечного продукта в метаболизме пуринов. Ураты могут функционировать как антиоксиданты, претерпевая неферментативное превращение в аллантоин. Предполагается, что эндогенный антиоксидант — урат — заменяет у приматов аскорбат, способность к синтезу которого у этих млекопитающих утрачена. Таким образом, вполне возможно, что в процессе эволюции утрата уриказы обеспечила определенные селективные преимущества для тех организмов, которые потеряли способность к восстановлению гулонолактона в аскорбат.
Урат натрия легко фильтруется почечными клубочками млекопитающих, интенсивно реабсорбируется и частично экскретируется в проксимальных канальцах, затем секретируется в петле Хенле и, вероятно, снова реабсорбируется в дистальных канальцах. За сутки здоровым человеком выделяется 400—600 мг мочевой кислоты. Большое количество фармакологических препаратов и природных соединений оказывает влияние на реабсорбцию урата натрия в почечных канальцах и его экскрецию. Аспирин в больших дозах ингибирует как экскрецию, так и реабсорбцию мочевой кислоты в почках.