Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Метаболизм пуриновых и пиримидиновых нуклеотидов
Заболевания, связанные с нарушением метаболизма пиримидинов (табл. 35.3)
Как отмечалось выше, конечными продуктами метаболизма пуринов являются хорошо растворимые в воде соединения, такие, как СО2, аммиак, ß-аланин и пропионат. Вот почему при состояниях, характеризующихся избыточным образованием пиримидинов, клинические симптомы слабо выражены. В случаях гиперурикемии, обусловленной избыточной продукцией ФРПФ, наблюдаются повышенный синтез пиримидиновых нуклеотидов и соответственно увеличенная экскреция конечных продуктов метаболизма, в частности ß-аланина. Поскольку для синтеза тимидилата необходим N5, N10-метилентетрагидрофолат, нарушения метаболизма фолата и витамина В12 приводят к дефициту ТМР (влияние недостатка витамина В12 реализуется опосредованно).
Таблица 35.3. Наследуемые нарушения метаболизма пиримидинов и связанные с ними изменения активности ферментов
|
Клинический синдром |
Дефектный фермент |
Характеристика дефекта |
Характеристика клинических проявлений |
Тип наследования признака |
|
ß-Аминоизобутиратацидурия |
Трансаминаза |
Недостаточность |
Без симптомов; распространен на Востоке |
Аутосомный рецессивный |
|
Оротовая ацидурия тип I |
Оротатфосфорибозил-трансфераза и оротидилатдекарбоксилаза |
Недостаточность |
Кристаллы оротовой кислоты в моче; отставание в развитии и мегалобластическая анемия (?) |
Аутосомный рецессивный |
|
Иммунодефицит. Ремиссия при пероральном приеме уридина |
||||
|
Оротовая ацидурия тип II |
Оротидилатдекарбоксилаза |
Недостаточность |
Оротидинурия и оротовая ацидурия, мегалобластическая анемия. Ремиссия при пероральном приеме уридина |
Аутосомный рецессивный |
|
Недостаточность орнитинтран-скарбамоилазы |
Орнитинтранскарбамоилаза |
Недостаточность |
Белковая нетолерантность, печеночная энцефалопатия, оротовая ацидурия |
Сцеплен с X- хромосомой; рецессивный |
Экскреция с мочой ß-аминоизобутирата — аутосомный рецессивный признак. Он распространен главным образом среди жителей Востока. Это нарушение не рассматривается как патологическое состояние (об этом уже шла речь при обсуждении катаболизма пиримидинов).
Описаны два типа первичной наследственной оротовой ацидурии. Более распространенная форма (хотя и встречающаяся весьма редко) связана с утратой во всех тестированных типах клеток функции двух ферментов — оротат-фосфорибозилтрансферазы и оротидилат(ОМР)-декарбоксилазы (рис. 35.19). Организм пациентов с этим типом оротовой ацидурии можно считать ауксотрофным по пиримидину. Заболевание легко поддается лечению уридином. В детском возрасте для больных характерны отставание в развитии, мегалобластическая анемия и «оранжевая кристаллоурия» (оротовая кислота). При отсутствии лечения пиримидиновыми нуклеозидами пациенты подвержены инфекциям. Второй тип наследуемой оротовой ацидурии (тип II) связан с недостатком только ОМР-декарбоксилазы (рис. 35.19). У пациентов, страдающих оротовой ацидурией первого типа, основным продуктом экскреции является оротовая кислота. При обследовании больного ацидурией второго типа оказалось, что у него экскретируется главным образом оротидин и лишь небольшое количество оротовой кислоты. В эритроцитах пациентов с оротовой ацидурией типа I были значительно повышены удельные активности аспартат-транскарбамоилазы и дигидрооротазы; они, однако, возвратились к норме при пероральном приеме пациентами уридина. Эти наблюдения свидетельствуют о том, что конечные продукты пути биосинтеза пиримидинов регулируют активность рассматриваемых ферментов. В условиях недостатка конечных продуктов происходит дерепрессия, вероятно, координированного характера, по крайней мере этих двух ферментов.
Данные по энзимологии пути биосинтеза пиримидинов позволяют предполагать, что в одной белковой молекуле локализованы активные центры карбамоилфосфатсинтазы, аспартаттранскарбамоилазы и дигидрооротазы, а в другой — активные центры оротат-фосфорибозилтрансферазы и ОМР-декарбоксилазы.
У больных с недостаточностью орнитинтранскарбамоилазы — митохондриального фермента клеток печени, ответственного за раннюю стадию синтеза мочевины и аргинина, наблюдается увеличение экскреции оротовой кислоты, урацила и уридина. По-видимому, в митохондриях этих пациентов в результате снижения активности орнитинтранскарбамоилазы накапливается карбамоилфосфат. Митохондриальный карбамоилфосфат диффундирует в цитозоль, где используется как субстрат для синтеза пиримидиновых нуклеотидов de novo. При избыточном образовании оротовой кислоты диагностируется оротовая ацидурия. Обычно она проявляется в легкой форме и не сопровождается образованием кристаллов. Синтез и экскреция оротовой кислоты у таких больных усиливаются при употреблении в пищу продуктов богатых азотом, таких, как мясо.
Оротовую ацидурию могут вызывать по крайней мере два лекарственных препарата. Аллопуринол (4-гидроксипиразолопиримидин) — пуриновый аналог, ингибирующий ксантиноксидазу. Этот препарат широко используется для лечения некоторых форм подагры. Аллопуринол может фосфорибозилироваться оротат-фосфорибозилтрансферазой, конкурентно ингибируя фосфорибозилирование оротовой кислоты. Более того, образующийся необычный нуклеотид подавляет оротидилатдекарбоксилазу, вызывая тем самым оротовую ацидурию и оротидинурию. Однако путь биосинтеза пиримидинов, по крайней мере у человека, «приспосабливается» к такому ингибированию, и «пиримидиновое голодание» имеет место только на ранних стадиях лечения препаратом.
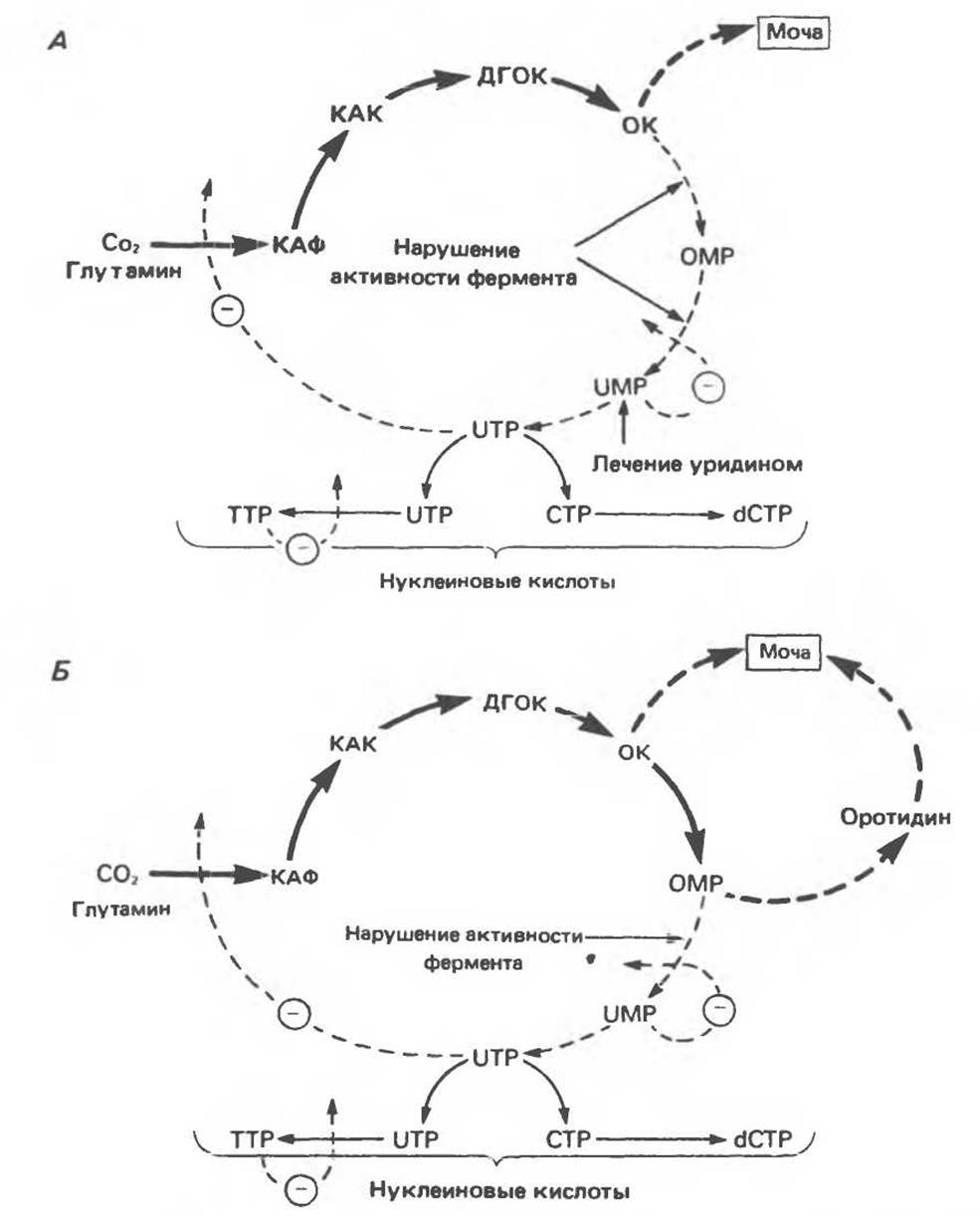
Рис. 35.19. А. Ферментные дефекты и их последствия при оротовой ацидурии типа I, которая характеризуется недостаточностью двух ферментов — оротат-фосфорибозилтрансферазы и оротидилат-декарбоксилазы. Б. Недостаточность оротидилат-декарбоксилазы, приводящая к оротовой ацидурии типа II. Пунктирные линии со знаком минус показывают пути ингибирования по принципу обратной связи в нормальных условиях. При оротовой ацидурии типа I с мочой экскретируется оротовая кислота. При оротовой ацидурии типа II в роли экскретируемых соединений выступают оротовая кислота и оротидин. Аббревиатуры расшифрованы на рис. 35.15.(Redrawn and reproduced, with permission, from Smith L. H. Ir. Pyrimidine metabolism in man. N. Engl. Med. 1973, 288, p. 764).
6-Азауридин после превращения в 6-азауридилат функционирует как конкурентный ингибитор ОМР-декарбоксилазы, что приводит к увеличению экскреции оротовой кислоты и оротидина.
При специфическом поражении митохондрий клеток печени (синдром Рейе) имеет место вторичная оротовая ацидурия. Дело в том, что пораженные митохондрии оказываются неспособными утилизировать карбамоилфосфат, который, как и в случае наследуемой недостаточности орнитинтранскарбамои- лазы, вызывает избыточное образование оротовой кислоты.
Литература
Ames В. N. et al. Uric acid provides an antioxidant defense in humans against oxidant and radical-caused aging and cancer: A hypothesis. Proc. Natl. Acad. Sсi. USA, 1981, 78, 6858.
Henderson J. F. Regulation of Purine Biosynthesis, Monograph, No. 170, American Chemical Society, 1972.
Henderson J.F., Paterson A.R.P. Nucleotide Metabolism: An Introduction, Academic Press, 1973.
Jones M. Pyrimidine nucleotide biosynthesis in animal cells, Annu. Rev. Biochem., 1980, 49, 253.
Kempe T. D. et al. Stable mutants of mammalian cells that over
produce the first three enzymes of pyrimidine nucleotide biosynthesis, Cell, 1976, 9, 541.
Martin D. W. Jr., Gelfand E. W. Biochemistry of diseases of immunodevelopment, Annu. Rev. Biochem., 1981, 50, 845.
Smith L.H. Jr. Pyrimidine metabolism in man, N. Engl. J. Med., 1973, 288, 764.
Stanbury J. B. et al. (eds.) The Metabolic Basis of Inherited Disease, 5th ed., McGraw-Hill, 1983.
Thelander L., Reichard P. Reduction of ribonucleotides, Annu. Rev. Biochem., 1979, 48, 133.
Wyngaarden J. B., Kelley W. N. Gout and Hyperuricemia, Grüne and Stratton, 1976.