Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Гликопротеины и протеогликаны
Протеогликаны и гликозаминогликаны
Протеогликаны и гликопротеины — это молекулы, состоящие из белков с ковалентно присоединенными к ним олигосахаридными или полисахаридными цепями. Различие между протеогликанами и гликопротеинами состоит в химической природе присоединенных к белку полисахаридов. В протеогликанах каждый полисахарид состоит из повторяющихся дисахаридных единиц, в которых всегда присутствуют Д-глюкозамин или Д-галактозамин. Каждый дисахаридный компонент протеогликановых полисахаридов (за исключением кератансульфата) содержит уроновую кислоту — L-глюкуроновую кислоту (GlcUA) или ее 5-эпимер, L-идуроновую кислоту (IdUA). За исключением гиалуроновой кислоты, все полисахариды протеогликанов содержат сульфатные группы в виде или О-эфиров, или N-сульфата (в гепарине или гепаринсульфате).
Существуют 3 типа связей протеогликановых полисахаридов с их полипептидной цепью:
1) О-гликозидная связь между Хуl и Ser, характерная только для протеогликанов; 2) О-гликозидная связь между GalNAc и Ser(Thr), присутствующая в кератансульфате II; 3) N-гликозиламиновая связь между GlcNAc и амидным азотом Asn.
Пути образования полисахаридных цепей полностью идентичны путям, по которым происходит рост олигосахаридных цепей гликопротеинов. UDP-Xyl-трансфераза присоединяет Хуl нуклеотидного сахара к Ser с возникновением Хуl-Ser-O-гликозидной связи. Образование О-гликозидной связи между GalNAc и Ser (или Thr), вероятно, осуществляется аналогичной UDPGalNAc-трансферазой. N-гликозидная связь между GlcNAc и амидным азотом Asn почти наверняка образуется при участии липид-связанного полисахарида, долихол-Р—Р-полисахарида, который, как отмечалось выше, ответствен за транспорт предобразованного олиго- или полисахарида в процессе образования гликопротеинов. Однако детали этой реакции в ходе синтеза протеогликанов пока не установлены.
Процесс элонгации цепи протекает при участии нуклеотидсахаров, действующих в качестве доноров, Реакции регулируются в первую очередь субстратной специфичностью отдельных гликозилтрансфераз. Здесь вновь проявляется принцип «один фермент — одна связь». Специфичность реакций зависит от нуклеотидсахарного донора, акцепторного олигосахарида и от аномерной конфигурации и положения связи. Ферментативные системы, участвующие в элонгации цепи, обладают способностью очень точно воспроизводить сложные полисахариды.
Завершение роста полисахаридной цепи является результатом следующих феноменов: 1) кэпирующего эффекта сиалилирования специфическими сиалил-трансферазами; 2) сульфирования, в особенности в 4-м положении сахаров; 3) удаления данного полисахарида с того места на мембране, где протекает катализ.
После образования полисахаридной цепи происходят многочисленные химические модификации, такие, как включение сульфатных групп в GalNAc-компоненты хондроитинсульфата и дерматансульфата и эпимеризация остатка GlcUA в остаток IdUA в гепарине и гепарансульфате.
Важным аспектом метаболизма протеогликанов является их деградация. Наследственные дефекты деградации полисахаридных цепей протеогликанов лежат в основе группы заболеваний, известных как мукополисахарцдозы и муколипидозы, которые обсуждаются ниже и в гл. 14. Эти нарушения катаболизма способствовали изучению специфических ферментов деградации и их субстратов. Существует ряд экзогликозидаз, осуществляющих ступенчатое отщепление сульфатных компонентов и гликозильных групп. Кроме того, имеются эндогликозидазы, которые присутствуют в нормальных условиях и обладают различной специфичностью. Например, широко распространенный фермент гиалуронидаза расщепляет N-ацетилгексозаминовые связи в гиалуроновой кислоте и хондроитинсульфатах.
Известно 7 типов полисахаридов (гликозамино-гликанов), соединяющихся с белками в составе протеогликанов. Шесть из них обладают родственной структурой и содержат остатки уроновой кислоты и гексозамина, которые перемежаются в повторяющихся дисахаридных компонентах; исключение составляет кератансульфат, лишенный уроновой кислоты. Все они, кроме гиалуроновой кислоты, содержат сульфированные сахара и ковалентно присоединены к белкам. Указанные 7 типов полисахаридов могут различаться по составу входящих в них мономеров, гликозидным связям, а также по количеству и локализации сульфатных заместителей.
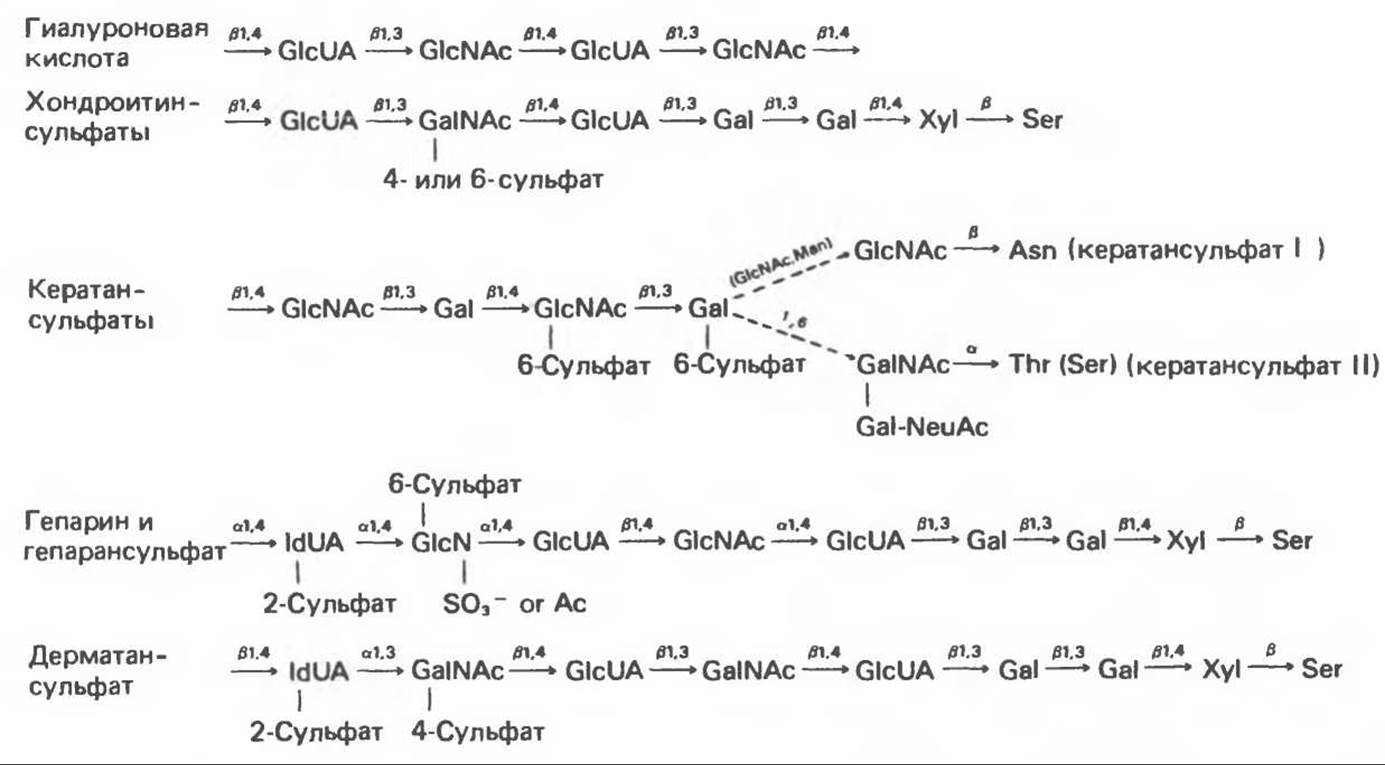
Рис. 54.9. Обобщенная структура протеогликанов и гликозаминогликанов (GlcUA — D-rлюкуроновая кислота; IdUA — L-идуроновая кислота; GlcN — D-глюкозамин; GalN — D-галактозамин; Ac — ацетил; Gal — D-галактоза; Xyl — D-ксилоза; Ser — L-серин; Thr — L-треонин; Asn — L-аспарагин; Man — D-манноза; NeuAc — N-ацетилнейраминовая кислота). Схема носит качественный характер и не отражает, например, состав уроновых кислот гибридных полисахаридов, таких, как гепарин и дерматансульфат, которые содержат и L-идуроновую, и D-глюкуроновую кислоты. Нельзя считать, что указанные заместители непременно присутствуют во всех случаях: так. в гепарине большинство остатков идуроновой кислоты несут 2-сульфатную группу, тогда как в дерматансульфате сульфирована значительно меньшая доля этих остатков. (Slightly modified and reproduced, with permission, from Lcnnarz W. J. The Biochemistry of Glycoproteins and Proteoglycans, Plenum Press. 1980.)
Все гликозаминогликаны являются полианионами благодаря присутствию в их структурах кислых сульфатных групп или карбоксильных групп уроновых кислот. С этой особенностью гликозаминогликанов связаны многие их функциональные свойства.
Структуры 7 гликозаминогликанов, входящих в состав протеогликановых молекул, представлены на рис. 54.9.
Гиалуроновая кислота
Гиалуроновая кислота представляет собой неразветвленную цепь из повторяющихся дисахаридных компонентов, содержащих GlcUA и GlcNAc. Твердые доказательства связи гиалуроновой кислоты с молекулой белка (которые имеются для других полисахаридов соединительной ткани) отсутствуют, но, вероятно, эта кислота подобно другим гликозамино-гликанам, синтезируется в составе протеогликанов. Гиалуроновая кислота присутствует у бактерий и широко распространена в различных тканях животных, включая синовиальную жидкость, стекловидное тело глаза и рыхлую соединительную ткань.
Хондроитинсульфаты
Хондроитинсульфаты — это протеогликаны, являющиеся важнейшим компонентом хряща. Полисахарид связывается с белком О-гликозидной связью Xyl-Ser. Данные о структуре хондроитинсульфатов суммированы на рис. 54.9. Повторяющийся дисахаридный компонент очень сходен с таковым в гиалуроновой кислоте, за тем исключением, что гексозамин представлен GalNAc, а не GlcNAc. Однако и в хондроитинсульфатах, и в гиалуроновой кислоте уроновая кислота представлена GlcUA, а положения связей и аномерные конфигурации у них одни и те же. GalNAc хондроитинсульфатов содержит сульфатный заместитель в положении 4 или 6. Как правило, оба заместителя присутствуют в одной и той же молекуле, но при разных моносахаридных остатках. На дисахаридную единицу приходится в среднем примерно один сульфатный заместитель. Каждая полисахаридная цепь содержит около 40 повторяющихся дисахаридных компонентов и имеет молекулярную массу, близкую к 20000. В результате связывания множества таких цепей с одной белковой молекулой образуются высокомолекулярные протеогликаны. Молекулярная масса хондроитинсульфата носового хряща составляет около 2,5x106.

Рис. 54.10. Электронная микрофотография протеогликанового агрегата средней величины; особенно хорошо видны субъединицы протеогликана и волокнистая основа. (Reproduced, with permission, from Rosenberg L., Heilman W., Kleinschmidt A. K. Electron microscopic studies of proteoglycan aggregates from bovine articular cartilage. J. Biol. Chem., 1975, 250, 1877.)
Хондроитинсульфаты прочно связываются с гиалуроновой кислотой при помощи двух связывающих белков, образуя в соединительной ткани очень большие агрегаты. Эти агрегаты можно наблюдать в электронном микроскопе (рис. 54.10); на рис. 54.11 дано их схематическое изображение.
Связывающие белки обладают сильной гидрофобностью и взаимодействуют и с гиалуроновой кислотой, и с протеогликаном.
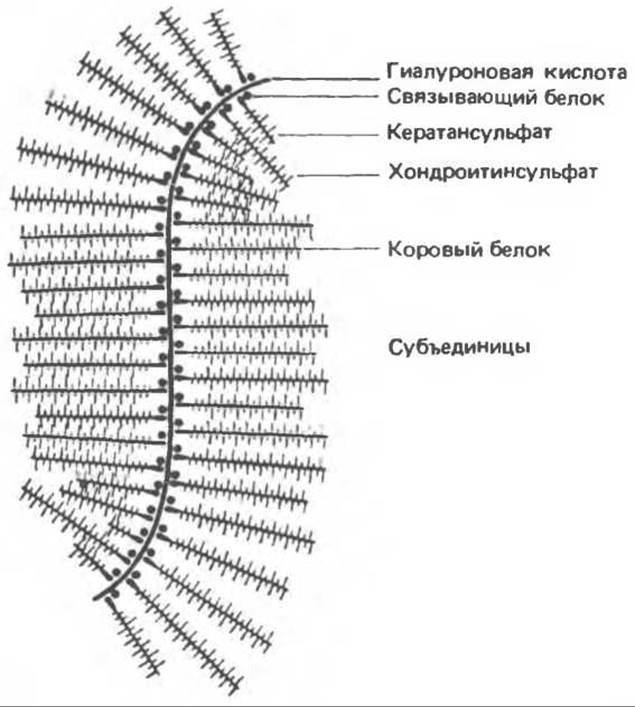
Рис. 54.11. Схематическое изображение протеогликанового агрегата. (Reproduced, with permission, from Lennarz W.J. The Biochemistry of Glycoproteins and Proteoglycans. Plenum Press, 1980.)
Хондроитинсульфаты содержат 6 типов межсахаридных связей, и их синтез поэтому протекает с участием 6 различных гликозилтрансфераз — по одному ферменту для каждого типа связей. Кроме того, имеются 2 вида сульфатных эфиров с сульфатными группами в 4- или 6-м положениях. Процессы эстерификации осущесвляются двумя сульфотрансферазами, сульфат-содержащим субстратом которых служит 3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
Кератансульфат I и кератансульфат II
Как показано на рис. 54.9, кератансульфаты состоят из повторяющихся дисахаридных компонентов Gal-GIcNAc и содержат сульфаты в 6-м положении остатков GlcNAc и иногда — Gal. Полисахарид в кератансульфате I присоединен к полипептидной цепи связью GlcNAc-Aso. Большие количества этого кератансульфата присутствуют в роговице.
Кератансульфат II — протеогликан скелета, содержащийся в нем вместе с хондриотинсульфатом, связан с гиалуроновой кислотой рыхлой соединительной ткани. Его полисахаридные цепи присоединяются к полипептидной цепи с помощью связи Gal- NAc-Thr(Ser).
Гепарин
Гепарин представляет собой классический протеогликан, в котором несколько полисахаридных цепей связаны с общим белковым ядром. Он обнаруживается в гранулах тучных клеток и, таким образом, локализован внутриклеточно. Гепарин обладает и другими структурными и функциональными особенностями, и некоторые из них имеют значение для медицины. Характерные особенности структуры гепарина представлены на рис. 54.12. Повторяющийся дисахаридный компонент содержит глюкозамин (GlcN) и уроновую кислоту. Большинство аминогрупп остатков GlcN присутствует в N-сульфированной форме, но имеется и небольшое количество ацетилированных аминогрупп. GlcN содержит также С6-сульфатный эфир.
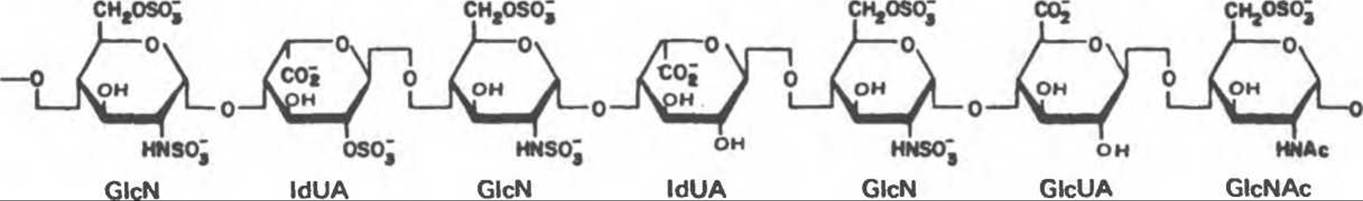
Рис. 54.12. Структура гепарина. Отрезок полимера иллюстрирует типичные структурные особенности гепарина, однако последовательность различным образом замещенных повторяющихся дисахаридных компонентов выбрана произвольно. Кроме того, могут присутствовать не-О-сульфированные или 3-О-сульфированные глюкозаминовые остатки. (Modified redrawn, and reproduced with permission, from Lindahl U. et al. Structure and biosynthesis of heparin-like polysaccharides. Fed. Proc., 1977, 36, 19.)
Около 90% уроновой кислоты — это IdUA и лишь 10% приходится на GlcUA. Первоначально остатки уроновой кислоты представлены в виде GlcUA, но в дальнейшем, после образования полисахарида 5-эпимераза превращает почти 90% остатков GlcUA в остатки IdUA, последние часто подвергаются сульфированию во 2-м положении.
Белковая молекула протеогликана гепарина уникальна в том отношении, что она состоит только из сериновых и глициновых остатков. Приблизительно две трети сериновых остатков соединены с полисахаридными цепями; их молекулярная масса составляет обычно 5000—15000, но иногда достигает 100000.
Полисахаридные цепи гепариновых протеогликанов после полимеризации претерпевают ряд модификаций:
1) первичный продукт не сульфируется, но полностью N-ацетилируется с образованием полимера (GlcUA-GlcNAc)n; 2) около 50% остатков GlcNAc подвергаются N-деацетилированию; 3) свободные аминогруппы GlcN сульфируются; затем происходит дальнейшее деацетилирование примерно половины остальных групп GlcNAc; 4) N-сульфированный полимер становится субстратом для 5-эпимеразы, которая превращает около 90% остатков GIcUA в IdUA; 5) вновь образованные остатки IdUA далее подвергаются О-сульфированию в положениях С-2; 6) модификация завершается О-сульфированием компонентов GlcN в G-6-положениях.
Гепарансульфат
Гепарансульфат присутствует на клеточных поверхностях, представляя собой внеклеточный протеогликан. Полипептидный остов гепарансульфатного протеогликана содержит дополнительный аминокислотный компонент, отличный от такового в гепарине. В процессе модификации его полисахаридных цепей деацетилирование остатков GlcNAc происходит слабее, и поэтому он содержит меньше N-сульфатов. Поскольку 5-эпимераза (как отмечалось выше при описании модификаций гепарина) использует в качестве субстрата N-сульфатные заместители, гепарансульфат отличается от гепарина меньшим количеством остатков IdUA и большим содержанием GlcUA. В соответствии с этим преобладающей уроновой кислотой в гепарансульфате является GlcUA, а в гепарине — IdUA.
Дерматансульфат
Дерматансульфат представляет собой протеогликан, широко распространенный в тканях животных. По структуре он сходен и с хондроитинсульфатом, и с гепарансульфатом. Его отличие от хондроитинсульфата состоит в том, что вместо GlcUA, соединенной с GalNAc ß-1,3-связью, он содержит IdUA, соединенную с GalNAc а-1,3-связью. Образование IdUA, как и в случае гепарина и гепарансульфата, происходит путем 5-эпимеризации GlcUA. Как и при образовании гепарина, реакция эпимеризации тесно сопряжена с сульфированием гексозамина. Таким образом, дерматансульфат содержит 2 вида повторяющихся дисахаридных единиц: IdUA—GalNAc и GlcUA—GalNAc.