Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Плазма крови и процесс свертывания
Белки плазмы
Общее количество белков в плазме — 7—7,5 г/дл (г%). Таким образом, белки составляют основную часть твердых веществ плазмы. Белки плазмы — это очень сложная смесь, включающая не только простые белки, но и смешанные или конъюгированные молекулы, например гликопротеины и различные типы липопротеинов.
Разделение сложной смеси белков на индивидуальные белки осуществляется при помощи растворителей и (или) электролитов; при этом выделяют различные белковые фракции в зависимости от их растворимости. Это свойство белков лежит в основе так называемых методов высаливания, часто используемых в клинических лабораториях. Белки плазмы осаждают при различных концентрациях сульфата натрия или сульфата аммония. При этом белки разделяют на три основные группы: фибриноген, альбумин и глобулин.
Плазма крови — это по определению внутрисосудистая жидкость. В артериальной области кровообращения внутрисосудистое гидростатическое давление, создаваемое сердцем и крупными сосудами, на 20—25 мм рт. ст. превышает гидростатическое давление в тканях. Выходу слишком большого количества жидкости из сосудов во внесосудистое тканевое пространство противодействует внутрисосудистое коллоидно-осмотическое давление, создаваемое белками плазмы.
Альбумин
Концентрация альбумина в плазме выше, чем концентрация двух других главных белков, а его молекулярная масса наименьшая (рис. 55.1). Именно этот белок вносит основной вклад во внутрисосудистое коллоидно-осмотическое давление. Альбумин синтезируется в печени, и его единственная цепь состоит из 610 аминокислот. Наряду с участием в поддержании коллоидно-осмотического давления альбумин служит еще молекулой-переносчиком. Он транспортирует билирубин, жирные кислоты, многие лекарственные вещества и элементы, содержащиеся в плазме в следовых концентрациях. Некоторые из его лиганд-связывающих участков являются высокоспецифичными и насыщаемыми, другие же обладают этими свойствами в значительно меньшей степени. При гипоальбуминемии (низкой концентрации альбумина в сыворотке), которая сопровождает заболевания печени и почек, наблюдается отек мягких тканей. Это связано с понижением внутрисосудистого коллоидно-осмотического давления.

Рис. 55.1. Относительные размеры и молекулярные массы молекул белков крови (Oncley).
Глобулины
Как отмечалось в гл. 5, глобулины — это белки, нерастворимые в воде, но растворимые в растворах солей. Глобулины сыворотки — это гетерогенная сложная смесь белковых молекул, обычно называемых a-, ß- и у-глобулинами (иногда дополнительно вводят цифровые обозначения); данная классификация основана на электрофоретической подвижности (рис. 55.2). Более рациональная классификация базируется на структуре и функциях глобулинов.
Гликопротеины содержат ковалентно связанные фрагменты олигосахаридов (см. гл. 54). Эти белки обнаруживаются во фракциях а1- и а2-глобулинов. Среди гликопротеинов имеется много специализированных белков с функциями, которые изучены в различной степени.
Липопротеины содержат липиды, обычно нековалентно связанные с белковой молекулой (см. гл. 26). Липопротеины мигрируют при электрофорезе вместе с а- или ß-глобулинами. Чем выше содержание липидов и чем ниже содержание белков в липопротеинах, тем ниже их удельный вес. Липопротеины служат переносчиками различных липидов и соединений, растворяющихся в них, но не в водной фазе плазмы.
Некоторые белки, связывающие металлы (металл-связывающие белки), например трансферрин, обладают свойствами глобулинов и переносят элементы, находящиеся в плазме в следовых количествах.
Плазма в норме содержит ряд ферментов, в частности фосфатазы, липазы, лактатдегидрогеназу, амилазу и ферроксидазу (церулоплазмин). При разрушении тканей или при нарушении структуры мембран внутриклеточные ферменты высвобождаются во внутриваскулярное пространство. В таких случаях их каталитическая активность может служить и количественным показателем степени повреждения тканей. В клинической медицине особенно важным является определение в сыворотке трансаминаз, креатинкиназ и кислых фосфатаз.
В плазме циркулируют полипептидные гормоны. Гидрофобные стероиды и 1,25-дигидроксивитамин D3, циркулируют в связанном виде (т. е. транспортируются специфическими переносчиками).
Важными компонентами плазмы являются иммуноглобулины, выполняющие роль эффекторов гуморальной иммунной системы, и фибриноген — предшественник фибрина, образующего кровяные сгустки. Оба этих класса плазменных белков будут рассмотрены более подробно.
Липопротеины плазмы обсуждаются в гл. 26.

Рис. 55.2. Метод зонального электрофореза в ацетате целлюлозы. А. Небольшое количество сыворотки или другой жидкости наносят на полоску ацетата целлюлозы. Б. Проводят электрофорез образца в буферном растворе. В. Белковые полосы становятся видимыми после окрашивания. Г. В результате денситометрического сканирования полоски ацетата целлюлозы на денситограмме видны пики альбумина, а1-глобулина, а2-глобулина, ß-глобулина и у-глобулина. (Reproduced, with permission, from Stites D.P., Stobo J. D., Wells J. V. (eds). Basic and Clinical Immunology, 6th ed. Appleton and Lange, 1987.)
Иммуноглобулины
Иммуноглобулины, или антитела, синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Антитела с удивительной специфичностью связываются с антигенными детерминантами других молекул.
Все молекулы иммуноглобулинов состоят из двух идентичных легких (L) цепей (мол. масса 23 000) и двух идентичных тяжелых (Н) цепей (мол. масса 53000—75000), образующих тетрамер (L2H2) при помощи дисульфидных связей (рис. 55.3). Каждая цепь может быть условно разделена на специфические домены или области, имеющие определенное структурное и функциональное значение. Половину легкой цепи, включающую карбоксильный конец, называют константной областью (C1), а N-концевую половину легкой цепи — вариабельной областью (VL). Примерно четвертую часть тяжелой цепи, включающую N-конец, относят к вариабельной области Н-цепи (VH), остальные 3/4 ее длины — это константные области (Сн1, Сн2, Сн3). Участок иммуноглобулина, связывающийся со специфическим антигеном, формируется N-концевыми вариабельными областями легких и тяжелых цепей, т. е. VH и VL- доменами. Эти домены не являются просто линейными последовательностями аминокислот, они формируют глобулярные образования с вторичной и третичной структурой, обеспечивающие эффективное связывание со специфическими антигенами. Как показано на рис. 55.3, при ферментативном расщеплении молекулы иммуноглобулина папаином образуются два антиген-связывающих фрагмента (Fab) и один кристаллизуемый фрагмент (Fc). Участок молекулы, расположенный между Сн1- и Сн2- доменами, носит название шарнирной области.
Существуют два основных типа легких цепей — каппа (к) и лямбда (λ), различающихся структурой в области CL (табл. 55.1). Индивидуальная молекула иммуноглобулина содержит либо две к-, либо две λ- цепи, но никогда не содержит одновременно и к-, и A-цепи. В состав иммуноглобулинов человека чаще входят к-цепи.
У человека обнаружено пять классов тяжелых (Н) цепей (табл. 55.1), различающихся СH-областями. Эти классы обозначают греческими буквами у, а, μ, δ и ε; их мол. масса варьирует от 50000 до 75000 (табл. 55.1). μ- и ε-Цепи содержат по четыре константные области, в составе других цепей таких областей три. Тип тяжелой цепи определяет класс иммуноглобулина и, следовательно, его эффекторные функции. Имеется пять классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Как видно из табл. 55.1, несколько классов Н-цепей могут быть разделены на подклассы на основе небольших различий в СН-областях.
Вариабельные области иммуноглобулинов, состоящие из VL- и VH-доменов, весьма гетерогенны. Действительно, нет двух вариабельных областей (у разных индивидов), которые были бы идентичны по аминокислотной последовательности. Имеются, однако, сходные по структуре участки. Их можно разделить на три группы в зависимости от степени гомологии аминокислотной последовательности: Vк-группа для к-цепей, Vλ группа для λ-цепей и VH- группа для Н-цепей. При большем «разрешении» в каждой из этих трех групп можно выделить подгруппы. Итак, в структуре вариабельных областей имеется несколько относительно постоянных участков. При сравнении вариабельных областей различных легких или тяжелых цепей установлено, что среди относительно невариабельных районов (определяющих группы и подгруппы) встречаются гипервариабельные участки (рис. 55.4). В составе легких цепей таких участков три, тяжелые цепи имеют четыре гипервариабельных участка.

Рис. 55.3. Упрощенная модель молекулы IgG антител человека: представлена четырехцепочечная основная структура и домены. V — вариабельная область; С — константная область; вертикальная стрелка — шарнирная область. Жирными линиями обозначены Н- и L-цепи; тонкими линиями — дисульфидные связи. (Modified and reproduced, with permission, from Stites D. P., Stobo J.D., Wells J.V. (eds.). Basic and Clinical Immunology, 6th ed. Appleton and Lange, 1987.)
Таблица 55.1. Свойства цепей иммуноглобулинов человека. (Reproduced, with permission, from Stites D. P., Stobo J. D., Wells J.V. (editors). Basic and Clinical Immunology, 6th ed., Appleton and Lange, 1987.)
|
Обозначение |
Тяжел |
ые цепи (Н) |
Легкие цепи (L) |
Секреторный компонент |
J-цепь |
||||
|
Классы, в которых имеются |
y |
а |
μ |
δ |
ε |
к |
λ |
СК |
J |
|
соответствующие цепи |
IgG |
IgA |
IgM |
IgD |
IgE |
Все классы |
Все классы |
IgA |
IgA, IgM |
|
Подклассы или подтипы |
1, 2, 3, 4 |
1, 2 |
1, 2 |
... |
... |
... |
1. 2, 3, 4 |
... |
... |
|
Аллотипические варианты |
Gm(1)-(25) |
А 2m(1), (2) |
... |
... |
... |
Кm(1)-(3)1) |
... |
... |
... |
|
Молекулярная масса (приблизительно) |
50 0002) |
55000 |
70000 |
62000 |
70000 |
23000 |
23000 |
70000 |
15000 |
|
Подгруппы V-области |
VHI-VHIV |
VкI-VкIV |
VλI-VλVI |
||||||
|
Углеводы (средний процент) |
4 |
10 |
15 |
18 |
18 |
0 |
0 |
16 |
8 |
|
Количество олигосахаридов |
1 |
2 или 3 |
5 |
? |
5 |
0 |
0 |
7 |
1 |
1) Прежде Inv (1)-(3).
2) Для у 3-60000.
Константные области молекул иммуноглобулинов, особенно Сн2 и Сн3 (а также Сн4 в IgM и IgE), образующие Fc-фрагмент, ответственны за эффекторные функции иммуноглобулинов, специфические для данного класса (табл. 55.2). Некоторые иммуноглобулины, например IgG, существуют только в тетрамерной форме. Другие иммуноглобулины (IgA и IgM) могут формировать олигомеры более высокого порядка, включающие два или три (IgA) или пять (IgM) тетрамеров (рис. 55.5).
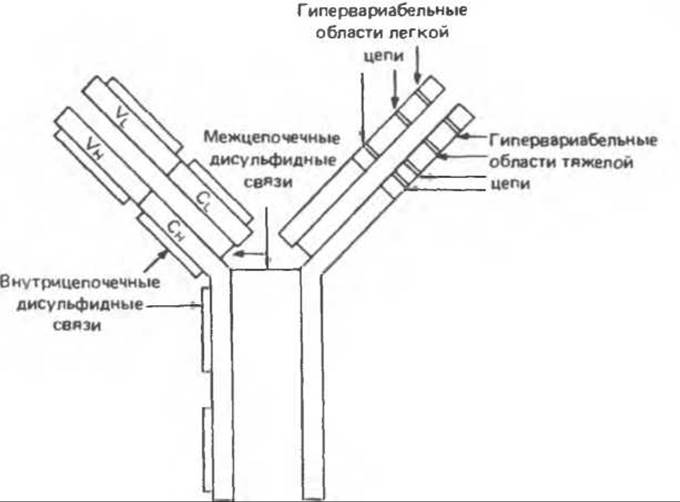
Рис. 55.4. Схематическая модель молекулы IgG, показывающая примерное расположение гипервариабельных областей в тяжелых и легких цепях. (Modified and reproduced, with permission, from Stites D. P., Stobo J. D., Wells J. V. (eds.). Basic and Clinical Immunology. 6th ed. Appleton and Lange. 1987.)
Таблица 55.2. Свойства иммуноглобулинов человека. (Reproduced, with permission, from Stites D. P., Stobo J. D., Wells J. V. (editors): Basic and Clinical Immunology, 6th, ed. Appleton and Lange, 1987.)
|
IgG |
IgA |
IgM |
IgD |
IgE |
|
|
Класс тяжелой цепи |
у |
а |
μ |
δ |
ε |
|
Подкласс тяжелой цепи |
у 1 у2 у3, у4 |
a1, а2 |
μ1, μ2 |
||
|
Тип легкой цепи |
к, λ |
к, λ |
к, λ |
к, λ |
к, λ |
|
Молекулярная формула |
у1 L2 |
а2 L2+ (а2 L2)2 СК J+ |
(а2 L2)5 J+ |
δ2 L2 |
ε2 L2 |
|
Коэффициент седиментации (S) |
6-7 |
7 |
19 |
7 8 |
8 |
|
Молекулярная масса (приблизительно) |
150000 |
160000 + 400000** |
900000 |
180000 |
190000 |
|
Электрофоретическая подвижность |
у |
Быстрый у-ß |
Быстрый а-ß |
Быстрый у |
Быстрый у |
|
Реакция связывания комплемента (классическая) |
+ |
0 |
+ + + + |
0 |
0 |
|
Концентрация в сыворотке (мг %) (приблизительно) |
1000 |
200 |
120 |
3 |
0,05 |
|
Перенос через плаценту |
+ |
0 |
0 |
0 |
0 |
|
Реакция на реагин |
? |
0 |
0 |
0 |
+ + + + |
|
Лизис бактерий |
+ |
+ |
+ + + |
? |
1 |
|
Антивирусная активность |
+ |
+ + + |
+ |
? |
? |
+ Для мономерного IgA сыворотки
+ J цепь
’ Секреторный компонент
** Для секреторного IgA
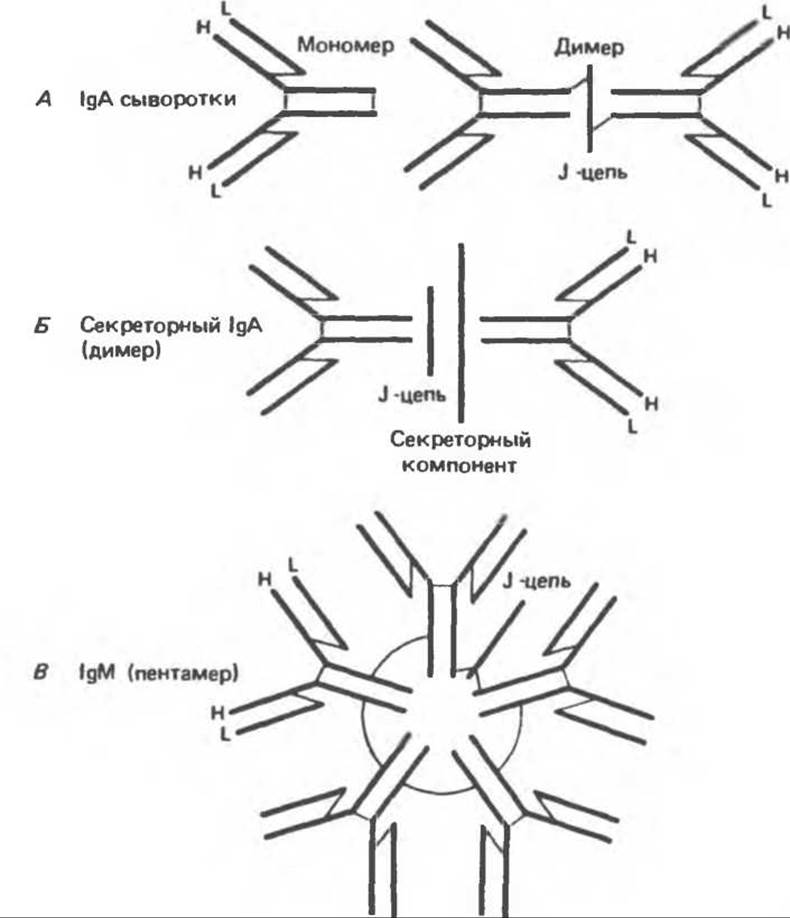
Рис. 55.5. Схематическое изображение полимерных молекул иммуноглобулинов человека. Полипептидные связи обозначены жирными линиями; межцепочечные дисульфидные связи — тонкими линиями. (Reproduced, with permission, from Stites D. P., Stobo J.D., Wells J. V. (eds.). Basic and Clinical Immunology, 6th ed. Appleton and Lange, 1987.)
Тяжелые и легкие цепи синтезируются в виде отдельных молекул, и затем в В-клетках или плазматических клетках из них образуются зрелые иммуноглобулины, являющиеся (без исключения) гликопротеинами (табл. 55.1).
Каждая легкая цепь иммуноглобулина — это продукт по крайней мере трех отдельных структурных генов; гена вариабельной области (VL), гена соединяющей области (J) (не имеющей отношения к J- цепи IgA или IgM) и гена константной области (CL). Каждая тяжелая цепь является продуктом по крайней мере четырех различных генов: гена вариабельной области (VH), гена разнообразия (D), гена соединяющей области (J) и гена константной области (СH). Таким образом, классическая схема «один ген — один белок» в данном случае не применима. Молекулярные механизмы, ответственные за синтез отдельных цепей иммуноглобулинов несколькими структурными генами, обсуждаются в гл. 38 и 41.
Каждый индивид способен синтезировать антитела против примерно одного миллиона различных антигенов. Такое разнообразие антител определяется комбинациями различных структурных генов, участвующих в образовании каждой из цепей иммуноглобулинов, а также высокой частотой соматических мутаций в генах VH и VL-областей.
В большинстве иммунных ответных реакций антитела идентичной специфичности, но разных классов образуются в ответ на введение иммуногена (иммунизирующего антигена) в строго хронологическом порядке. Один тип антиген-специфичной легкой цепи иммуноглобулина может соединиться с антиген-специфичной μ-тяжелой цепью с образованием молекулы IgM. Позднее та же антиген-специфичная легкая цепь соединяется с у-тяжелой цепью, имеющей идентичную вариабельную VH-область, с образованием молекулы иммуноглобулина IgG с антигенной специфичностью такой же, что и у молекул IgM. Далее та же легкая цепь может связаться с тяжелой a-цепью, содержащей идентичную VH. При этом образуется молекула IgA, у которой антигенная специфичность аналогична той, которую имела молекула IgG. Эти три класса иммуноглобулинов (IgM, IgG и IgA), синтезирующихся в ответ на один и тот же антиген, обладают идентичными вариабельными доменами в легких (VL) и тяжелых (VH) цепях; их называют идиотипическими (идиотипы). О различных классах изотипов говорят в том случае, когда различные СH-области комбинируются с одной и той же антиген-специфичной VH-областью. В гл. 41 обсуждаются механизмы генетической регуляции, ответственной за переключение генов СH-области.
Известны заболевания, при которых увеличивается продукция определенных классов или даже определенных молекул иммуноглобулинов. Например, именно так обстоит дело при возникновении клональной опухоли плазматических клеток (так называемой миеломы). Напротив, при гипогаммаглобулинемии снижается синтез либо какого-то одного класса иммуноглобулинов (например, IgA или IgG), либо всех вместе (IgA, IgD, IgE, IgG, IgM). Почти во всех случаях изменения в уровне иммуноглобулинов обусловлены нарушением либо скорости синтеза этих молекул, либо их секреции. Причины таких изменений весьма многочисленны.