Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Организация и репликация ДНК
Синтез и репликация ДНК
Основное функциональное значение процесса репликации ДНК заключается в снабжении потомства генетической информацией. Для обеспечения генетической стабильности организма и вида ДНК должна реплицироваться полностью и с очень высокой точностью. Процесс репликации ДНК весьма сложен. В нем участвует множество ферментов. Первое энзимологическое исследование репликации ДНК было проведено Артуром Корнбергом, открывшим в Escherichia coli фермент, ныне называемый ДНК- полимеразой I. Этот фермент проявляет несколько типов ферментативной активности и характеризуется сложной структурой. В качестве субстратов ДНК-полимераза I использует дезоксирибонуклеозидтрифосфаты — производные аденина, гуанина, цитозина и тимина. Полимеразная активность, впервые продемонстрированная для ДНК-полимеразы I, свойственна остальным полимеразам прокариотических и эукариотических клеток, при этом важно помнить, что основной функцией ДНК-полимеразы I Е. coli, как было установлено, является репарация ДНК.
Инициация синтеза ДНК
Для инициации синтеза ДНК (рис. 38.13) требуются короткие (10—200 нуклеотидов) последовательности РНК, выполняющие функции затравок (праймеров). Синтез начинается с реакции между 3'-гидроксильной группой РНК-затравки и а-фосфатной группой дезоксирибонуклеозидтрифосфата, в ходе которой дезоксирибонуклеозидный остаток присоединяется к РНК-затравке с одновременным выщеплением пирофосфата. 3'-гидроксильная группа присоединенного дезоксирибонуклеозидмонофосфата осуществляет далее нуклеофильную атаку на а-фосфатную группу следующего встраивающегося дезоксирибонуклеозидтрифосфата, также с отщеплением пирофосфата. Естественно, что выбор очередного нуклеотида на каждом шаге синтеза определяется матричной цепью ДНК согласно правилам, предложенным впервые Уотсоном и Криком (рис. 38.14). Так, если в соответствующем положении матричной цепи находится остаток адениндезоксирибонуклеозидмонофосфата, то в реакцию будет вступать тимидинтрифосфат и его а-фосфатная группа будет атаковаться 3'-гидроксильной группой последнего остатка растущей цепи. Реакция происходит только в том случае, если встраиваемый нуклеотид образует комплементарную пару с очередным нуклеотидом матричной цепи ДНК и благодаря водородным связям занимает положение, при котором 3'-гидроксильная группа растущей цепи атакует новый нуклеотид и включает его в полимер. Последовательности ДНК, присоединенные к РНК-затравкам, были названы по имени открывшего их японского ученого — фрагментами Оказаки (рис. 38.15). У млекопитающих после образования значительного числа фрагментов Оказаки репликационный комплекс приступает к удалению РНК-затравок и заполнению образующихся брешей соответствующими дезоксирибонуклеотидами. Затем с помощью ДНК-лигазы фрагменты «сшиваются» между собой с образованием непрерывной цепи ДНК.
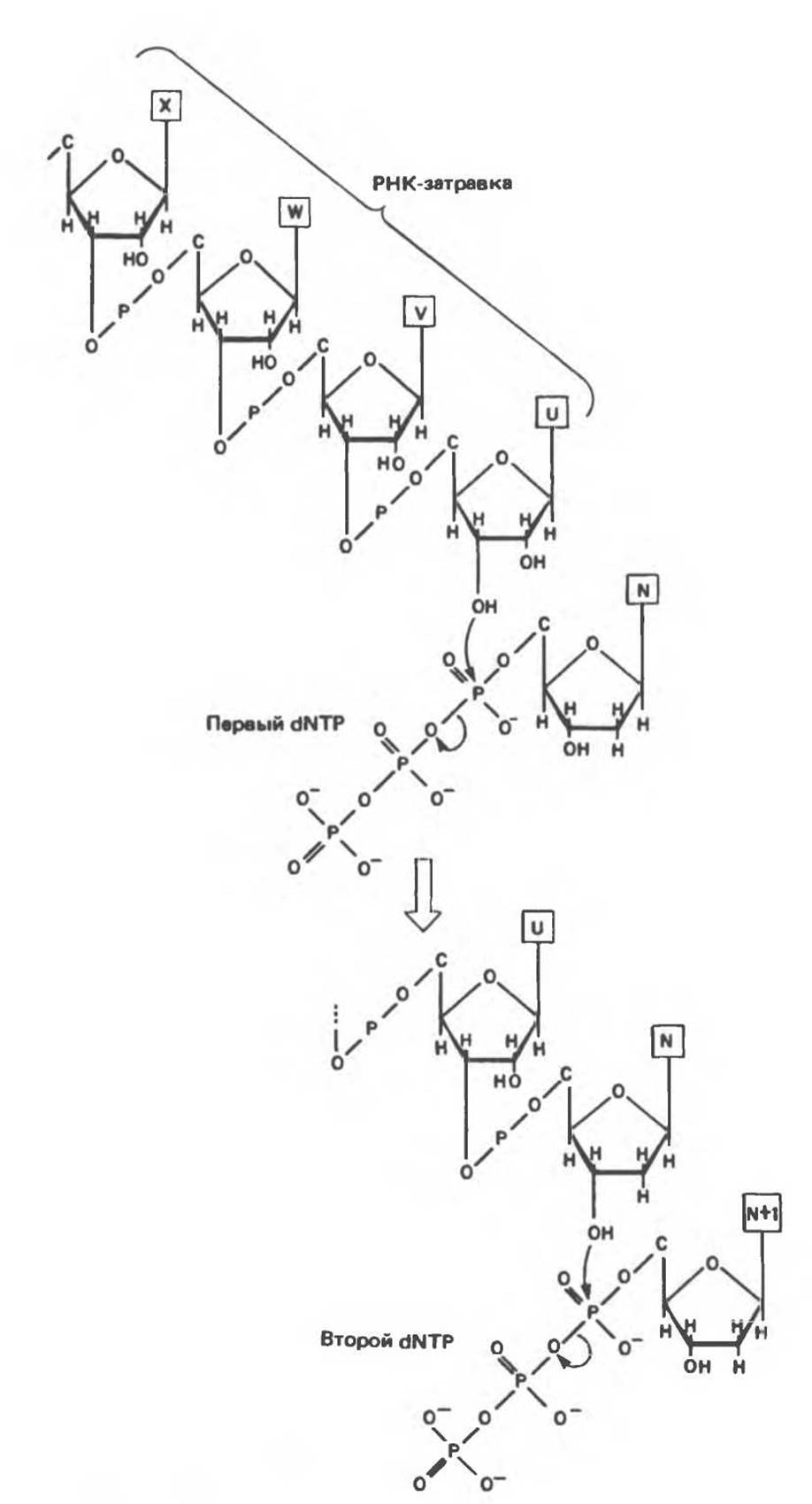
Рис. 38.13. Инициация синтеза ДНК РНК-затравкой и последующее присоединение второго дезоксирибонуклеозидтрифосфата.
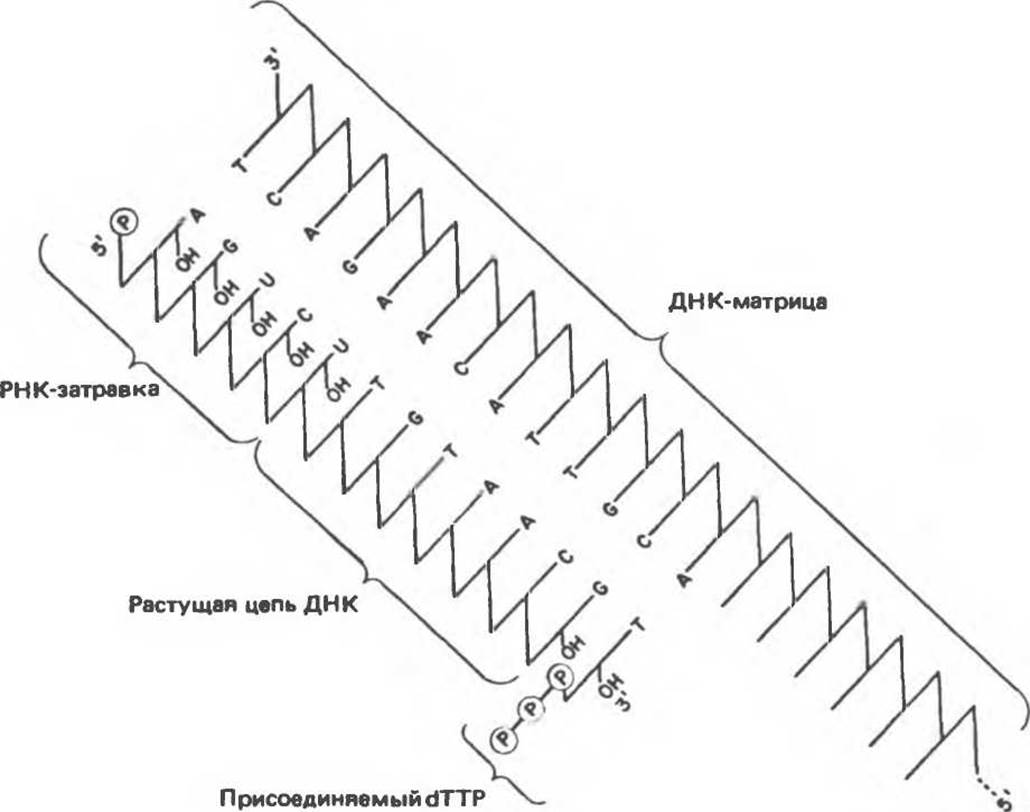
Рис. 38.14. Матричная функция ДНК-цепи при инициированном РНК-затравкой синтезе комплементарной цепи.

Рис. 38.15. Прерывистая полимеризация дезоксирибонуклеотидов и образование фрагментов Оказаки.
Полярность репликации
Как уже отмечалось, молекулы ДНК состоят из двух антипараллельных цепей. Репликация ДНК у про- и эукариот происходит одновременно на обеих цепях. Однако фермента, ведущего синтез ДНК в направлении 3'→5' не существует, и, следовательно, вновь синтезируемые цепи, казалось бы, не могут расти в одном и том же направлении одновременно. Несмотря на это противоречие, один и тот же фермент осуществляет практически синхронный синтез обеих цепей. При этом цепь, синтезируемая в направлении 5'→3' («лидирующая»), оказывается непрерывной. Синтез второй («отстающей») цепи осуществляется фрагментами по 150—200 нуклеотидов. Очередные акты инициации синтеза этих фрагментов, происходящего в каждый данный момент также в направлении 5'→3', осуществляются по мере общего продвижения репликационной вилки в одном направлении. Схема «полунепрерывного» синтеза ДНК представлена на рис. 38.16.
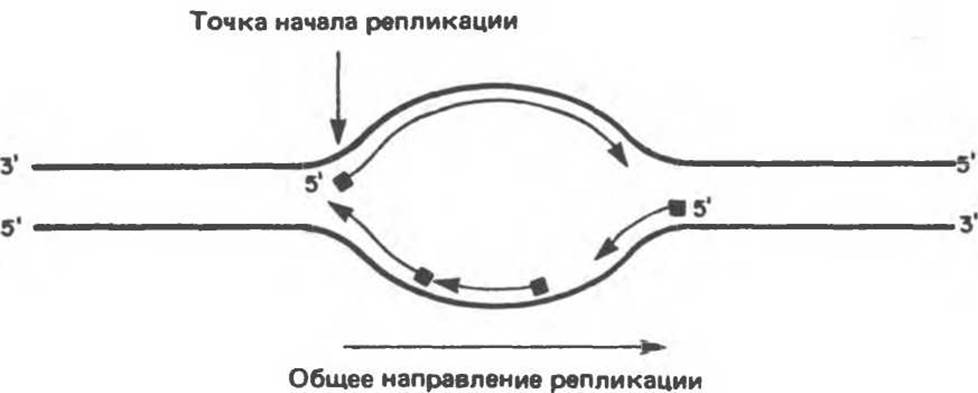
Рис. 38.16. Процесс полунепрерывной, одновременной репликации обеих цепей двухцепочечной ДНК.
При репликации ядерной ДНК млекопитающих большая часть РНК-праймеров в конце процесса удаляется, между тем при репликации митохондриального генома небольшие фрагменты РНК остаются интегрированными в замкнутой кольцевой молекуле ДНК.
Ферменты полимеризации и репарации ДНК
В ядрах клеток млекопитающих имеется класс полимераз, так называемых полимераз альфа (Pol а), ответственных за хромосомную репликацию. Одна молекула Pol а способна включать в растущую цепь около 100 нуклеотидов в секунду, таким образом она функционирует примерно в десять раз медленнее, чем бактериальная ДНК-полимераза. Снижение скорости может объясняться помехами со стороны нуклеосом. Как ДНК-полимераза преодолевает нуклеосомы — неизвестно. Однако известно, что после завершения репликации соответствующие нуклеосомы оказываются распределенными случайным образом в обеих дочерних цепях.
В ядрах клеток млекопитающих обнаружена также ДНК-полимераза с меньшей, нежели у Pol а, молекулярной массой — полимераза бета (Pol ß), которая не участвует в обычном процессе репликации, но необходима для репарации ДНК (см. ниже). Еще одна, митохондриальная, ДНК-полимераза гамма (Pol
у) осуществляет репликацию кольцевого генома митохондрий.
Полная репликация генома млекопитающих заканчивается за 9 часов — время, необходимое для удвоения генетического материала диплоидной делящейся клетки. Такая скорость свидетельствует о том, что репликация начинается сразу на многих участках, называемых точками начала репликации и обозначаемых ori (от англ. origin — начало). Таких точек (сайтов) насчитывается около 100. Репликация происходит в двух направлениях, и обе цепи реплицируются одновременно. При этом на хромосоме образуются так называемые «репликационные пузыри» (рис. 38.17).
Сайты, выполняющие роль точек начала репликации у эукариот, определены не достаточно четко. Более полные данные в этом плане имеются для дрожжей и нескольких вирусов животных. Можно сказать с уверенностью, что процессы инициации контролируются как в пространственном аспекте, так и во временном, поскольку соседние кластеры ori инициируются синхронно. Существует представление о том, что функциональные домены хроматина реплицируются как целостные единицы. При этом подразумевается, что точки начала репликации расположены вполне определенным образом по отношению к единицам транскрипции.

Рис. 38.17. Образование «репликационных пузырей» в процессе синтеза ДНК. Показаны двунаправленность репликации и предполагаемое расположение белков, расплетающих цепь, в репликационных вилках.
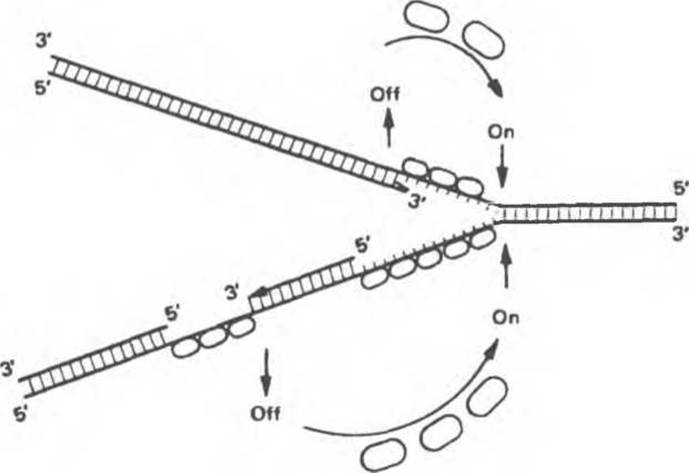
Рис. 38.18. Гипотетическая схема действия белка, специфичного к одноцепочечной ДНК в репликационной вилке. По мере синтеза второй цепи белок высвобождается и присоединяется к вновь образованным участкам одноцепочечной ДНК. (Courtesy of В. Alberts.)
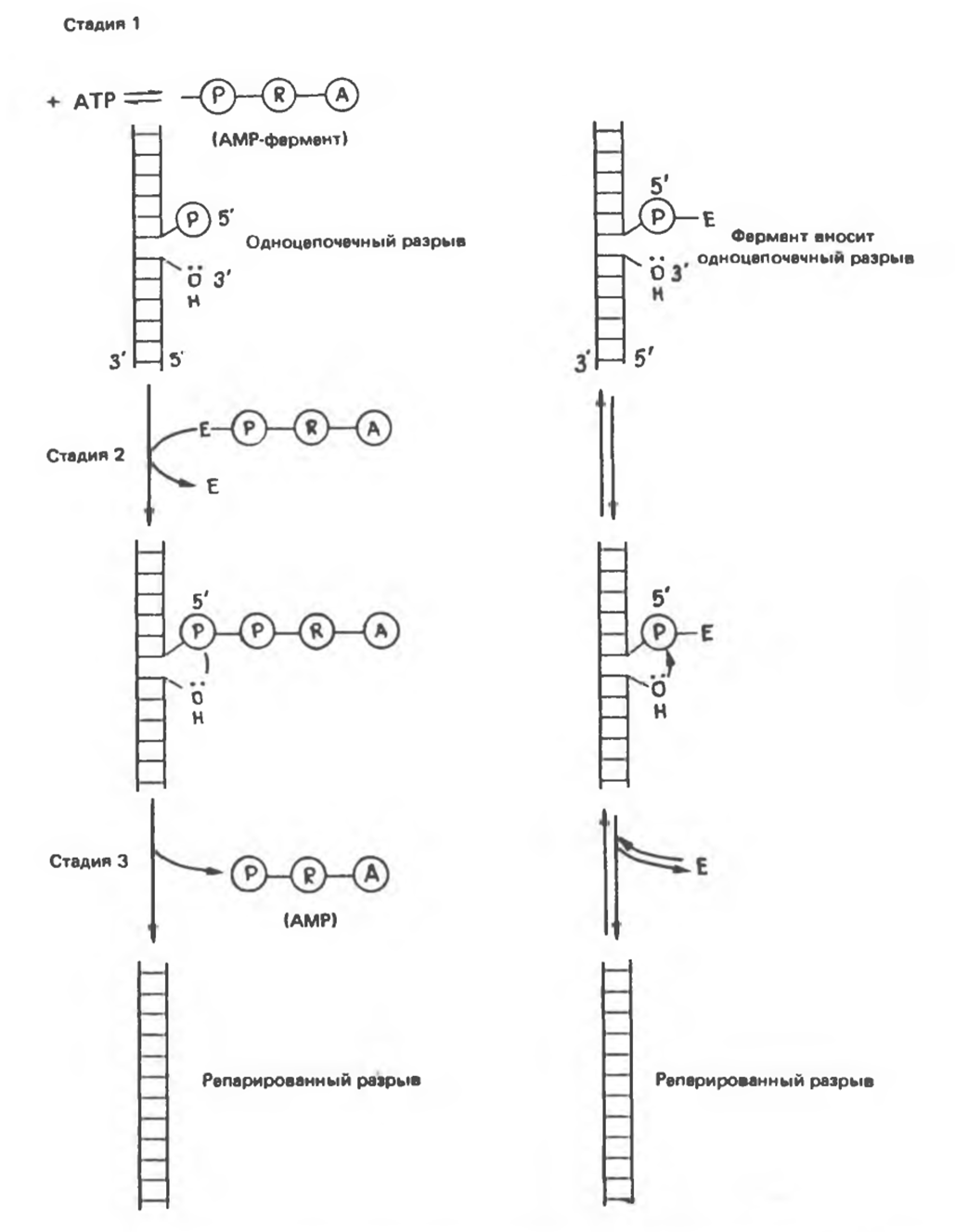
Рис. 38.19. Сравнение двух типов реакций, репарирующих одноцепочечные разрывы ДНК. Реакции, представленные слева, катализируются ДНК-лигазой, а представленные справа — ДНК-топоизомеразой. (Slightly modified and reproduced, with permission from Lehninger A. L.: Biochemistry, 2nd ed. Worth, 1975.)
При репликации двухцепочечная ДНК должна разойтись на индивидуальные цепи с тем, чтобы каждая из них могла функционировать в роли матрицы. Разделению цепей ДНК содействуют молекулы специфических белков, стабилизирующих одноцепочечную структуру при продвижении репликационной вилки. Стабилизирующие белки стехиометрически связываются с одиночной цепью, не мешая при этом нуклеотидам выступать в роли матрицы (рис. 38.18). Наряду с разделением цепей должно происходить и раскручивание спирали (1 оборот на каждые 10 нуклеотидов), сопровождаемое скручиванием вновь синтезированных дочерних цепей. Учитывая время, за которое происходит репликация у прокариот, можно рассчитать, что молекула ДНК должна раскручиваться со скоростью 400 000 об/сек, что совершенно невозможно. Следовательно, должны существовать множественные «шарниры», расположенные по всей длине молекулы ДНК. Шарнирные функции выполняет специальный фермент (ДНК-топоизомераза), вносящий разрывы в одну из цепей раскручиваемой двойной спирали. Разрывы быстро зашиваются этим же ферментом без дополнительных энергетических затрат, поскольку необходимая энергия запасается в форме макроэргической ковалентной связи, возникающей между сахарофосфатным остовом цепи ДНК и топоизомеразой. Представленную на рис. 38.19 схему этого процесса можно сравнить с последовательностью событий сшивания разрыва в ДНК, катализируемых ДНК-лигазой. ДНК-топоизомеразы ответственны также за раскручивание суперспирализованной ДНК. Суперспирализованная ДНК — это высокоупорядоченная структура, образуемая кольцевыми или сверхдлинными молекулами ДНК при закручивании вокруг гистонового кора (рис. 38.20).
Один из классов вирусов животных (ретровирусы) обладает ферментами, способными синтезировать молекулу ДНК по матрице РНК. РНК-зависимая ДНК-полимераза, или обратная транскриптаза (таково название этого фермента), сначала синтезирует РНК-ДНК-гибрид, используя рибонуклеиновый геном вируса в качестве матрицы. Затем фермент РНКаза Н удаляет РНК-цепь, а оставшаяся ДНК-цепь в свою очередь служит матрицей для синтеза второй цепи ДНК. Таким образом возникает кДНК — двухцепочечная ДНК-копия, содержащая информацию, первично представленную в виде РНК-генома ретровируса.
Регуляция синтеза ДНК
В клетках животных и человека репликация ДНК происходит только в определенный период жизни клетки. Этот период называется синтетическим (так называемая S-фаза). S-фаза отделена от митоза предсинтетическим (G1) и постсинтетическим (G2) периодами (рис. 38.21). Первичная регуляция клеткой синтеза собственной ДНК заключается в том, что репликация происходит в строго определенное время и в основном в клетках, готовящихся к делению. В регуляции вступления клетки в S-фазу участвуют циклические пуриновые нуклеотиды и, возможно, сами субстраты синтеза ДНК. Механизм такой регуляции остается неизвестным. Многие онковирусы способны ослаблять или разрушать внутренние информационные связи, контролирующие вступление клеток в S-фазу. И в этом случае механизм остается неясен, хотя, возможно, он включает фосфорилирование определенных белковых молекул хозяйской клетки.
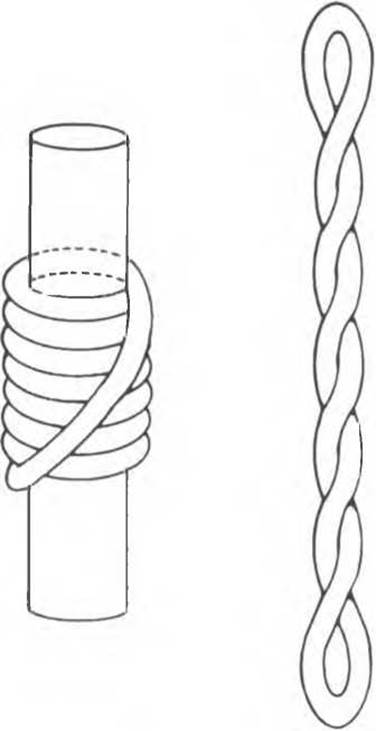
Рис. 38.20. Суперскручивание ДНК. Левозакрученная тороидная (соленоидная) сверхспираль (слева) превращается в правозакрученную при удалении цилиндрического ядра. Аналогичный переход происходит при разрушении нуклеосом в случае экстракции гистонов концентрированными солевыми растворами.
В S-фазе клетки млекопитающих содержат большее количество полимеразы а, чем в несинтетические периоды клеточного цикла. Кроме того, в S- фазе усиливается активность ферментов, участвующих в образовании субстратов синтеза ДНК (дезоксирибонуклеозидтрифосфатов). Активность этих ферментов падает при выходе из S-фазы и остается на низком уровне вплоть до поступления сигнала к возобновлению синтеза ДНК. В S-фазе происходит полная и строго однократная репликация ядерной ДНК. Создается впечатление, что реплицированный хроматин каким-то образов маркируется, в результате чего создаются помехи для дальнейшей репликации до тех пор, пока клетка не пройдет митоз. Можно предположить, что в качестве такого ковалентного маркера выступают метильные группы (т.е. маркирование ДНК осуществляется за счет ее метилирования).

Рис. 38.21. Цикл деления клеток млекопитающих. Фаза синтеза ДНК (S-фаза) отделена от митоза периодами G1 и G2. (Стрелкой указано направление цикла клеточного развития.)
Как правило, каждая данная пара хромосом реплицируется одновременно и в строго определенный промежуток S-фазы. Природа сигналов, регулирующих синтез ДНК на этом уровне, неизвестна, но, по-видимому, таким механизмом регуляции обладает каждая индивидуальная хромосома.
Деградация и репарация ДНК
Передача наследственной информации в неискаженном виде — важнейшее условие выживания как каждого конкретного организма, так и вида в целом. Следовательно, в ходе эволюции должна была сформироваться система, позволяющая клетке исправлять нарушения ДНК, вызванные ошибками репликации или повреждающими воздействиями окружающей среды. Подсчитано, что в результате повреждений, обусловленных этими причинами, в геноме клеток зародышевой линии человека происходит в среднем шесть нуклеотидных замен в год. По-видимому, в соматических клетках за год происходит примерно такое же число мутаций.
Как описано в гл. 37, основным условием точной репликации является правильное образование пар нуклеотидов. Точность комплементарных взаимодействий зависит от того, находятся ли пуриновые и пиримидиновые нуклеотиды в благоприятной для спаривания таутомерной форме (рис. 34.7). В равновесии концентрация благоприятных таутомерных
форм нуклеотидов превышает концентрацию неблагоприятных таутомеров в 104—105 раз. Этого явно недостаточно для обеспечения безошибочного узнавания. Вот почему в клетках бактерий и млекопитающих существует специальная система мониторинга точности спаривания нуклеотидов. Этот этап проверяется дважды: первый раз — при включении дезоксирибонуклеозидтрифосфатов в растущую цепь и второй раз — уже после включения, с использованием энергозависимого механизма удаления ошибочно встроенных нуклеотидов из вновь синтезированной нити ДНК. Благодаря такому контролю ошибки включения происходят не чаще чем 1 раз на 108—106 пар оснований. В клетках Е. coli этот механизм обеспечивается ДНК-полимеразой, обладающей 3'→5'-экзонуклеазной активностью. В то же время ДНК-полимеразы млекопитающих не обладают явно выраженной корректирующей нуклеазной активностью.
Физические и химические факторы окружающей среды вызывают в ДНК повреждения четырех типов (см. табл. 38.2). Поврежденные участки могут быть подвергнуты репарации, замещены путем рекомбинации или остаться без изменений. В последнем случае возникают мутации, потенциально ведущие к гибели клетки. Возможность репарации и замещения базируется на избыточности информации закодированной в структуре двухспиральной ДНК: дефектная область одной цепи ДНК может быть исправлена по неповрежденной комплементарной цепи.
Ключевой момент всех рекомбинационных и репарационных событий — распознавание дефекта, сопровождающееся либо непосредственной репарацией, либо маркированием для последующего исправления. Термолабильность N-гликозидной связи пуринов приводит к депуринизации ДНК с частотой около 5000—10000 на клетку (в день) при 37° С. Места депуринизации узнаются специальными ферментами, специфически заполняющими брешь без разрыва фосфодиэфирного остова молекулы.
Таблица 38.2. Типы повреждений ДНК
|
I. Затрагивающие единичные нуклеотиды A. Депуринизация Б. Дезаминирование цитозина до урацила B. Дезаминирование аденина до гипоксантина Г. Алкилирование оснований Д. Вставка или делеция нуклеотида Е. Включение основания-аналога |
|
II. Затрагивающие пару нуклеотидов А. УФ-индуцируемое образование тиминовых димеров Б. Поперечные сшивки бифункциональным алкилирующим агентом |
|
III. Разрывы цепей А. Ионизирующая радиация Б. Радиоактивная дезинтеграция каркаса ДНК |
|
IV. Поперечные сшивки А. Между основаниями одной цепи или разных цепей Б. Между ДНК и молекулами белка (например, гистонами) |
Как цитозиновые, так и адениновые основания спонтанно дезаминируются с образованием урацила и гипоксантина соответственно. Поскольку в норме ДНК не содержит ни урацила, ни гипоксантина, нет ничего удивительного в том, что специфические N-гликозилазы узнают эти аномальные основания и удаляют их. Образовавшийся разрыв служит сигналом для действия репарационных пурин- или пиримидинспецифичных эндонуклеаз, расщепляющих фосфодиэфирную связь возле соответствующего участка повреждения. После этого при последовательном действии экзонуклеазы, репарационной ДНК-полимеразы и ДНК-лигазы происходит заполнение бреши и восстановление исходной правильной структуры (рис. 38.22). Эта цепь событий получила название эксцизионной репарации. Сходным образом происходит процесс репарации ДНК, содержащей алкилированные основания и аналоги оснований.
Восстановление делений и удаление вставок происходит при помощи рекомбинационных процессов, которые могут протекать либо с участием репликации, либо без нее.
Ультрафиолетовое излучение индуцирует образование пиримидин-пиримидиновых димеров. Этот процесс затрагивает преимущественно расположенные друг под другом тиминовые основания одной цепи (рис. 38.23). Для удаления тиминовых димеров в клетке существуют два механизма: эксцизионная репарация и фотореактивация. Этот способ репарации подразумевает фотоактивацию видимым светом специфического фермента, который обращает процесс, приведший к образованию димерной структуры.
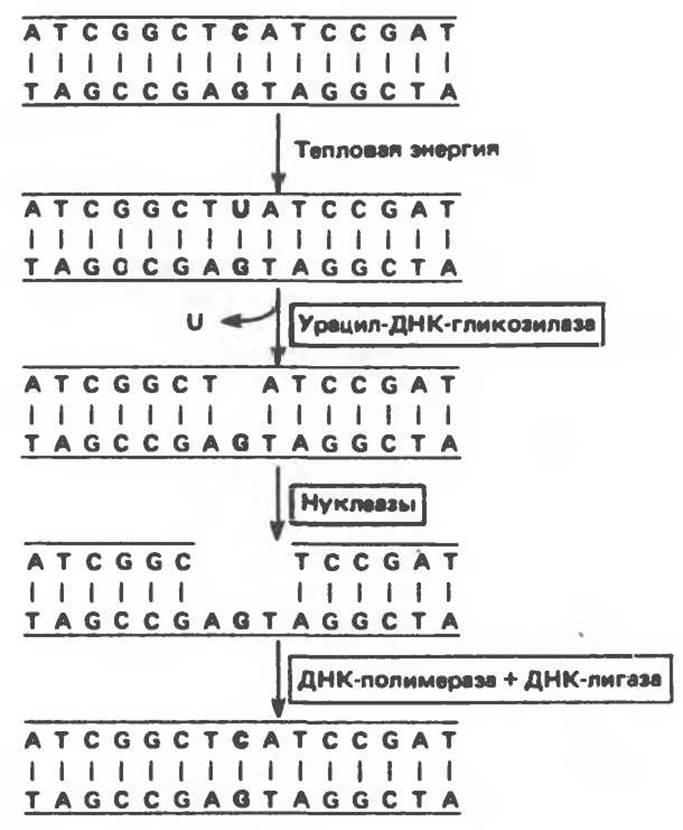
Рис. 38.22. Фермент урацил-ДНК-гликозилаза удаляет урацил, возникающий при спонтанном дезаминировании цитозина. (Courtesy of В. Alberts.)
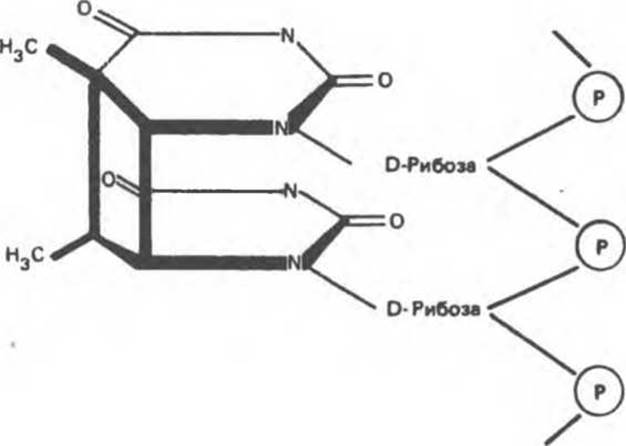
Рис. 38.23. Тимин-тиминовый димер, образующийся при связывании рядом расположенных тиминовых оснований.
Одноцепочечные разрывы ДНК, вызванные ионизирующей радиацией, могут быть репарированы прямым лигированием или рекомбинацией. Механизмы, вовлеченные в репарацию поперечных сшивок между основаниями противолежащих цепей или между ДНК и белками, изучены недостаточно.
Итак, репарация повреждений, вызванных ионизирующей радиацией и алкилированием оснований, осуществляется путем вырезания и ресинтеза коротких участков ДНК. Удаление повреждений, вызванных ультрафиолетовым облучением, а также поперечных сшивок достигается аналогичным путем, но в этом случае затрагиваются более протяженные участки ДНК. В клетках млекопитающих о протекании репарационной репликации свидетельствует внеплановый синтез ДНК, т.е. включение в ДНК радиоактивных предшественников вне S-фазы.
При интенсификации процессов эксцизионной репарации в ответ на повреждающие воздействия в клетках млекопитающих усиливается активность фермента поли(АDР-рибозил)-полимеразы. Этот фермент при участии кофермента NAD+ осуществляет реакцию ADP-рибозилирования белков хроматина. В основном происходит моно- ADP-рибозилирование, однако иногда имеет место присоединение гомополимерных цепочек (ADP-рибоза)n. Функция поли(АDР-рибозил)-полимеразы или ее продукта — (ADP-рибоза)n — в процессе эксцизионной репарации не вполне ясна. Наблюдается корреляция во времени между интенсификацией процессов репарации и увеличением активности фермента. Специфическое ингибирование активности данного фермента препятствует устранению разрывов в цепи ДНК. Увеличение активности poly (ADP-рибозил)полимеразы вызывается, по-видимому, фрагментацией ДНК в ядре. Такая фрагментация может быть индуцирована в первую очередь физическими агентами (например, рентгеновским излучением), кроме того, она может происходить неадекватно интенсивно в ходе репарации ультрафиолетовых повреждений или повреждений, вызванных алкилирующими агентами. Возрастание активности фермента, вызванное разрывами ДНК, бывает настолько велико, что может привести к истощению внутриклеточного запаса кофермента NAD+.
Пигментная ксеродерма — аутосомно-рецессивное наследственное заболевание. Клинический синдром включает чувствительность к солнечному свету (ультрафиолет), что приводит к образованию множества очагов рака кожи и летальному исходу. Это заболевание, по-видимому, связано с нарушениями репарационных процессов. В культивируемых клетках больных пигментной ксеродермой снижена интенсивность фотореактивации тиминовых димеров. Однако собственно генетические нарушения, приводящие к пигментной ксеродерме, насчитывают по меньшей мере 7 комплементационных групп, что указывает на комплексность причин, вызывающих данное заболевание.
При пигментной ксеродерме в клетках большинства (если не всех) комплементационных групп наблюдаются аномалии в скорости и интенсивности ответа поли(АDР-рибозил)-полимеразы на ультрафиолетовое облучение. В клетках по крайней мере одной комплементационной группы снижение активности фермента, по-видимому, связано с неспособностью разрезать цепь ДНК у поврежденного сайта,
поскольку добавление к таким дефектным клеткам дезоксирибонуклеазы нормализует уровень активности поли(АDР-рибозил)-полимеразы.
У больных с атаксией-телеангиэктазией (аутосомно-рецессивное заболевание, приводящее к мозжечковой атаксии и лимфоретикулярной неоплазме) повышена чувствительность к рентгеновскому облучению. У больных анемией Фанкони (аутосомно-рецессивная анемия, сопровождающаяся повышенной частотой онкологических заболеваний и хромосомной нестабильностью), вероятно, нарушена система репарации поперечных сшивок. Для всех трех описанных синдромов характерна повышенная частота возникновения опухолей. Вполне возможно, что в недалеком будущем будут выявлены другие заболевания человека, вызванные нарушениями в системе репарации повреждений ДНК.
Литература
Bauer W. R. et al. Supercoiled DNA, Sсi. Am. (July), 1980, 243, 118.
Cantor C.R. DNA choreography, Cell, 1981, 25, 293. Igo-Kemenes T., Hörz W., Zachau H.G. Chromatin, Annu. Rev. Biochem., 1982, 51, 89.
Jelinek W. R.. Schmid C. W. Repetitive sequences in eukaryotic DNA and their expression, Annu. Rev. Biochem., 1982,51, 813.
Jongstra J. et al. Induction of altered chromatin structures by simian virus 40 enhancer and promoter elements, Nature, 1984, 307, 708.
Kornberg A. DNA Replication, Freeman, 1980.
Lindahl T. DNA repair enzymes, Annu. Rev. Biochem., 1982, 51, 61.
Loeb L. A., Kunkel T. A. Fidelity of DNA synthesis, Annu. Rev. Biochem, 1982, 51, 429.
McGhee J. D., Felsenfeld G. Nucleosome structure, Annu. Rev. Biochem., 1980, 49, 1115.
Nossal N. G. Prokaryotic DNA replication systems, Annu. Rev. Biochem., 1983, 52, 581.