Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Характеристика эндокринной системы
Рецепторы гормонов
Общая характеристика рецепторов
Одна из трудноразрешимых проблем, с которой встречались исследователи при описании системы коммуникации, основанной на использовании гормонов, представлена на рис. 43.2. Во внеклеточной жидкости гормоны присутствуют в очень низкой концентрации — обычно в пределах 10-15—10-19 моль/л. Это намного ниже содержания других, структурно сходных соединений (стеролов, аминокислот, пептидов, белков) и иных веществ, которые находятся в крови в концентрации 10-5—10-3 моль/л. Следовательно, клетки-мишени должны отличать данный гормон не только от других гормонов, присутствующих в малых количествах, но и от прочих соединений, присутствующих в 106—109-кратном количестве. Столь высокую степень избирательности обеспечивают особые принадлежащие клетке молекулы узнавания, называемые рецепторами. Биологический эффект гормонов начинается с их связывания со специфическими рецепторами, а завершается, как правило, диссоциацией гормона и рецептора (в соответствии с тем принципом, что надежная система контроля должна обладать средством прерывания действия агента).
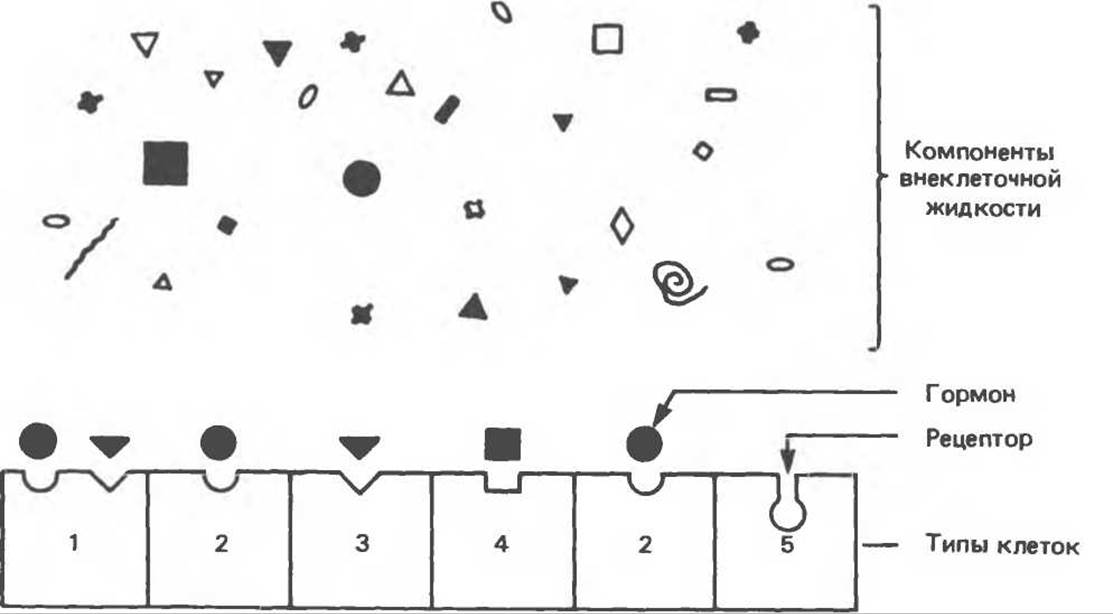
Рис. 43.2. Специфичность и избирательность рецепторов гормонов. Во внеклеточной жидкости содержится множество разнообразных соединений, но рецепторы узнают лишь очень немногие из них. Кроме того, рецепторы должны выбрать определенные молекулы из множества других, присутствующих в более высокой концентрации. На рисунке показано, что каждая клетка может нести либо один тип рецепторов, либо несколько.
Клетку-мишень определяют по способности избирательно связывать данный гормон с помощью такого рецептора, причем для количественной оценки взаимодействия используют радиоактивные лиганды, имитирующие связывание гормонов. Исследование проводится с соблюдением следующих правил: 1) введение радиоактивной метки не должно менять биологической активности лиганда; 2) связывание лиганда должно быть специфическим, т. е. добавление немеченого агониста или антагониста должно вытеснять метку; 3) связывание должно быть насыщаемо; 4) связывание должно происходить в тех же пределах концентраций, что и предполагаемый биологический ответ.
Домены узнавания и сопряжения на рецепторе
Все рецепторы, будь то рецепторы стероидов или полипептидов, имеют по крайней мере два функционально разных домена (участка): первый домен (домен узнавания) связывает гормон, а второй генерирует сигнал, который сопрягает узнавание гормона с определенным внутриклеточным процессом. Связывание гормона рецептором основано на том, что конформация какого-то участка молекулы гормона комплементарна участку молекулы рецептора. Степень сходства, или соответствия, определяет прочность связывания, измеряемую величиной константы сродства (К). Если у природного гормона относительная К равна 1, то у других природных соединений она колеблется от 0 до 1. Абсолютные же величины степени сродства (аффинности) могут различаться более чем в триллион раз. Для некоторых рецепторов были синтезированы лиганды с относительной К > 1; их используют в исследованиях биологии рецепторов.
Сопряжение (трансдукция сигнала) обеспечивается двумя основными механизмами. Полипептидные и белковые гормоны и катехоламины связываются с рецепторами, расположенными в плазматической мембране, и тем самым генерируют сигнал, который регулирует различные клеточные функции — обычно путем изменения активности ферментов. Стероидные и тиреоидные гормоны взаимодействуют с внутриклеточными рецепторами, и образовавшийся комплекс генерирует соответствующий сигнал (см. ниже).
У многих рецепторов полипептидных гормонов были идентифицированы аминокислотные последовательности этих двух доменов. Используя аналоги гормона, несущие замену той или иной специфической аминокислоты, можно изменить его связывание и биологическую активность. Рецепторы стероидных гормонов тоже обладают по крайней мере двумя функциональными доменами: один связывает гормон, другой связывается со специфической областью ДНК. В настоящее время для изучения этих рецепторов применяют метод рекомбинантных ДНК; как показывает структурный анализ, домены, связывающиеся с ДНК, в высокой степени гомологичны. В конечном итоге сущность рецептора определяется этой двойной функцией связывания и сопряжения, причем именно сопряжение между связыванием гормона и передачей (трансдукцией) сигнала — так называемое рецепторно-эффекторное сопряжение — служит первым этапом усиления ответа на гормон. Указанная двойная функция рецептора клетки-мишени составляет основное отличие его от белков- переносчиков плазмы, которые связывают гормон, но не генерируют сигнал.
Сравнение рецепторных и транспортных белков
Существует принципиальная разница между связыванием гормонов с рецепторами и их ассоциацией с различными транспортными белками (переносчиками). Соответствующее сопоставление сделано в табл. 43.1. Количество молекул рецептора, участвующих в связывании лиганда, составляет несколько тысяч на клетку, а само связывание характеризуется высокой аффинностью и специфичностью. Рецепторы способны к узнаванию и селекции специфических соединений в условиях градиента концентраций 106—107; при физиологических концентрациях гормона это связывание с рецепторами насыщаемо. Гормон-рецепторное взаимодействие зависит от температуры, pH и концентраций солей характерным для каждого гормона образом. Связывание определяется гидрофобным и электростатическим механизмами и потому легко обратимо, за исключением некоторых особых случаев.
В кровотоке стероидные и тиреоидные гормоны находятся в виде комплекса со специфическими транспортными белками. Такие белки значительно преобладают по количеству над внутриклеточными рецепторными белками, но обладают меньшей аффинностью и меньшей специфичностью связывания гормонов. Транспортные белки создают резервуар гормонов в крови, поскольку в связанном виде последние не подвергаются метаболизму и экскреции. Биологическая активность присуща только несвязанному (свободному) гормону. Пептидные и белковые гормоны не имеют специальных транспортных белков в плазме крови, и поэтому полупериод их жизни в крови намного меньше (секунды или минуты), чем у стероидных гормонов (часы).
Таблица 43.1. Сопоставление гормональных рецепторов и белков, транспортирующих гормоны в плазме крови
|
Свойство |
Рецепторы |
Транспортные белки плазмы крови |
|
Концентрация |
Очень низкая (тысячи молекул/клетка) |
Очень высокая (миллиарды молекул/мкл) |
|
Аффинность связывания (сродство) |
Очень высокая (1011—109 моль/л) |
Низкая (10-7—10-5 моль/л) |
|
Специфичность связывания |
Высокая |
Низкая |
|
Насыщаемость при физиологических концентрациях гормона |
Да |
Нет |
|
Обратимость связывания |
Да |
Да |
|
Трансдукция сигнала |
Да |
Нет |
Взаимосвязь между степенью занятости рецепторов и биологическим эффектом
Во многих случаях концентрация гормона, при которой он занимает (оккупирует) рецепторы, практически совпадает с той, при которой он вызывает биологический ответ (рис. 43.3, А). Это справедливо в отношении всех стероидных гормонов и ряда пептидных. Сам по себе данный факт удивителен, особенно если учесть количество этапов, разделяющих процесс связывания гормона и комплексный ответ на него, например индукцию фермента, лизис клетки или транспорт аминокислот. Но в некоторых случаях имеет место выраженная диссоциация этих двух процессов; максимальный биологический ответ наступает в условиях, когда занято лишь несколько процентов от общего количества рецепторов (рис. 43.3, Б, эффект 2). Рецепторы, не участвующие в индукции биологического ответа, называют резервными.
Резервные рецепторы были выявлены при изучении ответа на некоторые полипептидные гормоны; полагают, что они служат как средством увеличения чувствительности клетки-мишени к низким концентрациям гормона, так и резервуаром рецепторов. Представление о резервных рецепторах относится к категории рабочих гипотез; оно может корректироваться в зависимости от того, какой аспект действия гормона и на какой ткани подвергается изучению. Например, на клетках гранулезы получено прекрасное совпадение между связыванием гормона и синтезом сАМР (когда какие-либо гормоны активируют аденилатциклазу, резервных рецепторов, как правило, не обнаруживается); в то же время стероидогенез в этих клетках (сАМР-зависимый процесс) имеет место уже в условиях, когда занято менее 1% рецепторов (см. эффекты 1 и 2, рис. 43.3, Б). Для того чтобы в клетках печени произошла дерепрессия транскрипции гена фосфоенолпируваткиназы, достаточно, чтобы было занято существенно менее 1 % рецепторов инсулина; с другой стороны, на тимоцитах обнаружена высокая степень корреляции между связыванием инсулина и транспортом аминокислот. Примерами диссоциации между уровнем связывания рецепторов и выраженностью биологического эффекта может служить влияние катехоламинов на мышечное сокращение, липолиз и транспорт ионов. Предполагается, что эти конечные биологические реакции являются результатом каскадного усиления действия гормона. Обнаружено, что одна и та же клетка проявляет разную чувствительность к гормону в зависимости от того, о каком эффекте гормона идет речь. Так, в адипоцитах по мере нарастания занятости рецепторов инсулина происходит (последовательно) активация липолиза, окисления глюкозы, транспорта аминокислот и синтеза белка.

Рис. 43.3. Зависимость биологического эффекта от связывания гормона в условиях отсутствия (А) или наличия (Б. эффект 2) резервных рецепторов. В некоторых случаях биологический эффект может быть прочно сопряжен со связыванием гормона тканью, тогда как в отношении другого эффекта проявляется феномен резервных рецепторов (ср. эффекты 1 и 2 на рис. Б).
Регуляция рецепторов
Количество рецепторов в клетке или на ее поверхности находится в динамическом состоянии: оно регулируется физиологически и изменяется при заболеваниях или под влиянием терапевтических средств. Лучше изучены в этом отношении рецепторы, локализованные в плазматической мембране. Показано, что их концентрация и сродство к гормону (аффинность) являются регулируемыми параметрами. Изменение этих параметров происходит очень быстро и существенным образом сказывается на чувствительности клетки к гормону. Например, в клетках, подвергнутых воздействию ß-адренергических агонистов, в течение некоторого времени (от нескольких минут до часов) в ответ на новое добавление агониста прекращается активация аденилатциклазы и исчезает биологический ответ. Такая десенситязация опосредуется двумя механизмами. Первый включает утрату рецепторов плазматической мембраной. Эта понижающая регуляция осуществляется путем секвестирования (связывания) рецепторов в клетке, т. е. отделения их от других компонентов системы клеточного ответа, в частности от регуляторной и каталитической субъединиц аденилатциклазы (см. гл. 44). После удаления агониста рецепторы возвращаются на поверхность клетки и чувствительность к гормону восстанавливается. Второй механизм десенситизации ß-адренергической системы — ковалентная модификация рецепторов путем фосфорилирования. Это сАМР-зависимый процесс, который не сопряжен с изменением числа рецепторов и их перемещением. Как показали опыты по реконструкции мембран (включение рецепторов в мембраны, предварительно лишенные рецепторов), фосфорилированные рецепторы не способны активировать циклазу, что ведет к разобщению связывания гормона и активации клетки. Аналогичные примеры физиологической адаптации, осуществляемой путем понижающей регуляции количества рецепторов гомологичным гормоном, можно наблюдать в случае инсулина, глюкагона, ТРГ, гормона роста, ЛГ, ФСГ, катехоламинов. Некоторые гормоны (ангиотензин II и про л актин) осуществляют повышающую регуляцию своих рецепторов. Эти изменения количества рецепторов могут происходить очень быстро (за время, измеряемое минутами или часами), и, по-видимому, они служат важным средством регуляции биологического ответа. Эффект частичной утраты рецепторов на биологический ответ, вызываемый данной концентрацией гормона, определяется наличием или отсутствием резервных рецепторов. На рис. 43.4 показано, как влияет 5-кратное снижение количества рецепторов на кривую «концентрация — ответ» в зависимости от этого условия. В случае А (резервные рецепторы отсутствуют) величина ответа достигает лишь 20% от контроля; следовательно, происходит изменение Vmax. В случае Б (резервные рецепторы присутствуют) достигается максимальный ответ, но при гораздо более высокой концентрации гормона, чем в контроле; этот случай аналогичен изменению Км.
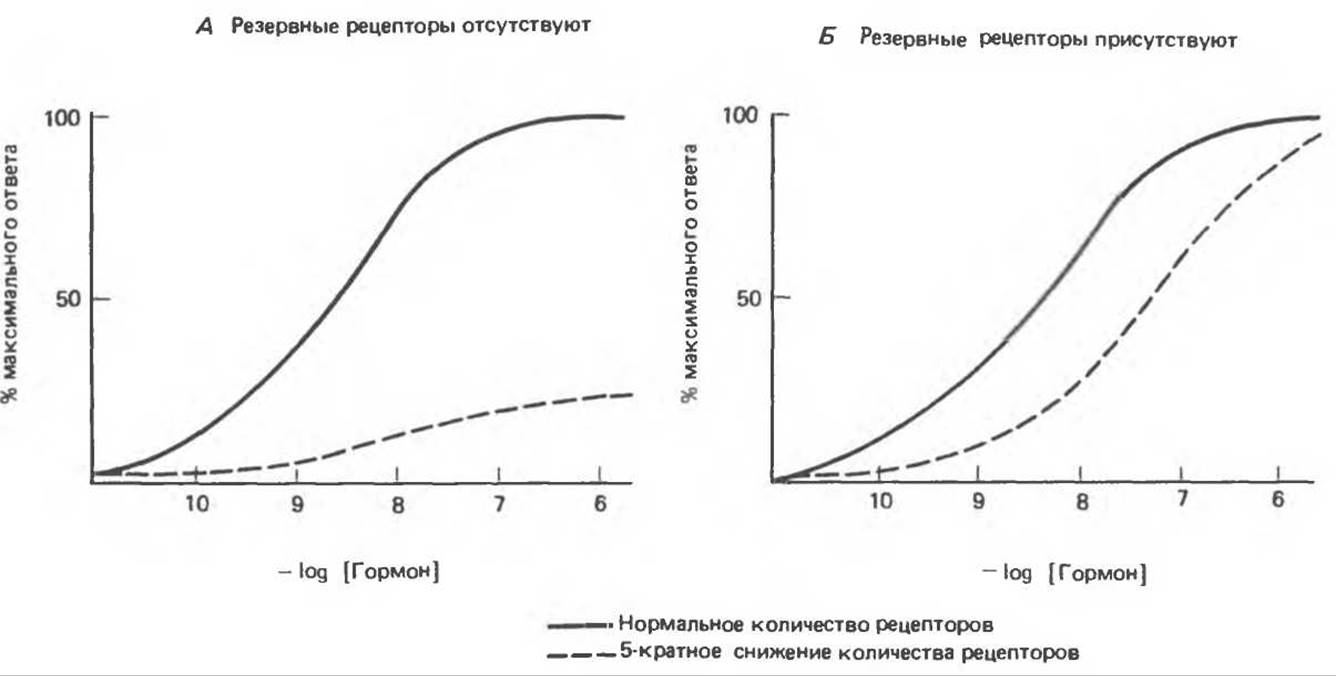
Рис. 43.4. Эффект 5-кратного снижения числа рецепторов на биологический ответ в системе, не содержащей (А) и содержащей (Б) резервные рецепторы.
Структура рецепторов
Лучше других изучен ацетилхолиновый рецептор, который легко получить в очищенном виде, так как он содержится в относительно большом количестве в электрическом органе угря Torpedo californiсa. Этот рецептор состоит из четырех суъединиц а2, ß, у и δ. Две а-субъединицы связывают ацетилхолин. Методом направленного мутагенеза были выявлены те области а-субъединицы, которые участвуют в образовании трансмембранного ионного канала, осуществляющего главную функцию рецептора ацетилхолина.
Содержание других рецепторов очень мало, и это препятствовало проведению их очистки и анализа. В настоящее время методы генной инженерии позволяют получать необходимое количество материала, и такие исследования стали активно развиваться. Удалось показать, что рецептор инсулина представляет собой гетеротетрамер (а2ß2), в котором субъединицы соединены множественными дисульфидными связями; выступающая из мембраны а- субъединица связывает инсулин, а пронизывающая мембрану ß-субъединица обеспечивает передачу сигнала, вероятно, при участии тирозинкиназы, составляющей цитоплазматическую часть этого полипептида. Рецепторы инсулиноподобного фактора роста І (ИФР I), эпидермального фактора роста (ЭФР) и липопротеинов низкой плотности (ЛНП) в целом сходны с рецептором инсулина (см. рис. 51.16). Рецепторы других полипептидных гормонов охарактеризованы хуже, но, основываясь на их чувствительности к ряду пептидаз и протеолитических ферментов, полагают, что они имеют общий белковый компонент. Во многих случаях для связывания гормона необходимы, по-видимому, интактные дисульфидные связи, фосфолипид и углеводные компоненты.
Рецепторы стероидных гормонов тоже являются белками. На протяжении последних лет была изучена их функция, а теперь начинает выясняться и структура. Рассмотрим в качестве примера рецептор глюкокортикоидов (рис. 43.2). Он содержит три функционально разные области: 1) участок связывания гормонов, расположенный в С-концевой части полипептидной цепи; 2) прилегающий к нему участок связывания ДНК; 3) специфическая область N-концевой половины белковой молекулы, необходимая для высокоаффинного связывания с соответствующим участком ДНК (и содержащая большую часть антигенных участков молекулы). Существование этих трех функциональных доменов было подтверждено путем анализа рецепторов, синтезированных с использованием ДНК. Видимо, такая структура в принципе свойственна разным типам рецепторов стероидных гормонов; при этом наблюдается высокая степень гомологии в последовательности аминокислот соответствующих участков. Очень любопытна также гомология между этим типом рецепторов и v-еrbА-онкогеном.

Рис. 43.5. Разные гормоны одного и того же класса могут различаться по активности. Одинаковый по силе ответ достигается при разных концентрациях гормонов.
Концепция агониста — антагониста
Химические соединения гормональной природы можно разделить на четыре группы в зависимости от способности вызывать биологический ответ, опосредованный рецептором данного гормона: агонисты, частичные агонисты, антагонисты и неактивные соединения. Эта классификация была очень подробно разработана применительно к глюкокортикоидам (см. гл. 48).
К агонистам относят соединения, способные вызвать максимальный ответ, однако необходимые для этого концентрации могут быть различны (рис. 43.5 и пример А на рис. 43.6). На рис 43.5 цифры 1, 2 и 3 можно отнести к инсулину свиньи, проинсулину свиньи и инсулину морской свинки соответственно. Во всех проверенных системах эти препараты инсулина вызывали примерно одинаковый по силе ответ, но при собственной для каждого из инсулинов концентрации. Аналогичным образом цифры 1, 2, 3 на этом рисунке могут обозначать дексаметазон, кортизол и кортикостерон (см. табл. 48.4).
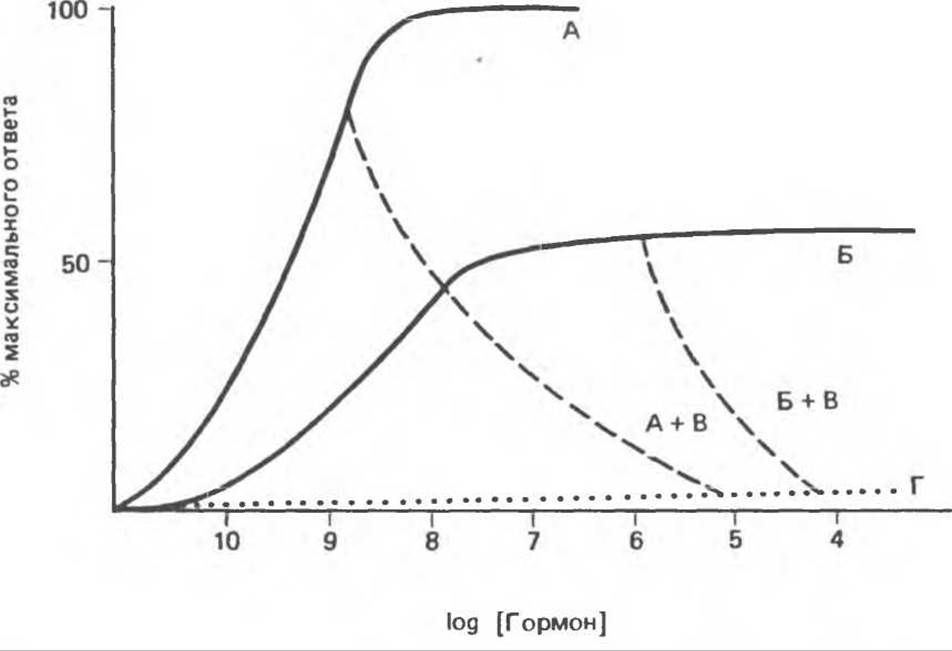
Рис. 43.6. Гормоны можно разделить на следующие группы: агонисты (А). частичные агонисты (Б), антагонисты (А + В и Б + В) и неактивные агенты (Г).
Частичные агонисты вызывают ослабленный ответ, даже если используются в очень высокой концентрации (см. рис. 43.6, Б). Антагонисты обычно не оказывают эффекта сами по себе, но полностью ингибируют действие агонистов и частичных агонистов (см. примеры А + В и Б + В на рис. 43.6). Большая группа соединений, структурно сходных с гормонами, не обладает собственным эффектом и не влияет на действие агонистов и антагонистов. Их относят к категории неактивных веществ (рис. 43.6, Г).
Частичные агонисты нередко конкурируют с агонистами за связывание с рецептором (и активацию его), и в этих случаях они становятся частичными антагонистами. Степень торможения активности агониста, вызываемая частичными или полными антагонистами, зависит от соотношения концентраций соответствующих стероидов. Как правило, антагонист вызывает торможение в концентрации намного большей, чем та, в которой агонист оказывает максимальный эффект. Столь высокие концентрации крайне редко возникают in vitro, однако этот феномен широко используется для исследования глюкокортикоидных гормонов в условиях in vitro.
В табл. 48.4 перечислены стероиды, использованные в исследованиях, на основании которых впервые было высказано предположение о двойной функции глюкокортикоидного рецептора, а именно связывание лиганда и — через обусловленное этим изменение структуры — связывание с ДНК. Из этой гипотезы следовало, что 1) агонисты связываются с рецептором, полностью его активируют и вызывают максимальный биологический ответ; 2) частичные агонисты полностью занимают рецептор, но не полностью его активируют и потому вызывают частичный биологический ответ; 3) антагонисты полностью занимают рецептор, но образовавшийся комплекс не способен связываться с ДНК и потому непосредственно не вызывает биологического ответа, однако эффект агонистов при этом блокируется.
После того как была выяснена роль рецепторов в действии гормонов, стало очевидно, что нарушение функции рецепторов может лежать в основе ряда заболеваний. В табл. 43.2 приведены три основные категории таких заболеваний. Первая группа охватывает случаи патологии, обусловленные появлением антител против рецепторов определенных гормонов. Эти антитела (класса IgG) могут блокировать связывание гормона (папиллярно-пигментная дистрофия кожи с инсулинорезистентностью; астма), имитировать связывание гормона (болезнь Грейвса) или повышать скорость оборота рецептора (тяжелая миастения).
Ко второй группе отнесены болезни, при которых не выявляется связывание гормона с рецептором. Действительно ли рецепторы в этих случаях отсутствуют или же они не выявляются из-за дефектов структуры, остается неизвестным, поскольку сам анализ рецепторов основан, как правило, на определении их связывания с гормонами.
Таблица 43.2. Гормональные рецепторы и связанные с ними заболевания
|
Заболевание |
Рецептор |
Характер нарушения |
|
Болезнь Грейвса (гипертиреоидизм) |
ТСГ |
Антитела стимулируют рецептор ТСГ |
|
Инсулиновый |
Антитела блокируют связывание инсулина с рецептором |
|
|
Папиллярно-пигментная дистрофия кожи с инсулинорезистентностью |
||
|
Миастения гравис |
Ацетилхолиновый |
Антитела способствуют повышению скорости оборота рецептора ацетилхолина |
|
Астма |
ß- Адренергический |
Антитела блокируют связывание ß- адренергических агентов с рецептором |
|
Наследственный нефрогенный несахарный диабет |
АДГ |
Дефицит рецепторов |
|
Синдром тестикулярной феминизации Псевдогипопаратиреоидизм |
Андрогенный ПГТ |
Дефицит рецепторов « » |
|
Рахит типа II, резистентный к витамину D |
Рецептор кальцитриола |
« » |
|
Ожирение |
Инсулиновый |
Снижение связывания гормона |
|
Сахарный диабет типа II [инсулиннезависимый сахарный диабет (ИНСД)] |
« |
То же |
Третья категория — это заболевания, обусловленные нарушением регуляции рецепторов. У больных, страдающих ожирением или же сахарным диабетом типа II и ожирением, нередко наблюдается непереносимость глюкозы и инсулинорезистентность, несмотря на повышенный уровень инсулина в крови. У таких больных снижено количество рецепторов инсулина (эффект понижающей регуляции) на клетках-мишенях — жировых, печеночных, мышечных. При похудании у этих больных постепенно снижается уровень инсулина в крови, возрастает число рецепторов, повышается чувствительность к гормону и уменьшается непереносимость глюкозы. Последние работы по изучению молекулярных основ рака убедительно показывают, что нарушенное сопряжение рецептора фактора роста с эффекторным механизмом может быть причиной неконтролируемого роста злокачественных клеток. Приведенные примеры служат иллюстрацией целого ряда заболеваний, обусловленных патологией гормональных рецепторов.
Литература
Ginsberg В. Н. Synthesis and regulation of receptors for polypeptide hormones. Pages 59- 97. In: Biological Regulation and Development, Vol. 3B, Yamamoto K. (ed.). Plenum Press, 1985.
Granner D. K., Lee F. The multiple endocrine neoplasia syndromes, Chapter 76. In: Comprehensive Textbook of Oncology, Moosa A. R.. Robson M.C., SchimpffS. C. (ed.). Williams and Wilkins, 1984.
Mishina M. et al. Expression of functional acetylcholine receptor from cloned cDNAs. Nature, 1984, 307, 604.
Roth J.. Taylor S.I. Receptors for peptide hormones: Alternations in disease of humans, Annu. Rev. Physiol., 1982, 44, 639.
Roth J. et al. The evolutionary origins of hormones, neurotransmitters. and other extracellular messengers. N. Engl. J. Med., 1982, 306, 523.
Sibley D. R.. Lefkowitz R. J. Molecular mechanisms of receptor desensitization using the ß-adrenergic receptor-coupled adenylate cyclase system as a model. Nature, 1985, 317, 124.