Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Гормоны гипофиза и гипоталамуса
Гормоны передней доли гипофиза - Семейство пептидов проопиомеланокортина (ПОМК)
Это семейство состоит из пептидов, действующих либо как гормоны (адренокортикотропин, липотропин, меланоцит-стимулирующий гормон), либо как нейромедиаторы или нейромодуляторы. Про- опиомеланокортин (ПОМК) синтезируется в виде молекулы предшественника, состоящей примерно из 285 аминокислотных остатков, и подвергается различному процессингу в разных отделах гипофиза.
Распределение, процессинг и функции продуктов гена ПОМК
Ген ПОМК экспрессируется в передней и промежуточной долях гипофиза. Наиболее консервативные последовательности, сохраняющиеся у разных видов, локализуются в N-концевом фрагменте, кодирующем АКТГ и ß-эндорфин. ПОМК или родственные ему продукты присутствуют во многих других тканях позвоночных, включая мозг, плаценту, желудочно-кишечный тракт, половой тракт, легкие и лимфоциты. Это обусловливается главным образом экспрессией гена ПОМК в указанных тканях, а не поглощением продуктов гена из плазмы; однако такой механизм можно считать доказанным только для мозга, плаценты и семенников. Родственные пентиды найдены также у многих видов беспозвоночных.
Процессинг белка ПОМК в передней и промежуточной долях гипофиза протекает по-разному. У взрослых людей промежуточная доля рудиментарна, но она активна у плодов человека, женщин в поздние сроки беременности, а также у многих видов животных. Процессинг белка ПОМК в периферических тканях (кишечник, плацента, мужской половой тракт) сходен с таковым в промежуточной доле гипофиза. Существуют три основные группы пептидов семейства ПОМК: 1) АКТГ, из которого могут образовываться меланоцит-стимулирующий гормон (а-МСГ) и кортикотропиноподобный пептид промежуточной доли; 2) ß-липотропин (ß-ЛПГ), служащий предшественником а-липотропина, ß-МСГ и ß-эндорфина и. следовательно, а- и у-эндорфинов; 3) большой N-концевой пептид, из которого образуется у-МСГ. Разнообразие этих продуктов обусловлено наличием множественных кластеров двухосновных аминокислот, которые представляют собой потенциальные участки расщепления для трипсиноподобных ферментов. Каждому из упомянутых пептидов предшествуют остатки Lys-Arg, Arg-Lys, Arg-Arg или Lys-Lys. Сегмент прогормона отщепляется и подвергается посттрансляционной модификации путем гликозилирования, ацетилирования и фосфорилирования. Следующее расщепление продуктов ПОМК в передней и промежуточной доле гипофиза происходит на участке между АКТГ и ß-ЛПГ, что приводит к отделению N-концевого пептида, включающего АКТГ, от ß-ЛПГ (рис. 45.7). АКТГ1-39 затем отделяется от N-концевого пептида, дальнейших расщеплений в передней доле гипофиза практически не происходит. В промежуточной доле АКТГ1-39 расщепляется на а-МСГ (остатки 1—13) и кортикотропиноподобный пептид (18—39); ß-липотропин (42—134) превращается в у-липотропин (42—101) и ß-эндорфин (104—134); ß-МСГ (84—101) образуется из у-липотропина.
Перечисленные пептиды претерпевают множество дополнительных модификаций. Большая часть N- концевого пептида и АКТГ1-39 находится в передней доле гипофиза в гликозилированном состоянии, а-МСГ обнаруживается преимущественно в N-ацетилированной и амидированной с С-конца форме; деацетилированный а-МСГ намного менее активен. ß-Эндорфин в промежуточной доле быстро ацетилируется; ацетилированный ß-эндорфин в противоположность а-МСГ обладает в 1000 раз меньшей активностью, чем немодифицированная форма. Таким образом, ß-эндорфин может находиться в гипофизе в неактивном состоянии. В гипоталамусе молекулы этого пептида не ацетилированы и, по-видимому, присутствуют в активной форме. ß-Эндорфин подвергается также укорочению с С-конца с образованием λ- и у-эндорфинов (рис. 45.7). Таковы три главных эндорфина в промежуточной доле гипофиза грызунов. Большой N-концевой фрагмент, вероятно, тоже подвергается множественному расщеплению, но о его судьбе известно меньше, хотя в гипофизах крысы и крупного рогатого скота найден у-МСГ. Изложенные сведения о структуре пептидов получены главным образом при исследованиях гипофиза грызунов, но общая схема превращений, по-видимому, верна и для других видов.
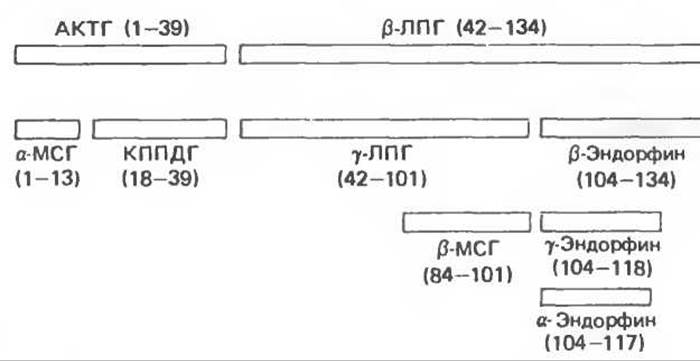
Рис. 45.7. Продукты расщепления проопиомеланокортина (ПОМК). МСГ— меланоцит-стимулирующий гормон: КППДГ кортикотропиноподобный пептид промежуточной доли гипофиза; ЛПГ— липотропин.
Функции большинства пептидов семейства ПОМК точно не установлены. Постулированные для них эффекты перечислены в табл. 45.4.
Регуляция синтеза ПОМК
ПОМК синтезируются приблизительно 5% клеток передней доли гипофиза и всеми клетками промежуточной доли. Регуляция синтеза и секреции ПОМК в этих отделах гипофиза сильно различаются.
А. Передняя доля. Кортикотропин-рилизинг-гормон (КРГ, кортиколиберин) является основным фактором, регулирующим высвобождение ПОМК из передней доли гипофиза. Он действует через сАМР-опосредованную систему, требующую присутствия Са2+. Стимулирующий эффект кортиколиберина на секрецию ПОМК непосредственно предотвращается глюкокортикоидными гормонами. Глюкокортикоиды могут также оказывать влияние на гипоталамус, ингибируя образование кортиколиберина, его секрецию или оба этих процесса. Адреналэктомия (которая уменьшает количество глюкокортикоидов и повышает уровень КРГ) сопровождается 20-кратным увеличением транскрипции гена ПОМК. Одновременное введение глюкокортикоидов может, однако, уменьшить этот прирост, причем тормозящее действие глюкокортикоидов, по-видимому, осуществляется через специфические рецепторы. Ингибирование секреции АКТГ глюкокортикоидами происходит быстрее, чем воздействие на транскрипцию гена ПОМК, поэтому можно предположить, что эти эффекты опосредуются независимыми механизмами. Минорные эффекты на секрецию ПОМК (АКТГ) передней долей включают прямую стимуляцию процесса вазопрессином и а-адренергическими агентами, непрямую стимуляцию (через центральную нервную систему) серотонином и ацетилхолином и торможение у-аминомасляной кислотой (ГАМК). Дофамин на секрецию ПОМК не влияет.
Б. Промежуточная доля. Эта доля гипофиза бедна кровеносными сосудами; гипоталамо-гипофизарная портальная система ее не достигает, и поэтому на нее не влияет кортиколиберин. В промежуточной доле нет рецепторов глюкокортикоидов, что исключает участие этих гормонов в регуляции продукции ПОМК. Промежуточная доля гипофиза обильно иннервирована дофаминергическими волокнами и, кроме того, содержит серотонинергические и катехоламинергические нервные окончания. Агонисты дофамина (эргокриптин) снижают, а антагонисты (галоперидол) повышают количество мРНК ПОМК и секрецию пептидов ПОМК. Время и степень этих изменений предполагают наличие сопряжения между образованием и секрецией пептидов. Указанные вещества не влияют на переднюю долю гипофиза. Высвобождение ПОМК в промежуточной доле стимулируется серотонином и ß-адренергическими агентами.
Таблица 45.4. Функции пептидов ПОМК
|
Пептид |
Функция |
|
АКТГ |
Стимуляция роста надпочечников и продукции стероидов |
|
а-МСГ |
Влияние на распределение меланина у амфибий влияние на обучение и половое поведение; влияние на рост и функцию клеток Сертоли семенников |
|
ß-ЛПГ |
Стимуляция липолиза и мобилизации жирных кислот |
|
ß-Эндорфин |
Обезболивание1); влияние на поведение (питание, эмоции, обучение); регуляция температуры тела и кровяного давления; стимуляция сокращений мышц полового тракта |
|
N-Концевой фрагмент |
Усиление действия АКТГ на стероидогенез |
1) Установленные функции.
В. Другие ткани. О регуляции продукции ПОМК в других тканях известно мало. На нее не влияют гипофизэктомия, адреналэктомия, кортиколиберин и глюкокортикоиды. Хронический стресс (иммобилизация) повышает содержание АКТГ в плазме и снижает его в гипофизе, но в мозге количество ПОМК при этом не меняется. В то же время острый стресс приводит к уменьшению количества ß- эндорфина в гипоталамусе. Высвобождение ß-эндорфина из гипоталамуса может стимулироваться эстрогенами.
Действие и регуляция специфических пептидов
А. Адренокортикотропный гормон (АКТГ):
1. Структура и механизм действия
АКТГ представляет собой одноцепочечный полипептид, состоящий из 39 аминокислот (рис. 45.8) и регулирующий рост и функцию коры надпочечников. Для полного проявления биологической активности гормона необходимы 24 N-концевые аминокислоты, которые тождественны у разных видов; 16 С-концевых аминокислот значительно варьируют.
Синтетический аналог АКТГ, широко применяется для диагностики.
АКТГ повышает синтез и секрецию стероидов надпочечников, усиливая превращение холестерола в прегненолон. Эта стадия включает образование С21-стероида из С27-стероида путем отщепления 6-углеродной боковой цепи. Поскольку прегненолон служит предшественником всех стероидов надпочечников (см. рис. 48.3), длительная стимуляция АКТГ приводит к избыточному образованию глюкокортикоидов, минералокортикоидов и дегидроэпиандростерона (предшественника андрогенов). Однако в физиологических условиях вклад АКТГ в образование стероидов двух последних классов минимален. АКТГ стимулирует рост коры надпочечников (трофический эффект), повышая синтез белка и РНК.
Подобно другим пептидным гормонам. АКТГ связывается с рецепторами плазматических мембран. В течение нескольких секунд гормонрецепторного взаимодействия происходит значительное увеличение уровня внутриклеточного сАМР. Аналоги сАМР имитируют действие АКТГ, причем этот эффект осуществляется с участием кальция.
АКТГ активирует аденилатциклазу в жировых клетках, в результате происходит сАМР-опосредованная активация липазы и усиление липолиза. Кроме того, АКТГ стимулирует секрецию инсулина поджелудочной железой, однако эти вненадпочечниковые эффекты невелики и требуют сверхфизиологических концентраций гормона.
2. Регуляция
Образование АКТГ из белка-предшественника ПОМК и регуляция синтеза и секреции последнего рассматривались выше. Основная регуляция осуществляется по петле отрицательной обратной связи, включающей глюкокортикоиды и кортиколиберин. Избыточные количества АКТГ и сами могут тормозить продукцию кортиколиберина по механизму «короткая петля». Важная роль в регуляции образования и секреции АКТГ принадлежит центральной нервной системе. В регуляции этого типа принимает участие ряд нейромедиаторов, в том числе норадреналин, серотонин и ацетилхолин. Скорее всего именно нейромедиаторы опосредуют стрессорную реакцию со стороны АКТГ, который стимулирует продукцию глюкокортикоидов, необходимых для адаптации к таким воздействиям, как гипогликемия, хирургическая операция, физическая или эмоциональная травма, эффекты холода и пирогенов.
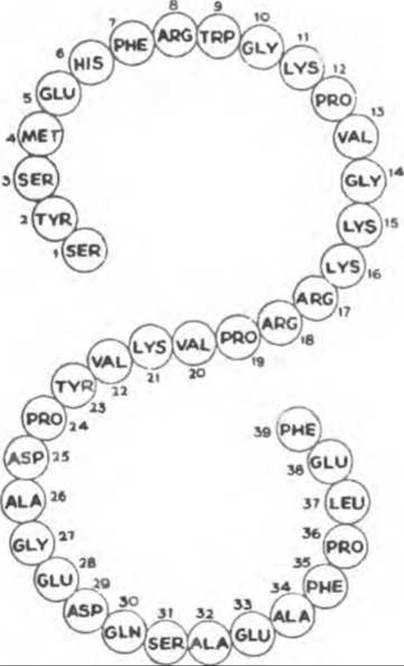
Рис. 45.8. Структура человеческого АКТГ.
3. Патофизиология
В результате избыточного образования АКТГ гипофизом или его эктопического образования опухолью развивается синдром Кушинга. Слабое МСГ-подобное действие АКТГ, а также секреция ß- или а- МСГ приводят к повышенной пигментации кожи. Возникающие метаболические нарушения обусловлены гиперпродукцией стероидов надпочечников, к ним относятся 1) отрицательный азотный, калиевый и фосфорный баланс; 2) задержка натрия, которая может привести к повышению артериального давления и отекам; 3) нарушение толерантности к глюкозе или сахарный диабет; 4) повышение содержания жирных кислот в плазме; 5) уменьшение количества эозинофилов и лимфоцитов в крови при увеличении количества полиморфноядерных лейкоцитов. У больных с синдромом Кушинга может наблюдаться атрофия мышц и специфическое перераспределение жира с его отложением на туловище. Отсутствие АКТГ, связанное с опухолью, инфекцией или инфарктом гипофиза, вызывает противоположные сдвиги.
Б. ß-Липотропин (ß-ЛПГ). Этот пептид состоит из 91 аминокислотного остатка С-конца ПОМК (рис. 45.7). ß-ЛПГ содержит последовательности ß-МСГ, у-липотропина, метэнкефалина и ß-эндорфина. В гипофизе человека найдены ß-липотропин, у-липотропин и ß-эндорфин; ß-МСГ не обнаружен, ß- Липотропин характерен только для гипофиза, потому что в других тканях он быстро превращается в у-липотропин и ß-эндорфин. ß-ЛПГ содержит 7членную аминокислотную последовательность (ß-ЛПГ47-53), идентичную фрагменту АКТГ4-10 (рис. 45.9). ß-Липотропин стимулирует липолиз и мобилизацию жирных кислот, но его физиологическая роль невелика. По-видимому, он имеет значение только как предшественник ß-эндорфина.
В. Эндорфины. ß-Эндорфин представляет собой С-концевой участок ß-липотропина (31 аминокислотный остаток с С-конца) (рис. 45.7). Для образования а- и у-эндорфинов требуется отщепление от С-конца ß-эндорфина соответственно 15 или 14 аминокислот. Эти пептиды обнаруживаются в гипофизе, где они находятся в ацетилированной форме и, по-видимому, неактивны. В других местах (например, в нейронах центральной нервной системы) они присутствуют в немодифицированном виде и поэтому, вероятно, могут служить нейромедиаторами или нейромодуляторами. Эндорфины связываются с теми же рецепторами центральной нервной системы, что и морфиновые опиаты, и могут играть роль в эндогенной регуляции чувствительности к боли. Они обладают более высокой активностью (при расчете на молекулу — в 18—30 раз), чем морфин. Последовательность энкефалина содержится в ПОМК, но ей не предшествуют двухосновные аминокислоты, и она, по-видимому, не отщепляется и не экспрессируется.

Рис. 45.9. Сравнение аминокислотных последовательностей фрагментов молекул АКТГ и ß-липотропина (ß-ЛПГ). Подчеркнутые остатки указывают на различия между молекулами. Молекула АКТГ состоит из 39 аминокислот, ß-липотропин включает 91 аминокислоту.
Г. Меланоцит-стимулирующий гормон (МСГ).
МСГ стимулирует у некоторых видов меланогенез, вызывая дисперсию внутриклеточных меланиновых гранул, что приводит к потемнению кожи. Три различные молекулы МСГ (а, ß и у) содержатся в составе молекулы ПОМК, а две из них (а и ß) секретируются у некоторых видов животных. У людей активностью МСГ обладают компоненты больших по размеру молекул у- или ß-липотропинов. а-МСГ содержит аминокислотную последовательность, идентичную участку АКТГ1-13, но N-концевой фрагмент молекулы находится в ацетилированной форме. а-МСГ, а также кортикотропиноподобный пептид промежуточной доли гипофиза обычно обнаруживаются у животных с хорошо развитой промежуточной долей. У людей в постнатальном периоде эти пептиды не найдены.
Лица с низким уровнем глюкокортикоидов (болезнь Аддисона) характеризуются усиленной пигментацией кожи, связанной с повышенной активностью МСГ в плазме. Это может быть обусловлено секрецией АКТГ, но скорее является результатом совместной секреции ß- и у-липотропинов, которым, как известно, присуща активность МСГ.