Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Метионин и цистеин
Образование и превращения цистатионина
Опыты по биохимии питания выявили заменимость цистеина (цистина) в диете. А именно было показано, что у крыс потребность в цистеине может удовлетворить метионин и что потребность в метионине частично может быть покрыта цистином пищи (стр. 122). Эти результаты дали основание предполагать, что у крысы сера метионина переходит в серу цистина. Повышенное выделение цистина у больных цистинурией после введения метионина [452] и повышенное образование меркаптуровых кислот после совместного введения метионина и галоидопроизводных бензола [453, 454] также указывали на возможность такого превращения. Тарвер и Шмидт [455], используя метионин, меченный S35, получили прямое доказательство превращения серы метионина в серу цистина в организме крысы, а Стеттен [222] показала, что после введения крысам серина, меченного N15, в тканях образуется цистин, содержащий высокую концентрацию изотопа. Бранд и сотрудники [457] наблюдали, что при введении гомоцистеина больным цистинурией они выделяют повышенные количества цистина; авторы предположили [458], что переход серы гомоцистеина в молекулу цистеина происходит через промежуточное соединение, S-(ß-aмино-ß-карбоксиэтил)-гомоцистеин, позднее названный цистатионином. Дю-Виньо и сотрудники [459—464] подтвердили этот путь превращения; ими показано, что акцептором серы служит молекула серина. Все четыре диастереоизомера цистатионина были синтезированы и исследованы в опытах по кормлению крыс [459, 465]. D-Изомеры оказались неактивными, L-цистатионин в опытах по поддержанию роста заменял цистеин пищи, тогда как L-алло-цистатионин стимулировал рост в отсутствие метионина при наличии холина в рационе. Авторы пришли к заключению, что L-цистатионин расщепляется в организме крысы на цистеин и гомосерин, тогда как при расщеплении L-алло-цистатионина образуется гомоцистеин и серин:

L-Цистатионин, меченный по сере, превращался в меченый цистин [464], а в опытах in vitro с препаратами печени крысы было найдено, что из него образуются цистеин и а-кетомасляная кислота [460, 462, 466]. Возможно, что а-кетомасляная кислота возникала из гомосерина, так как гомосерин, добавленный к ферментному препарату, вызывал образование этой кетокислота. По-видимому, в организме может происходить аминирование а-кетомасляной кислоты в а-аминомасляную [467]. Последняя появляется в повышенных количествах в моче людей после приема метионина [468, 469]. При изучении фермента, осуществляющего конденсацию гомоцистеина и серина, оказалось, что он отличается от ферментной системы, расщепляющей цистатионин. Реакции образования и расщепления цистатионина можно представить следующим образом:

Препараты печени В6-авитаминозных крыс не катализируют образование цистеина из гомоцистеина и серина, если к гомогенатам не добавлен пиридоксальфосфат [470]; это свидетельствует об участии витамина B6 в переносе серы через цистатионин. Оказалось, что пиридоксальфосфат необходим как для системы, синтезирующей цистатионин, так и для системы, расщепляющей его [471]1. Для реакций ß-замещения (или конденсации) промежуточных шиффовых оснований Снелл и сотрудники сформулировали механизм, который объясняет роль витамина В6 в этих превращениях (стр. 255).
1 Участие пиридоксальфосфата в синтезе цистатионина и в его расщеплении на NH3, а-кетомасляную кислоту и цистеин установлено одновременно Горяченковой (ДАН, 85, 603, 1952) и Бинкли [471], а его роль как кофермента гомосериндезаминазы — Браунштейном и Азарх (ДАН, 85, 385, 1952). Гринберг и сотрудники выделили из печени крысы в кристаллическом виде полифункциональный пиридоксалевый фермент, который катализирует описанные выше реакции — расщепление цистатионина с образованием NH3, H2S и пирувата и дезаминирование гомосерина (Y. Matsuo, D. М. Greenberg, J. Biol. Chem., 230, 545, 561, 1958; 234, 507, 516.1959); другой пиридоксалевый фермент, выделенный в очищенном виде из печени крысы, по-видимому, совмещает функцию синтеза цистатионина из серина и гомоцистеина с активностью сериндегидратазы или сериндезаминазы. — Прим. ред.
Установлено, что препараты печени крысы осуществляют дезаминирование гомосерина с образованием а-кетомасляной кислоты [472]; оказалось, что реакция катализируется специфической дезаминазой, не действующей на серин или треонин (см. примечание на стр. 366).
Бинкли [473] удалось отделить фермент, расщепляющий цистатионин, от фермента, синтезирующего его, путем избирательного инактивирования второго при нагревании до 50°. Кроме L-цистатионина, фермент расщепляет дженколовую кислоту, L-алло-цистатионин и лантионин [474].
Дальнейшее доказательство роли цистатионина в процессе пересульфирования получено в опыте с больным цистинурией, которому вводили S35-метионин. Изотоп был обнаружен в цистине мочи [475]. Многие другие соединения также служат источниками серы цистеина. Найдено, что L-лантионин поддерживает рост крыс, получавших диету, недостаточную по цистину [476]. Сера гомолантионина [477, 478] и этионина [479] также может превращаться в серу цистина.
У крыс указанный путь образования цистеина, по-видимому, необратим. Однако у некоторых микроорганизмов синтез метионина из цистеина протекает путем цепи реакций, представляющей обращение рассмотренного выше процесса. Некоторые организмы, например Neurospora, катализируют эти реакции в обоих направлениях. Синтез метионина у N. crassa изучали с использованием нескольких мутантов, у которых были блокированы различные звенья биосинтетического процесса [235, 236, 480]. Так, были выделены мутанты, способные расти на средах, содержащих: а) метионин, б) метионин или гомоцистеин, в) метионин, гомоцистеин или цистатионин, а также мутанты, блокированные на стадии синтеза гомосерина или на стадии конденсации цистеина с гомосерином. Аналогичные мутанты Escherichia coli также подверглись изучению; в опытах с ферментами и с изотопами были получены данные, показавшие, что пути превращения цистеина в метионин у этого микроорганизма и у Neurospora аналогичны [483—486]. Цистатионин выделен из фильтратов культур некоторых мутантов Neurospora [480] и из мочи В6-авитаминозных крыс [1104]. S35-Цистатионин был обнаружен также в тканях млекопитающих в опытах с применением S35-метионина [487, 488].
Таким образом, углеродная цепь цистеина как у млекопитающих, так и у микроорганизмов происходит из серина. Реакции обмена серина рассмотрены выше (стр. 319—323).
Механизм введения серы в углеродную цепь серина не ясен1. Исследования на мутантах некоторых микроорганизмов дают указания на следующий путь [489, 1105, 1106]:
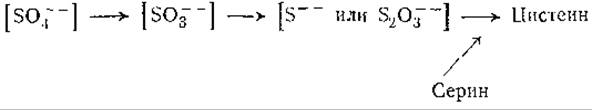
Возможно, что сероводород утилизируется в результате обращения реакций, катализируемых десульфгидразами цистеина и гомоцистеина (стр. 376); сульфит может использоваться путем обращения реакции расщепления β-сульфинилпировиноградной кислоты (стр. 380).
1 Из дрожжей получен фермент (серинсульфгидраза), который при участии пиридоксальфосфата синтезирует L-цистеин путем замещения НО-группы серина HS-группой сероводорода (К. Schlossmann, F. Lynen, Biochem. Z., 328, 591, 1957); другой, аналогичный фермент дрожжей образует S-метилцистеин из серина и метилмеркаптана (Е. С. Wolff, S. Black, Р. F. Downey, J. Am. Chem. Soc., 78, 5958, 1956). — Прим. peд.