Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Метионин и цистеин
Распад цистеина
Биологический распад цистеина может происходить различными путями. Tapp [549] и Фромажо и сотрудники [550—553] наблюдали цистеиндесульфгидразную реакцию в препаратах печени, почек и поджелудочной железы млекопитающих, а также у ряда микроорганизмов. Как установлено в опытах с применением S35, эта реакция обратима [1110]; ее можно выразить следующим уравнением:
Цистеин + Н2O → Пируват + H2S + NH3.
Одновременное наличие других конкурентных превращений цистеина и пировиноградной кислоты создает осложнения при изучении этой реакции. В некоторых опытах наблюдали образование аланина, вероятно, за счет переаминирования между пировиноградной кислотой и цистеином или другими свободными аминокислотами (например, глутаминовой кислотой), присутствующими в ферментной системе [554]. Найдено, что пиридоксальфосфат активирует препараты фермента, полученные из тканей В6-авитаминозных животных [546, 555—560]. Предложен механизм десульфгидразной реакции, в основе которого лежит образование шиффова основания из пиридоксальфосфата и цистеина; этот механизм исследовали в неферментативных модельных системах (стр. 255). Хотя этот механизм правдоподобен, необходимо учитывать, что реакцию до сих пор изучали только с применением неочищенных ферментных препаратов, обладающих также трансаминазной активностью; роль пиридоксальфосфата в реакциях переаминирования общеизвестна (стр. 248). При переаминировании между цистеином и а-кетокислотой должна образовываться ß-меркаптопировиноградная кислота. Различные препараты из ткани животных и из бактерий десульфируют ß-меркаптопировиноградную кислоту в пировиноградную кислоту [561—563]:
![]()
В присутствии восстанавливающих веществ, например ß-меркаптоэтанола, цистеина или глутатиона, образующаяся в этой реакции сера восстанавливается в сероводород [561]:
![]()
Таким образом, образование сероводорода из цистеина может происходить в результате реакций дезаминирования или переаминирования с последующим превращением ß-меркаптопировиноградной кислоты в пировиноградную кислоту и серу или сероводород. При наличии избытка цистеина сера перейдет в сероводород; при исследовании цистеиндесульфгидразной реакции наблюдали одновременное превращение цистеина в цистин. Интересно отметить, что цистеиндесульфгидразная реакция не идет до конца; в большинстве опытов реакция прекращалась после образования пировиноградной кислоты и сероводорода в количестве, не достигающем половины теоретического. В некоторых бактериальных системах десульфирование протекает в две ступени: в первой происходит, по-видимому, дезаминирование цистеина, а во второй — освобождение сероводорода [555, 559, 564—566]. Образование сероводорода повышается в присутствии кетокислот, например кетоглутаровой кислоты [553, 1111]. Эти наблюдения согласуются с механизмом следующего рода:
Данные ряда экспериментальных исследований хорошо согласуются с приведенной выше схемой, и, поскольку в этих исследованиях применялись неочищенные ферментные препараты, такой механизм распада цистеина вполне вероятен. Вместе с тем возможно, что в некоторых системах отщеплению серы предшествует образование аммиака в результате окислительного дезаминирования цистеина. Не исключен также первоначально предложенный механизм десульфгидразной реакции, с тем изменением, что в настоящее время учитывается промежуточное образование шиффова основания с пиридоксальфосфатом. Возможно, что в различных условиях встречаются все эти механизмы распада цистеина1.
В ранних исследованиях наблюдали образование сероводорода как из D-, так и из L-цистеина в присутствии Propionibacterium pentosaceum [567]. Скорости образования сероводорода из обоих изомеров были примерно одинаковы. Недавно найдено, что экстракты из некоторых штаммов Escherichia coli катализируют десульфирование D-цистеина гораздо активнее, чем расщепление L-изомера [568]; в том и другом случае возникали примерно эквимолярные количества пировиноградной кислоты, аммиака и сероводорода.
1 См. примечание к стр. 368.
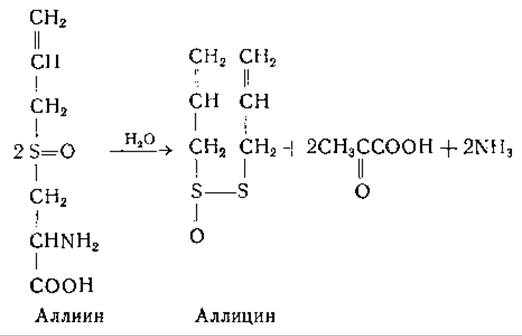
Реакция, катализируемая аллииназой, аналогична реакции десульфирования цистеина [569, 570]. Аллиин, содержащийся в луковицах чеснока, превращается под действием фермента в аллицин (придающий чесноку характерный для него запах), пировиноградную кислоту и аммиак. В этой реакции участвует пиридоксальфосфат [1112].
Цистеин легко окисляется в цистин неферментативным путем, однако известно, что эта реакция, равно как восстановление цистина в цистеин, может катализироваться ферментами. Как отмечено выше, превращение цистеина в цистин может происходить в результате реакции с серой. Много лет назад Кейлин [571] наблюдал окисление цистеина в цистин цитохромом с и цитохромоксидазой. Недавно описана реакция восстановления цистина в препаратах из дрожжей и высших растений при участии дифосфопиридиннуклеотида [572, 573].
Цистин + ДПН-Н + Н+ → 2 мол. цистеина + ДПН+.
Действие фермента специфически направлено на цистеин и дифосфопиридиннуклеотид. Известна аналогичная реакция с участием глутатиона (GSH) и трифосфопиридиннуклеотида (ТИН) [574-578]:
GSSG + ТПН-Н + Н+→ 2GSH + ТПН+.
Одним из важных путей обмена цистеина является окисление его в цистеинсульфиновую кислоту. Около 20 лет назад Пири предположил, что цистеин при окислении превращается в цистеинсульфиновую кислоту, от которой далее отщепляется сульфит, окисляющийся в сульфат [541, 579, 580]. Возможно, что при окислении цистеина промежуточным звеном является образование цистеинсульфеновой кислоты [582], но последняя не была выделена:
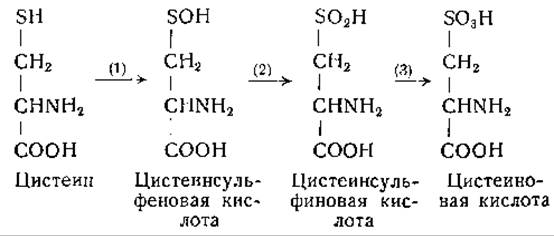
Дальнейшее окисление цистеинсульфиновой кислоты в цистеиновую кислоту экспериментально установлено (реакция 3). Цистеинсульфеновая кислота, вероятно, нестабильна; предполагают, что это соединение спонтанно подвергается дисмутации на цистеинсульфиновую кислоту и цистеин:

Цистеинсульфиновая кислота принадлежит к числу главных промежуточных продуктов обмена цистеина. В организме крысы цистеинсульфиновая кислота не переходит в сколько-нибудь значительных количествах в цистеин, поскольку она не способна заменять цистеин как пищевой фактор роста [583].
Описано образование сульфита и аланина из цистеинсульфиновой кислоты в препаратах печени кролика [553, 592, 593]. В последующих исследованиях было установлено, что это превращение происходит в результате реакции переаминирования между цистеинсульфиновой кислотой и а-кетоглутаровой или щавелевоуксусной кислотой с образованием ß-сульфинилпировиноградной кислоты. Сульфинилпировиноградная кислота не была выделена. По-видимому, она в присутствии ионов некоторых металлов (например, Мn++) спонтанно распадается на сульфит и пируват; эта реакция аналогична неферментативному декарбоксилированию щавелевоуксусной кислоты. Образующийся сульфит окисляется в сульфат. Эти реакции можно представить следующим образом [553, 584—591, 1113]:
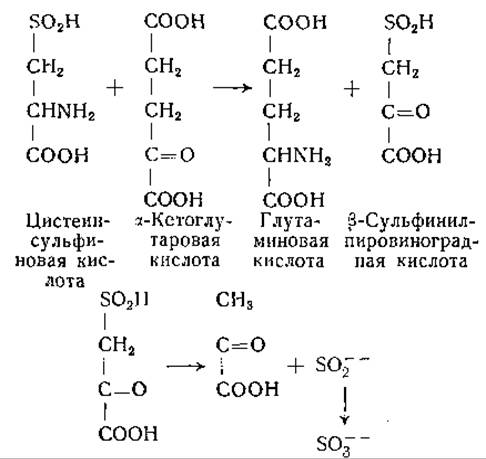
Аналогичную реакцию переаминирования наблюдали между цистеинсульфиновой кислотой и щавелевоуксусной кислотой. Образование аланина, отмеченное в более ранних исследованиях, можно отнести за счет реакции переаминирования между пировиноградной и глутаминовой кислотами.
В препаратах печени крысы цистеинсульфиновая кислота вступает также в реакцию переаминирования с пировиноградной кислотой; это превращение в отличие от аналогичной реакции с а-кетоглутаровой кислотой оказалось нарушенным в тканях В6-авитаминозных крыс.
Цистеинсульфиновая кислота может окисляться в цистеиновую кислоту; это превращение катализируется дегидрогеназной системой, действующей обратимо [584]:
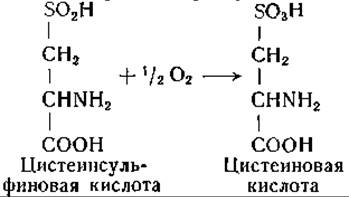
ß-Сульфинилпировиноградная кислота, вероятно, не окисляется в ß-сульфонилпировиноградную кислоту, так как последняя не превращается в пировиноградную кислоту и сульфат ферментными препаратами, образующими сульфат и пировиноградную кислоту из цистеинсульфиновой кислоты. Имеются данные о наличии обратимого переаминирования между ß-сульфонилпировиноградной и глутаминовой кислотами с образованием цистеиновой и а-кетоглутаровой кислот.
Кроме того, описано окисление цистеинсульфиновой кислоты в ß-сульфинилпировиноградную кислоту присутствующим в печени крысы ферментом, действующим при участии дифосфопиридиннуклеотида [584]. По-видимому, существуют по крайней мере два пути превращения цистеинсульфиновой кислоты в ß-сульфинилпировиноградную кислоту, а именно окисление и переаминирование. При парентеральном введении цистеина крысам повышается содержание аланина в печени [594], как и при введении цистеинсульфиновой кислоты [595]. Цистеинсульфиновая кислота найдена в ткани мозга нормальной крысы [596]. Следовательно, имеются убедительные данные, подтверждающие роль этого соединения как нормального метаболита. О большой биологической реактивности цистеинсульфиновой кислоты свидетельствует ее участие в реакциях переаминирования, окисление в цистеиновую и в ß-сульфинилпировиноградную кислоты и ее декарбоксилирование, описанное ниже. В опытах с применением меченого сульфита было установлено образование цистеинсульфиновой кислоты, по всей вероятности — за счет обращения одной или нескольких из указанных реакций; этот процесс в известной мере сходен с процессом фиксации двуокиси углерода [597]. В исследованиях на курином эмбрионе наблюдали включение радиоактивного сульфата в состав молекулы таурина [598, 599]. Превращение цистеинсульфиновой кислоты в таурин установлено у собаки [600]; в препаратах печени собаки обнаружена декарбоксилаза цистеиновой кислоты [601]. Кроме того, имеется ряд данных о наличии и образовании в биологических системах гипотаурина (2-аминоэтансульфиновой кислоты). Так, например, у крыс после внутривенного введения цистеина повышалось содержание аланина, гипотаурина и таурина в печени [594, 602]. В препаратах печени имеет место ферментативное декарбоксилирование цистеинсульфиновой кислоты с образованием гипотаурина [603]. Гипотаурин обнаружен в моче нормальных крыс, а также крыс, получающих рационы с высоким содержанием цистеина [604, 605]. Гипотаурин получен путем химического синтеза [602, 606—608]. Таурин образуется в организме путем декарбоксилирования цистеиновой кислоты или путем окисления гипотаурина. Для первой из этих реакций, как и для декарбоксилирования цистеинсульфиновой кислоты, необходим в качестве кофермента пиридоксальфосфат [1114]. Найдено, что крысы при недостаточности витамина В6 выделяют мало таурина и гипотаурина или совсем не выделяют их [604, 609]. Гипотаурин, вероятно, легко подвергается биологическому окислению в таурин, но эта реакция пока в деталях не изучена. Совокупность экспериментальных данных указывает на то, что главный путь образования таурина ведет через дистеинсульфиновую кислоту. Однако некоторое количество таурина, вероятно, образуется за счет декарбоксилирования цистеиновой кислоты. Эти реакции могут быть представлены следующим образом:
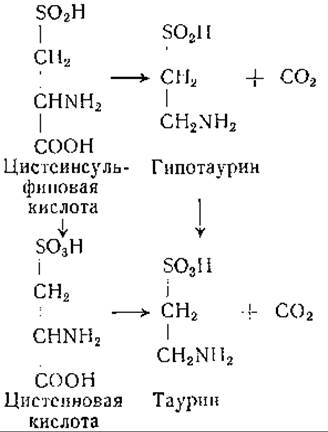
Еще один гипотетический путь образования таурина, который был указан уже в ранних работах [579, 580], состоит в превращении цистеина в цистин с последующим образованием цистиндисульфоксида и декарбоксилированием его в таурин:
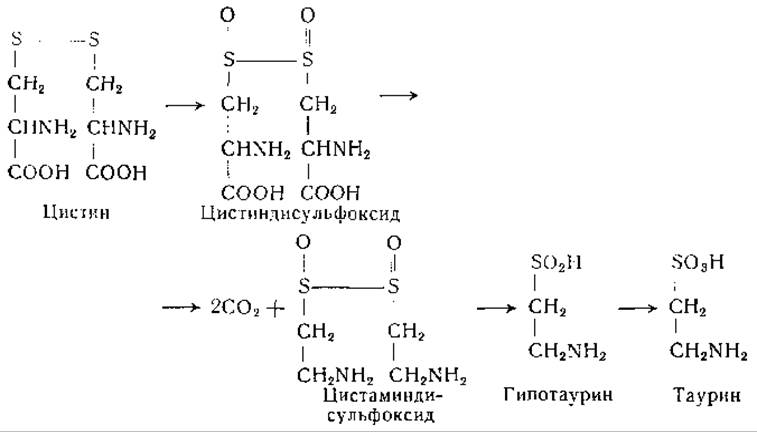
Описаны наблюдения, согласующиеся с этой цепью реакций. В частности, отмечено, что цистиндисульфоксид доступен окислительному декарбоксилированию в препаратах печени и легко превращается в сульфат в организме животных [541, 610]. Найдено также, что цистамин, образующийся, возможно, в результате распада кофермента А, превращается в организме различных животных в таурин; в этой реакции промежуточным соединением, по-видимому, является гипотаурин [611, 612]:
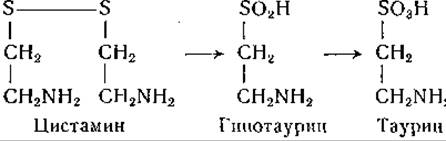
В моче и печени крыс после инъекции им цистеина найден цистаминдисульфоксид [612]. Из печени голубя выделен в очищенном виде фермент, окисляющий цистеамин (2-меркаптоэтил- амин) в присутствии хлорида 2,3,5-трифенилтетразолия; для действия этого фермента необходимо присутствие дифосфопиридиннуклеотида [1115].
Таурин, подобно глицину, содержится в желчи в виде парного соединения с холевой кислотой. Синтез таурохолевой кислоты осуществлен при помощи препаратов микросом из печени морской свинки, катализирующих следующие реакции [1116]:
Холевая кислота + Кофермент A + АТФ → Холилкофермент А
Холилкофермент А + Таурин → Таурохолевая кислота + Кофермент А.
После инъекции S-аминоэтилцистеина крысы выделяют S-аминоэтилцистеин, соответствующее ему a-N-ацетилпроизводное и цистамин в связанной форме [613]. Образование цистамина из S-аминоэтилцистеина совместимо с гипотезой, согласно которой последний является промежуточным соединением в предполагаемой реакции переноса серы от цистеина к этаноламину:
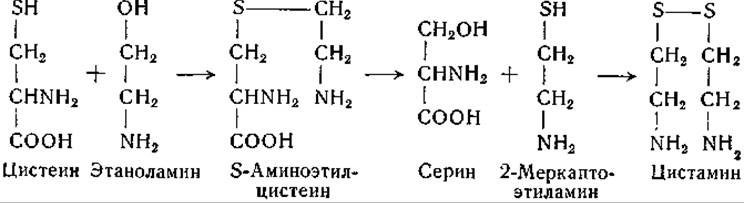
При окислении цистеина в присутствии формальдегида образуется N-формилцистеин. Этот же продукт получен при окислении тиазолидинкарбоновой кислоты, образующейся при конденсации цистеина с формальдегидом [614]. При конденсации гомоцистеина с формальдегидом аналогичным путем образуется n-тиазан-4-карбоновая кислота [615]. Конденсации этого рода происходят неферментативным путем [616, 617], а продукты конденсации доступны действию ферментов [614, 615].
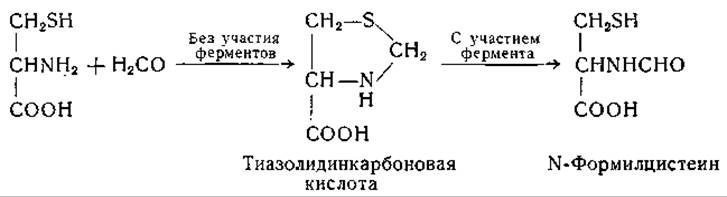
При взаимодействии цистеина с цианидом образуется соединение, вероятно имеющее строение 2-имино-4-тиазолидинкарбоновой кислоты [618]. Крысы выделяют это соединение с мочой после подкожного введения NaCN. Этой реакцией, возможно, обусловлено хорошо известное защитное действие цистеина при отравлении цианидом [619].

К числу конечных продуктов обмена серы у животных принадлежат сульфат и тиосульфат. Тиосульфат участвует в реакции
Тиосульфат + Цианид → Тиоцианат + Сульфат,
изучению которой было посвящено много работ. Образование тиоцианата (роданида) при этой реакции, играющей роль в детоксикации цианида, катализирует фермент роданеза, впервые обнаруженный Лангом [620]. Фермент содержится в печени и других тканях млекопитающих [620—623]. Сёрбо [623, 624] детально исследовал роданезу и выделил этот фермент в кристаллическом виде. Он пришел к выводу, что роданеза имеет дисульфидную группу, реагирующую с тиосульфатом следующим образом:
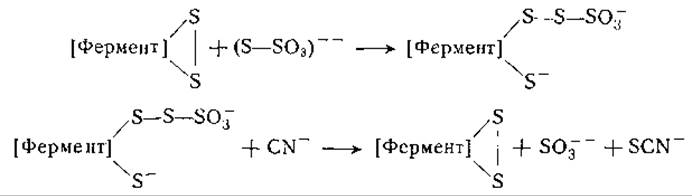
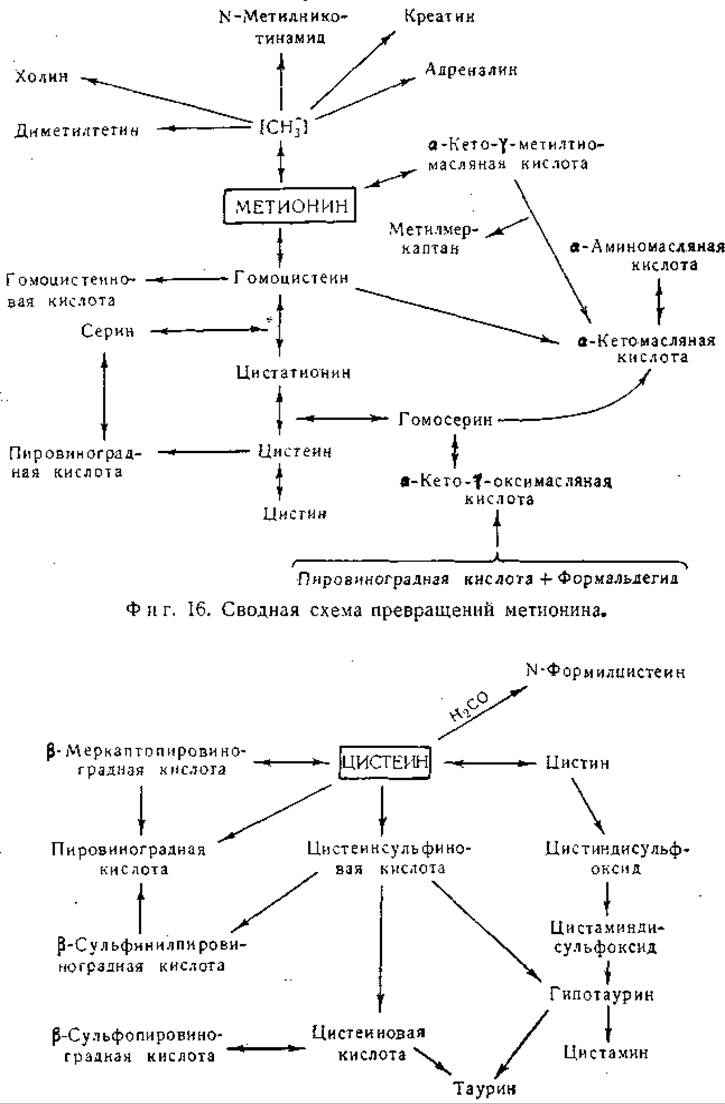
Фиг. 17. Сводная схема превращений цистеина.
По мнению Сёрбо, образование тиоцианата из цианида и элементарной серы в препаратах печени происходит под действием фермента, не идентичного роданезе. К аналогичному заключению он приходит в отношении образования роданида из ß-меркаптопировиноградной кислоты, от которой ферментативным путем отщепляется сера [561, 625]. Кристаллическая роданеза не использует элементарную серу.
Окисление сульфида в тиосульфат в препаратах печени крысы катализируется термолабильными и термостабильными фракциями, полученными из этой ткани. Ферментные системы активируются соединениями, образующими клешневидные комплексы, и, по-видимому, требуют наличия ионов кобальта. Интересно отметить, что у голодающих животных активность сульфид-оксидазы значительно повышена по сравнению с контрольными неголодающими животными [1117].
Недавно показано, что для образования фенолосерных кислот (и, по-видимому, при биосинтезе других сложных эфиров серной кислоты) необходимо предварительное активирование сульфата в результате реакции, в которой участвует аденозин-трифосфат [1118]. Активный сульфат идентифицирован как 3'-фосфоаденозин-5'-фосфосульфат (ФАФС); при его взаимодействии с нитрофенолом образуется нитрофенилсульфат и 3', 5'-дифосфоаденозин (ФАФ) [1119]:
![]()