Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Лизин
Распад лизина
Как известно, лизин незаменим в питании млекопитающих (табл. 10). В диете растущих крыс лизин не может быть заменен на а-аминоадипиновой кислотой [1038], ни а-амино-ε-гуанидинокапроновой кислотой [1039]. В отличие от других аминокислот L-лизин не может быть заменен в пищевых рационах D-изомером [1040, 1041] или производными L-изомера, у которых а-аминогруппа содержит заместитель или заменена оксигруппой. Между тем s-N-ацетил- и ε-N-метиллизин могут заменять лизин в пищевом рационе роста крыс [1042, 1043]. При кормлении крыс лизином, содержащим N15 и дейтерий, отношение D : N15 в лизине, включающемся в белки органов, остается неизменным [1044]. При введении крысам N15-аммония или N15-аминокислот изотопный азот не переходит в а-аминогруппу лизина [270, 1045]. В организме крысы наблюдается лишь очень слабая лабилизация а-водородного атома лизина. Все эти данные указывают на то, что лизин не принимает сколько-нибудь активного участия в обратимых процессах переаминирования или дезаминирования; однако они не исключают возможности необратимого дезаминирования или переаминирования этой аминокислоты.
Борсук и его сотрудники [1046—1048] наблюдали превращение лизина в глутаровую кислоту. Они нашли, что в гомогенатах печени морской свинки ε-С14-лизин превращается в а-аминоадипиновую кислоту; последняя переходит в а-кетоадипиновую кислоту, которая в свою очередь декарбоксилируется с образованием глутаровой кислоты:
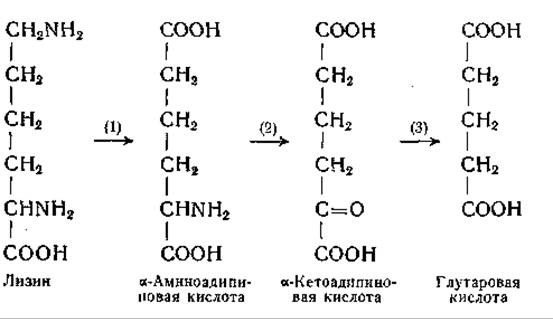
Возможно, что реакция (2) осуществляется путем переаминирования.
Образование глутаровой кислоты из лизина можно считать установленным; Рингер с сотрудниками [1050] еще в 1913 г. высказали предположение о существовании подобного превращения, исходя из того, что ни лизин, ни глутаровая кислота не превращаются в теле животных в глюкозу или в ацетоуксусную кислоту. Ротстайн и Миллер, пользуясь методом «изотопной ловушки», показали в опытах на крысах превращение лизина в глутаровую кислоту и глутаровой кислоты в L-a-оксиглутаровую кислоту; последняя далее окисляется в а-кетоглутаровую кислоту; кроме того, ε-углеродный атом лизина может частично переходить в формиат. Эти данные указывают на возможность превращения лизина в глутаминовую кислоту, что согласуется с данными других авторов, полученными в исследованиях с ε-С14-лизином [1049, 1051, 1055]. Наличие пипеколиновой кислоты в тканях ряда растений [1025, 1056—1059] и обнаружение превращения лизина в пипеколиновую кислоту у высших растений [1071, 1072], у Neurospora [1023] и в организме крысы [1051] послужили указанием на то, что пипеколиновая кислота является промежуточным продуктом обмена лизина. По данным Ротстайна и Миллера, в организме крысы в процессе превращения лизина в пипеколиновую кислоту отщепляется а-аминогруппа, а не ε-аминогруппа лизина. Было найдено, что пипеколиновая кислота принадлежит к главным продуктам обмена лизина у крыс; она, по-видимому, представляет промежуточное звено при превращении лизина в а-аминоадипиновую кислоту. Эти исследования показали, что при распаде лизина в организме крысы переход азота ε-аминогруппы лизина в а-аминогруппу а-аминоадипиновой кислоты осуществляется в результате внутримолекулярной реакции переаминирования (см. схему на стр. 432) [1052, 1055]. Следует помнить, что, хотя приведенная ниже схема согласуется с известными фактами, касающимися процесса диссимиляции лизина, отдельные этапы этого процесса требуют экспериментального уточнения. Превращение лизина в а-кето-ε-аминокапроновую кислоту (или в ее циклическую форму, ∆1-пиперидино-карбоновую кислоту) еще не было осуществлено в опытах с ферментными препаратами из тканей млекопитающих. L-Аминокислотная оксидаза змеиного яда катализирует эту реакцию с очень малой скоростью. Когда ε-аминогруппа лизина блокирована, например посредством введения карбобензоксигруппы, окисление а-аминогруппы происходит значительно быстрее. В результате этой реакции образуется ε-N-карбобензоксипроизводное кетокислота. После удаления защищающей группы получают кетокислоту (а-кето-ε-аминокапроновую кислоту), которая в растворе находится в равновесии с циклической формой [1060] (стр. 237). Образование этого соединения у Neurospora обнаружено Швитом и сотрудниками [1021—1023], которые наблюдали превращение лизина в ∆1-пиперидин-2-карбоновую кислоту. Следует учитывать возможное участие в обмене лизина его производных по ∆1-аминогруппе, особенно в связи с данными о том, что ε-N-ацетил- и ε-N-метилпроизводные лизина могут заменять лизин в питании растущих крыс. Притом известно, что реакции ферментативного дезаминирования D- и L-лизина и переаминирования а-аминогруппы L-лизина протекают значительно быстрее, если а-аминогруппа блокирована [1060, 1061]. Аналогичные наблюдения имеются в отношении производных орнитина. Заслуживает внимания, что в одном из путей обмена орнитина участвует a-N-ацетилорнитин (стр. 344).

В опытах с одной из фракций гомогената печени крысы обнаружено превращение ∆1-пиперидин-2-карбоновой кислоты в L-пипеколиновую кислоту; для этой реакции необходим восстановленный ди- или трифосфопиридиннуклеотид [1142]:
![]()
У крыс ε-С14-D-лизин не превращается в D-пипеколиновую кислоту; весь введенный в виде лизина изотопный углерод был обнаружен в моче и небелковых азотистых фракциях тканей [1062].

Фиг. 22. Сводная схема превращений лизина.
Нейбергер и Сангер [1061] впервые высказали предположение о том, что одним из продуктов обмена лизина является δ-аминовалерьяновая кислота. Установлено, что эта аминокислота образуется при декарбоксилировании а-кетоаналога лизина [1060]. По данным Ротстайна и Миллера [1063], δ-С14-5-аминовалерьяновая кислота превращается у крыс в глутаминовую кислоту. δ-Аминовалерьяновая кислота может подвергаться переаминированию [1064, 1065] (стр. 227); в результате этой реакции следует ожидать образования полуальдегида глутаровой кислоты, который может далее окисляться в глутаровую кислоту.
У дрожжей обнаружен лизин в связанной форме, а именно в виде ε-N-биотинил-L-лизина (биоцитин) [1066]. Существование соединения, содержащего лизин, связанный через ε-аминогруппу, весьма интересно; имеются и другие данные, подтверждающие существование соединений, содержащих связи через ε-аминогруппу лизина (стр. 0229). Райт и сотрудники [1067] обнаружили в крови человека фермент, гидролизующий биоцитин. Биоцитин выделяется с мочой в виде биоцитин-сульфоксида [1068].
Данные об обмене 5-оксилизина немногочисленны (стр. 50). Эта аминокислота обнаружена только в коллагене [1069]. При исследовании гидролизатов желатины и коллагена кожи, выделенных из тела молодых крыс, которым скармливали в течение трех недель С14-лизин, содержание радиоактивного углерода оказалось одинаковым в лизине и в оксилизине. Эти данные позволяют считать лизин предшественником оксилизина [1070].