Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
а-Кетоаналоги аминокислот
а-Кетоаналоги аминокислот представляют значительный интерес с биохимической точки зрения как промежуточные вещества в процессах биосинтеза и распада аминокислот. Некоторые из них являются в то же время промежуточными продуктами цикла лимонной кислоты и играют важную роль связующих звеньев в обмене жиров, углеводов и трех аминокислот (глутаминовой кислоты, аспарагиновой кислоты и аланина).
а-Кетокислоты образуются из соответствующих им а-аминокислот в результате процессов ферментативного окислительного дезаминирования (стр. 182) и переаминирования (стр. 210). О методах приготовления а-кетокислот см. обзор Майстера [546]. Многие а-кетокислоты получены путем химического синтеза, однако некоторые из них стали доступными лишь благодаря применению ферментативных методов — в частности, окислительного дезаминирования [547]. В табл. 9 приведены многие а-кетокислоты, представляющие интерес с биохимической точки зрения.
а-Кетоаналоги аминокислот, обладающих более чем одним асимметрическим атомом углерода, могут существовать в оптически активных формах. Так, S-оксилизину, треонину и изолейцину должны соответствовать по две оптически активных а-кетокислоты. До сих пор это подтверждено путем препаративного выделения отдельных изомеров только для а-кетокислотного аналога изолейцина.
Две а-кето-β-метилвалерьяновые кислоты были приготовлены из соответствующих изомеров изолейцина путем ферментативного дезаминирования и выделены в виде натриевых солей [558]. В том случае, когда вторым центром оптической асимметрии является ß-углеродный атом, енолизация а-кетокислоты приводит к рацемизации. У изомеров а-кето-β-метилвалерьяновой кислоты это превращение легко осуществляется в щелочном растворе:
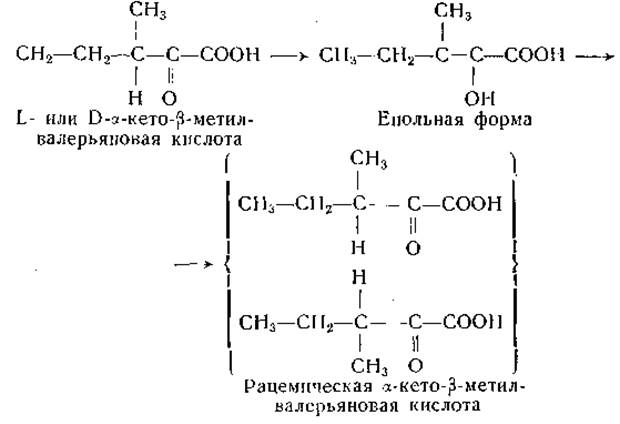
О том, что такая рацемизация (или енолизация) не происходит быстро при любых условиях, свидетельствуют наблюдения, показавшие, что L-изомер а-кето-β-метилвалерьяновой кислоты (соответствующий L-изолейцину и алло-D-изолейцину) более эффективно обеспечивает рост молодых крыс [559] и некоторых бактерий [560], чем оптический антипод этой кетокислоты. Щавелевоянтарная кислота теоретически может существовать в двух оптически активных формах, но ввиду склонности этой кислоты к енолизации разделение изомеров будет, по-видимому, затруднено. Между тем не исключена возможность, что лишь один из изомеров щавелевоянтарной кислоты метаболически активен. а-Кетокислоты, способные к енолизации, теоретически могут существовать в цис- и транс-енольных формах, и в некоторых случаях это было доказано экспериментально [561, 562].
В то время как выделению и идентификации аминокислот посвящено множество исследований, их кетокислотным аналогам было уделено относительно мало внимания. Пировиноградная, щавелевоуксусная и а-кетоглутаровая кислоты найдены в тканях многих животных и растений; имеются данные о наличии в биологических объектах глиоксиловой [563], а-кетоизовалерьяновой [564], а-кето-y-метиленглутаровой [565], а-кетопимелиновой [566], а-кетоадипиновой [566], ß-оксипировиноградной [566] и а-кето-y-оксимасляной кислот [566].
Идентификация а-кетокислот в биологическом материале сопряжена с трудностями вследствие нестабильности многих а-кетокислот. Хорошие результаты дает разделение гидразонов а-кетокислот при помощи хроматографического метода. Однако 2,4-динитрофенилгидразон а-кетокислоты в ряде случаев дает на хроматограммах 2 пятна, которые, по-видимому соответствуют сын- и анти-формам гидразона:

При элюировании этих пятен и вторичном их хроматографировании из каждого вещества нередко вновь образуются по два пятна (соответствующие исходным пятнам). Гидрирование каждого из элюатов приводит к образованию одной и той же аминокислоты.
При гидрировании гидразонов а-кетокислот обычно образуются соответствующие аминокислоты [556, 563, 567], которые можно идентифицировать хроматографически. Этот метод представляет большую ценность для идентификации а-кетокислот, присутствующих в биологическом материале. Нужно, однако, иметь в виду, что 2,4-динитрофенилгидразоны некоторых а-кетокислот при гидрировании дают более одной аминокислоты (см. табл. 9). Для идентификации 2, 4-динитрофенилгидразонов а-кетокислот имеют значение их точки плавления; однако в некоторых случаях (например, у 2,4-динитрофенилгидразона фенилпировиноградной кислоты) точка плавления зависит от растворителя, использованного для кристаллизации [554].
Количественное определение а-кетокислот можно производить путем декарбоксилирования сульфатом церия [568, 569] или перекисью водорода [570]. К числу других методов, полезных для идентификации кетокислот, относятся получение бисульфитных производных, исследование инфракрасных и ультрафиолетовых спектров поглощения, неферментативное переаминирование с образованием соответствующих а-аминокислот. Некоторые а-кетокислоты, например а-кето-y-метилтиомасляная кислота, дают те же характерные цветные реакции, что и аналогичные им аминокислоты. Ряд методов определения а-кетокислот основан на реакциях карбонильной группы.
Для обнаружения и количественного определения некоторых а-кетокислот могут быть использованы ферментативные и микробиологические методы. Многие а-кетокислоты восстанавливаются при действии лактатдегидрогеназы, причем по меньшей мере шесть из них (ß-меркаптопировиноградная кислота, а-кетомасляная кислота, а-кето-β-оксимасляная кислота, ß-оксипировиноградная кислота, пировиноградная кислота и глиоксиловая кислота) восстанавливаются примерно с одинаковой скоростью. Дрожжевая декарбоксилаза а-кетокислот также отличается широким диапазоном субстратной специфичности (см. табл. 9).