Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Окислительное дезаминирование
Аминоксидазы
Процессы окисления аминов изучали с применением многих биологических объектов и самых различных субстратов. Ряд аминов образуется из аминокислот в результате их декарбоксилирования (стр. 199). Окисление аминов происходит путем следующих реакций:
![]()
Исследования Целлера [168] и Блажко [169, 170] привели к обнаружению двух типов аминоксидаз, а именно моноамин-оксидаз и диаминоксидаз. Природа коферментов, необходимых для действия этих ферментов, до сих пор окончательно не установлена. Получены указания на то, что пиридоксальфосфат является коферментом диаминоксидазы [701].
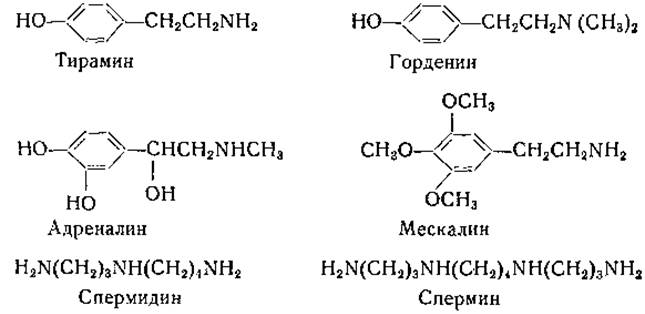
Моноаминоксидаза распространена очень широко; она найдена в различных тканях животных и у растений [171 —174]. Печень является наиболее обильным источником моноаминоксидазы, которая связана в этой ткани с цитоплазматическими гранулами [171]. Моноаминоксидаза окисляет первичные амины жирного ряда, однако метиламин и этиламин окисляются медленно или вовсе не окисляются [173—175]. В субстратной специфичности фермента имеются некоторые видовые различия. Первичные амины с разветвленной углеродной цепью окисляются медленнее, чем амины с прямой цепью. Вторичные и третичные амины окисляются, по-видимому, с образованием соответствующих альдегидов и метиламина или соответственно диметиламина. В частности, моноаминоксидаза окисляет горденин и адреналин. К числу субстратов моноаминоксидазы относятся
нилэтиламин, тирамин, мескалин, окситирамин и артеренол [168]. Моноаминоксидаза окисляет также диамины с 14-, 16- или 18-членной углеродной цепью [176].
Тейбор и сотрудники [177] получили из бычьей крови амин-оксидазу, которую они подвергли 150—200-кратной очистке. Этот фермент окисляет спермин [N,N'-бис(3-аминопропил)-1,4-бутандиамин], спермидин [N-(3-аминопропил)-1,4-бутандиамин] и ряд других аминов, но не действует на адреналин; следовательно, он отличен от моноаминоксидазы печени.
Физиологические функции моноаминоксидазы, по-видимому, связаны с обменом прессорных веществ, однако конкретная роль этого фермента еще не известна. Предполагают, что моноаминоксидаза ответственна, по крайней мере частично, за разрушение адреналина, а также за разрушение токсических аминов, всасывающихся из кишечника; известно, что в слизистой кишечника содержится очень активная моноаминоксидаза. О том, что этот фермент проявляет свое действие in vivo, свидетельствуют опыты, в которых мышам инъецировали меченый триптамин, — введенный изотоп выводился из организма почти количественно в виде парных соединений индолуксусной кислоты [178].
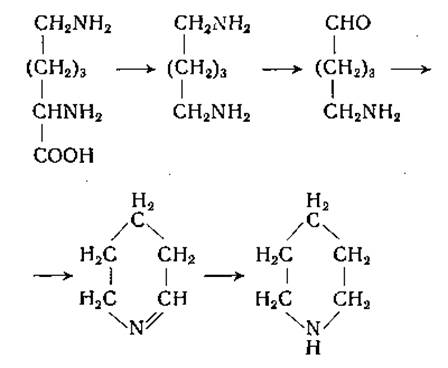
Диаминоксидаза также широко распространена в природе. Этот фермент был открыт Целлером [179] в свиных почках, а затем обнаружен в других тканях животных, у растений и микроорганизмов [180, 181]. Диаминоксидаза, по-видимому, идентична гистаминазе; к числу ее адекватных субстратов принадлежат; агматин, спермидин, гистамин, спермин, кадаверин, путресцин и этилендиамин. Любопытно, что диамины с прямой углеродной цепью, содержащие от 14 до 18 углеродных атомов в молекуле, окисляются моноаминоксидазой, а не диаминоксидазой. В исследованиях Тейбора [182] был убедительно обоснован указанный выше механизм осуществляемых диаминоксидазой реакций (стр. 192). Этот автор получил фермент из почек свиньи в очищенном виде и показал, что продуктами окисления гистамина являются имидазоладетальдегид, аммиак и перекись водорода. Было установлено, что альдегид окисляется дальше в имидазолуксусную кислоту альдегидоксидазой в присутствии дифосфопиридиннуклеотида или ксантиноксидазой молока и кислородом. Путресцин, кадаверин и, по-видимому, другие диамины превращаются в соответствующие аминоальдегиды. При циклизации альдегида, полученного из кадаверина, образуется А'-пиперидин; из этого можно заключить, что лизин может служить предшественником пиперидина [183, 184]:
В опытах с меченым путресцином не так давно установлено, что этот амин используется при синтезе спермина и спермидина в предстательной железе крысы и у некоторых микроорганизмов [702].