Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Декарбоксилирование аминокислот
Аминокислотные декарбоксилазы бактерий
Образование аминов из аминокислот у бактерий ранее наблюдали многие авторы, но лишь исследованиями Гейла и его сотрудников было показано, что этот процесс является результатом действия специфических аминокислотных декарбоксилаз. Гейл и его сотрудники [197, 222—227] изучили у бактерий шесть указанных ниже реакций декарбоксилирования:
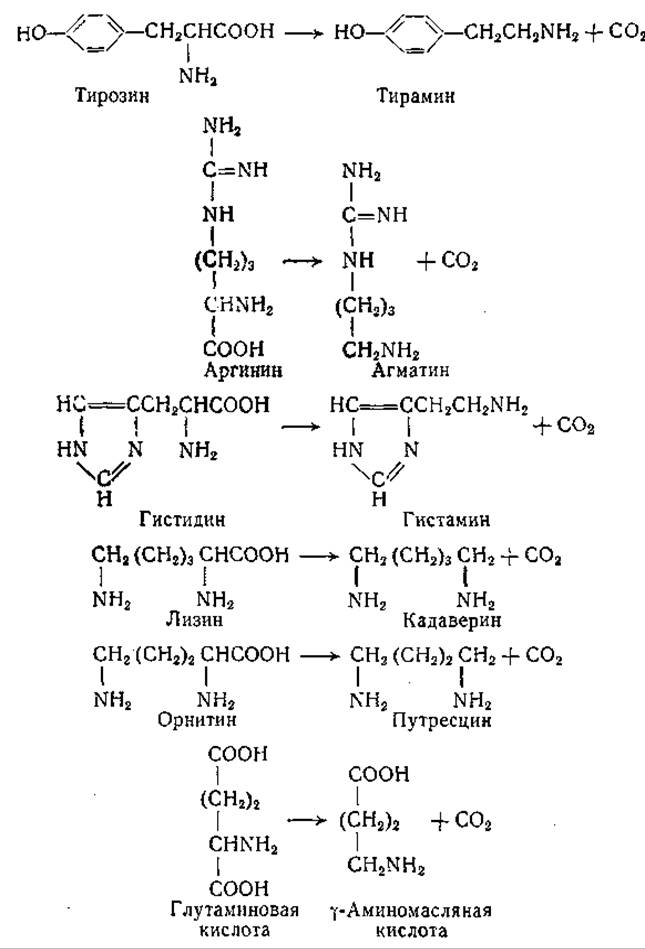
Декарбоксилазы бактерий в отличие от аминокислотных декарбоксилаз животных и растительных тканей обычно имеют pH-оптимум в кислой зоне. Гейл исследовал декарбоксилирование аминокислот у целого ряда микроорганизмов. Его работы показали, что многие бактерии декарбоксилируют несколько аминокислот из числа шести, упомянутых выше, но некоторые микроорганизмы способны декарбоксилировать лишь одну аминокислоту. Некоторые бактериальные декарбоксилазы были получены в частично очищенном виде; в дальнейшем было установлено, что для каждой из катализируемых этими ферментами реакций необходим пиридоксальфосфат. Многие бактерии, проявляющие декарбоксилазную активность, продуцируют эти ферменты в значительно больших количествах при выращивании на средах, содержащих соответствующие аминокислоты. Было отмечено, что максимальное образование декарбоксилаз наблюдается при выращивании бактерий на кислых средах. Много лет назад Ханке и Кеслер [195] высказали интересное предположение, по которому образование аминов бактериями представляет собой физиологический механизм, направленный на нейтрализацию кислот окружающей среды.
Образование и распространение бактериальных декарбоксилаз лизина, орнитина, тирозина, гистидина, аргинина и глутаминовой кислоты изучены довольно подробно; исследована также кинетика реакций, катализируемых декарбоксилазами, и описана частичная очистка некоторых из них. Эти исследования позволили использовать аминокислотные декарбоксилазы для целей количественного определения аминокислот. Такие определения основаны на измерении количества углекислоты, выделяющейся при действии специфической декарбоксилазы [197], или количества образующегося амина [228]. Поскольку аминокислотные декарбоксилазы обладают строгой стереоспецифичностью, они применяются также для обнаружения примеси следов L-изомеров в препаратах D-аминокислот. Кроме того, эти ферменты применяют и для получения D-аминокислот (например, D-лизина или D-глутаминовой кислоты) путем избирательного разрушения L-изомера в рацемических препаратах аминокислот (стр. 94, 95).
Все же следует отметить, что субстратная специфичность некоторых декарбоксилаз не абсолютна. Так, например, L-тирозиндекарбоксилаза Streptococcus faecalis проявляет заметную декарбоксилазную активность в отношении L-фенилаланина [229]; суспензии этих бактерий можно использовать не только для определения тирозина, но и для определения фенилаланина. Последний можно определять в присутствии тирозина, используя специфический метод определения образующегося амина [228]. Тирозиндекарбоксилаза действует также на 3,4-диоксифенилаланин, но не декарбоксилирует производные тирозина с замещенной фенольной группой, например О-метилтирозин.
L-Лизиндекарбоксилаза бактерий образует углекислоту из δ-оксилизина [230]. Предполагаемый продукт этой реакции — оксикадаварин — не был выделен; неизвестно также, подвергаются ли декарбоксилированию оба L-изомера δ-оксилизина (с превращением в соответствующие изомеры оксикадаверина). Лизиндекарбоксилаза не действует на а, ε-диаминопимелиновую кислоту; эту аминокислоту декарбоксилирует особый фермент, присутствующий у некоторых бактерий (см. ниже).
В ранних работах было отмечено, что препараты глутаматдекарбоксилазы образуют СО2 из ß-оксиглутаминовой кислоты. В последние годы найдено, что некоторые микроорганизмы, в том числе многие штаммы Escherichia coli, декарбоксилируют только одну из оптических форм алло-β-окси-DL-глутаминовой кислоты [231]; декарбоксилирование ß-окси-DL-глутаминовой кислоты протекает значительно медленнее. Показано, что при декарбоксилировании алло-β-оксиглутаминовой кислоты образуется -у-амино-β-оксимасляная кислота; реакция активируется пиридоксальфосфатом. Декарбоксилирование глутаминовой и алло-β-оксиглутаминовой кислот, по-видимому, осуществляется различными ферментами, так как отношение скоростей декарбоксилирования этих аминокислот у разных штаммов бактерий неодинаково. Следует указать, что биологическое значение фермента, декарбоксилирующего алло-β-оксиглутаминовую кислоту, остается под сомнением, поскольку в природе до сих пор не обнаружен ни один из четырех возможных изомеров ß-оксиглутаминовой кислоты.
Найден мутантный штамм Е. coli, который декарбоксилирует у-оксиглутаминовую кислоту с образованием а-окси-у- аминомасляной кислоты [232]. Идентичен ли фермент, катализирующий эту реакцию, глутаматдекарбоксилазе, пока, не известно. К числу аминокислот, декарбоксилируемых бактериальными декарбоксилазами, принадлежит L-аспарагиновая кислота. По данным Виртанена и сотрудников [233, 234], Ehizobium leguminosarum декарбоксилирует аспарагиновую кислоту с образованием ß-аланина:
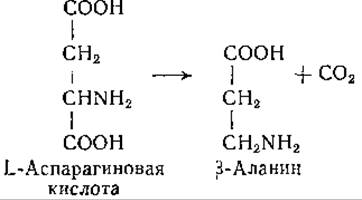
Эта ферментативная реакция свойственна и некоторым другим микроорганизмам; однако скорость ее зачастую так мала, что определение образующейся углекислоты технически затруднительно. Образование ß-аланина при этой реакции было подтверждено при помощи микробиологического метода [235,236].
Декарбоксилирование L-аспарагиновой кислоты с образованием L-аланина обнаружено у Clostridium welchii [237] и у других микроорганизмов [238]. Эта реакция уникальна в том отношении, что при ней происходит отщепление ß-карбоксильной, а не а-карбоксильной группы:
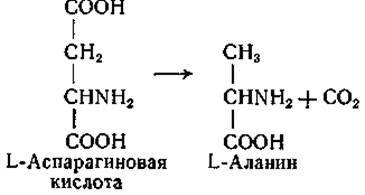
Acпapтaт-ß-декарбоксилаза Cl, welchii отличается от других декарбоксилаз еще и тем, что она активируется не только пиридоксальфосфатом, но и очень малыми количествами а-кето- кислот. Это явление нельзя отнести за счет декарбоксилирования щавелевоуксусной кислоты, возникающей в результате переаминирования между добавленной а-кетокислотой и аспарагиновой кислотой, по-скольку а-аланин, образующийся при ферментативном карбоксилировании аспарагиновой кислоты в присутствии меченой пировиноградной кислоты, не содержит изотопной метки. По всей вероятности, активирующее действие добавленной а-кетокислоты связано с образованием пиридоксальфосфата в результате реакции переаминирования между а-кетокислотой и пиридоксаминфосфатом, присутствующим в ферментном препарате.
Еще одна бактериальная декарбоксилаза, при действии которой образуется а-аминокислота, а именно декарбоксилаза мезо-а,ε-диаминопимелиновой кислоты, была открыта Уорк и ее сотрудниками. Этот фермент был найден у ряда микроорганизмов, в том числе у Escherichia coli, Aerobacter aerogenes и Sarcina lutea; он катализирует следующую реакцию [239—242]:
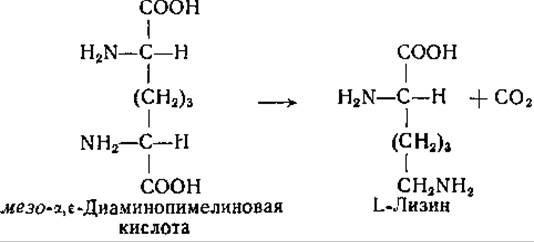
Неочищенные препараты декарбоксилазы диаминопимелиновой кислоты декарбоксилируют как мезо-, так и LL-форму этой аминокислоты с образованием L-лизина. Однако в очищенном виде этот фермент значительно более активно превращает мезоформу, чем LL-форму. Фактически субстратом этой декарбоксилазы является мезо-а,ε-диаминопимелиновая кислота; декарбо- ксилирование LL-формы этой аминокислоты неочищенными препаратами фермента объясняется, видимо, предварительным переходом LL-форму в жезо-форму. Взаимные превращения LL-формы и жезо-формы а, ε-диаминопимелиновой кислоты, очевидно, катализируются специфической рацемазой (стр. 244). У некоторых микроорганизмов, содержащих наряду с рацемазой и декарбоксилазой диаминопимелиновой кислоты также декарбоксилазу L-лизина, происходят следующие последовательные превращения:

Декарбоксилаза диаминопимелиновой кислоты в отличие от лизиндекарбоксилазы и большинства других бактериальных аминокислотных декарбоксилаз имеет pH-оптимум в нейтральной зоне. Установлено, что ее коферментом служит пиридоксальфосфат. Роль декарбоксилазы диаминопимелиновой кислоты в процессе биосинтеза лизина рассматривается дальше (стр. 428). Реакция декарбоксилирования диаминопимелиновой кислоты уникальна в том отношении, что отщепляемая карбоксильная группа связана с асимметрическим центром, имеющим D-конфигурацию. Все прочие известные аминокислотные декарбоксилазы действуют на L-аминокислоты. В ранних работах упоминается о декарбоксилировании d-лизина [233, 243], но в настоящее время эта аминокислота известна как L-лизин.
Ранее были сделаны попытки показать обратимость реакций декарбоксилирования аминокислот; при этом заметного образования аминокислоты из амина и углекислоты не наблюдалось. Обратимость реакции была доказана позже при помощи изотопного метода [244, 245]. В частности, было показано, что при реакции декарбоксилирования глутаминовой кислоты константа равновесия ![]() равна 70; таким образом, в точке равновесия значительно преобладает декарбоксилирование глутамата. Константы равновесия других реакций ферментативного декарбоксилирования аминокислот еще не изучены, и не исключена возможность, что при определенных условиях может иметь место синтез аминокислоты путем присоединения СО2 к соответствующему амину.
равна 70; таким образом, в точке равновесия значительно преобладает декарбоксилирование глутамата. Константы равновесия других реакций ферментативного декарбоксилирования аминокислот еще не изучены, и не исключена возможность, что при определенных условиях может иметь место синтез аминокислоты путем присоединения СО2 к соответствующему амину.
Доказано участие витамина B6 в форме пиридоксальфосфата в большей части известных реакций декарбоксилирования аминокислот у животных, растений и микроорганизмов (см. табл. 20). Роль пиридоксальфосфата в декарбоксилировании аминокислот обсуждается ниже (стр. 248).
Интересные данные о механизме декарбоксилирования аминокислот получены при помощи D2О [246]. Обнаружено, что в процессе ферментативного декарбоксилирования лизина, тирозина и глутаминовой кислоты в молекулу амина у углеродного атома, несущего аминную группу, включается только один атом дейтерия. Из этого следует, что в процессе декарбоксилирования не происходит образования на промежуточной стадии иминопроизводного аминокислоты, поскольку при а-углеродном атоме сохраняется один водородный атом (а-водород исходной аминокислоты). Эти наблюдения согласуются с рассмотренным на стр. 257 механизмом декарбоксилирования аминокислот, основанным на образовании шиффова основания в результате конденсации аминогруппы аминокислоты и альдегидной группы пиридоксальфосфата.
Вполне вероятно, что ферментативному декарбоксилированию подвергаются не только упомянутые выше, но и другие аминокислоты. В природных объектах обнаружен ряд аминов, имеющих строение продуктов декарбоксилирования природных аминокислот (например, триптамин и амины, соответствующие лейцину, изолейцину и валину) [247]. Нерешенным остается вопрос о существовании сериндекарбоксилазы. Опубликовано краткое сообщение о том, что клетки Proteus vulgaris декарбоксилируют лейцин и валин [248].