Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Реакция переаминирования с участием ω-аминокислот и альдегидокислот
В настоящее время известен ряд реакций переаминирования с участием ω-аминокислот и альдегидокислот. Реакция переаминирования глицин-орнитин уникальна в том отношении, что один из субстратов этой реакции и один из ее продуктов являются альдегидами [288]:
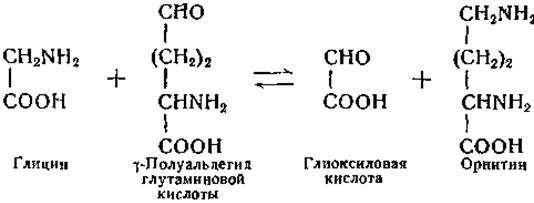
Глицин интересен также тем, что он представляет собой одновременно а-аминокислоту и ω-аминокислоту. Обратимое превращение глиоксшювой кислоты в глицин обнаружено в опытах на животных in vivo (стр. 319). В опытах in vitro было показано, что глутамин, аспарагин, глутаминовая и аспарагиновая кислоты могут служить донаторами аминогрупп в реакциях переаминирования с глиоксиловой кислотой, причем аминодикарбоновые кислоты менее активны, чем их амиды [289, 298]. Имеются данные об образовании глутаминовой кислоты из глицина и а-кетоглутаровой кислоты [277, 280], но реакция в данном направлении протекает с трудом; появление глиоксиловой кислоты в качестве продукта этой реакции не было установлено. Заслуживает внимания, что и при неферментативной реакции переаминирования
![]()
положение равновесия благоприятствует образованию глицина; изменение свободной энергии для этой реакции составляет примерно +2000 кал. Эта величина значительно больше величин, найденных для реакций аланин-а-кетоглутарат и аспартат-а-кетоглутарат [299].
Реакции переаминирования между орнитином и пируватом и между орнитином и а-кетоглутаратом обнаружены в печени [277, 288, 300] и у Neurospora crassa [301]. С наибольшей скоростью протекают реакции между орнитином и пировиноградной, а-кетоглутаровой, а-кетомасляной или глиоксиловой кислотами, согласно следующему общему уравнению:

При взаимопревращениях пролина, орнитина и глутаминовой кислоты общим промежуточным продуктом является +полуальдеґид глутаминовой кислоты. Это соединение впервые получили Фогель и Дэвис [302], обнаружившие, что оно служит предшественником пролина. Реакция переаминирования между орнитином и кетокислотами доходит почти до конца как в печени, так и у Neurospora. Равновесие реакции смещено в сторону образования у-полуальдегида глутаминовой кислоты — возможно, потому, что реакция осложнена превращением альдегида в другие продукты.
Другая реакция переаминирования с участием орнитина была обнаружена у Escherichia coli при изучении биосинтеза этой аминокислоты (стр. 344). Фогель получил данные, свидетельствующие о превращении N-ацетилглутаминовой кислоты в соответствующий у-полуальдегид. Последнее соединение в результате переаминирования превращается в a-N-ацетилорнитин; реакцию переаминирования удалось продемонстрировать в опытах с бесклеточными экстрактами Е. coli в присутствии глутаминовой кислоты и пиридоксальфосфата [303, 304]. Переаминирование a-аминогруппы орнитина происходит в том случае, когда S-аминогруппа замещена [128, 288].
Переаминирование между туаминомасляной кислотой и a-кетоглутаратом, впервые описанное Бесманом и сотрудниками [305], служит еще одним примером переноса ω-аминогруппы. Помимо у-аминомасляной кислоты [306], в реакции переаминирования вступают также ß-аланин [305, 307], 8-аминовалерьяновая кислота [308, 309] и а, у-диаминоглутаровая кислота [308]. Реакция между у-аминомасляной и а-кетоглутаровой кислотами изучена обстоятельно. Найдено, что продуктом этой реакции является полуальдегид янтарной кислоты; реакция обратима:
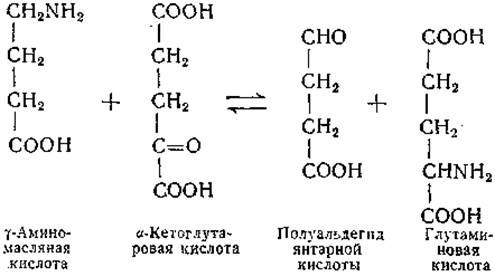
Вещества, образующиеся в результате реакции переаминирования а, у-диаминоглутаровой кислоты (пока не найденной в природных объектах), ß-аланина и δ-аминовалерьяновой кислоты, не были идентифицированы. Имеются указания на то, что δ -аминовалерьяновая кислота, представляющая собой продукт декарбоксилирования а-кето-ε-аминокапроновой кислоты, может возникать в процессе распада лизина [309]. Для полуальдегида глутаровой кислоты — предполагаемого продукта реакций переаминирования δ-аминовалерьяновой кислоты — возможно окисление в глутаровую кислоту и далее в а-кетоглутаровую кислоту (стр. 434).