Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Значение реакций переаминирования в обмене аминокислот
Широкое распространение реакций переаминирования и участие в них многочисленных аминокислот свидетельствуют о существенном значении этих реакций в обмене веществ. Роль реакций переаминирования в процессах окислительного дезаминирования L-аминокислот и мочевинообразования у млекопитающих рассмотрена выше (стр. 171). Возможность замещения незаменимых а-аминокислот в пищевом рационе растущих животных соответствующими кетокислотами определяется наличием в организме активных трансаминаз (стр. 137). Сравнительно недавно было показано, что молодые крысы растут примерно с одинаковой скоростью при кормлении синтетической диетой, содержащей 10 незаменимых аминокислот и глутаминовую кислоту, и рационом, в котором 5 незаменимых аминокислот (лейцин, изолейцин, валин, фенилаланин и метионин) заменены соответствующими кетокислотами и эквивалентным источником азота [321]. Эти данные свидетельствуют о том, что общая активность трансаминаз в организме крысы очень велика; поскольку для синтеза белков необходимо одновременное присутствие всех аминокислот, приведенные выше факты говорят о том, что указанные пять а-кетокислот быстро подвергаются переаминированию.
1 Существование таких реакций остается недоказанным. В экстрактах «пиридоксаминфосфат-трансаминазы» из Е. coli [R. В. Веесhеуa. F. С. Happold, Biochem. J., 66, 520 (1957)] превращение пиридоксаминфосфата в пиридоксальфосфат происходит путем окислительного дезаминирования, а не переаминирования, а реакция, ошибочно принятая авторами за переаминирование пиридоксальфосфата, состоит в действительности в ферментативном дефосфорилировании пиридоксальфосфата (J. Turner, личное сообщение, 1959). По новейшим данным Сенеза (1960), в бактериальных экстрактах наблюдается неферментативное переаминирование между пиридоксаминфосфатом и а-кетокислотами; этим объясняется активирование некоторых аминокислотных декарбоксилаз бактерий кетокислотами. — Прим. ред.
Попытки установить наличие прямой связи между реакциями переаминирования и такими процессами, как синтез белка, рост и развитие, не увенчались успехом [255, 257, 322—320]. В опытах на крысах получены интересные данные о влиянии гормонов передней доли гипофиза и гипофизэктомии на реакции переаминирования в тканях. Введение гормона передней доли гипофиза вызывает повышение активности аспартат-глутамат-транс-аминазы в печени (но не в почках) у гипофизэктомированных крыс и у крыс, находящихся на ограниченном пищевом рационе, но не влияет на активность этого фермента в печени и почках у взрослых здоровых самок [327]. Этот же гормон вызывает увеличение активности аланин-глутамат-трансаминазы (но не аспартат-глутамат-трансаминазы) в печени молодых крыс и снижение активности этого фермента у взрослых самцов [328]. При введении кортизона увеличивается активность аспартат-глутамат-трансаминазы в почках и сердечной мышце мыши и уменьшается активность этого фермента в печени [329]. Снижение активности аспартат-глутамат- и особенно аланин-глутамат-трансаминазы наблюдается у крыс, находящихся на малобелковой диете [330]. Истолкование упомянутых эффектов в настоящее время затруднительно; во всяком случае, такие наблюдения дают представление о некоторых вопросах, которые еще предстоит решить.
Активность аспартат-глутамат-трансаминазы кровяной сыворотки в норме очень низка; она значительно увеличивается при некоторых заболеваниях, в частности при инфаркте миокарда. Это явление, имеющее диагностическое значение, рассматривается в гл. V.
Браунштейн и Бычков [331] в 1939 г. выдвинули предположение, что окислительное дезаминирование некоторых L-аминокислот [332] можно объяснить сочетанным действием трансаминаз, катализирующих переаминирование между а-аминокислотами и а-кетоглутаровой кислотой, и глутаматдегидрогеназы (стр. 175).

Поскольку эти реакции обратимы, следует ожидать, что при помощи данного механизма может происходить и аминирование а-кетокислот. Вопрос о существовании ферментов обратимого аминирования для других аминокислот, помимо глутаминовой кислоты, нуждается в изучении. Мнения о существовании подобных механизмов придерживается Чедранголо [333], который получил данные, указывающие на прямое окисление аланина ферментными препаратами из печени и почек. Ферментные препараты, полученные из печени и почек В6-авитаминозных крыс, проявляют пониженную способность к дезаминированию и переаминированию L-аспарагиновой кислоты и L-аланина, тогда как автивность глутаматдегидрогеназы в этих препаратах находится на нормальном уровне [334]. В связи с этим представляют интерес наблюдения Финчема [335], показавшие, что мутантный штамм Neurospora crassa, у которого отсутствует глутаматдегидрогеназа, лишен способности ассимилировать аммиак, тогда как из большой группы аминокислот любая обеспечивала рост плесени при добавлении к питательной среде вместо глутаминовой кислоты.
Вместе с тем имеются данные, свидетельствующие о наличии у некоторых организмов иных путей аминирования и дезаминирования аминокислот (см., например, [336—339]). Так, например, было найдено, что у Brucella abortus при определенных условиях 75% аланина образуется в результате переаминирования, а остальное количество — посредством других механизмов. У этого микроорганизма имеет место прямое аминирование пирувата, однако оно не является единственным путем синтеза аланина. Имеются сообщения о прямом ферментативном аминировании пирувата у Bacillus subtilis (стр. 191).1.
1 Клетки Bacillus subtilis и многих других спороносных аэробов (бацилл) не содержат глутаматдегидрогеназы: у этих микроорганизмов и отчасти у других грамположительных бактерий, обладающих обратимо действующей L-аланиндегидрогеназой, ассимиляция аммиака происходит путем восстановительного аминирования пировиноградной кислоты и последующего переаминирования между аланином и кетоглутаровой кислотой [Шень, Сан-Чун, Хунь Мун-мин и А. Е. Браунштейн, Биохимия, 24, 929, 957 (1959)]; предполагаемое некоторыми авторами наличие аланиндегидрогеназы у грамотрицательных бактерий, высших растений и животных нельзя считать доказанным. — Прим. ред.
В последние годы стало очевидным, что процессы биосинтеза и распада многих аминокислот протекают с участием реакций переаминирования. Промежуточные реакции обмена отдельных аминокислот рассматриваются в гл. IV; здесь мы ограничимся кратким обсуждением общих функций процессов переаминирования в промежуточном обмене.
Путем переаминирования происходит обратимое образование аланина, глутаминовой и аспарагиновой кислот из соответствующих им а-кетокислот, возникающих в цикле лимонной кислоты. Реакции переаминирования фигурируют в качестве промежуточных звеньев в процессах биосинтеза ряда других аминокислот (например, изолейцина, валина, лейцина, фенилаланина, тирозина и др.) у микроорганизмов. У Escherichia coli в биосинтезе аминокислот участвуют по меньшей мере три трансаминазы [272]:
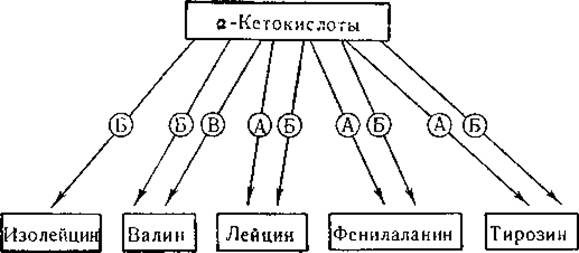
В биосинтезе фенилаланина, тирозина и лейцина принимают участие трансаминазы А и Б; ферментный препарат А более активен в отношении ароматических аминокислот, однако активность фермента по отношению к лейцину также достаточно высока. Образование валина катализируется ферментами Б и В; изолейцин синтезируется только при участии фермента Б. Следовательно, образование каждой из перечисленных аминокислот, за исключением изолейцина, обеспечивается двумя трансаминазами. Не удивительно, что единственный мутантный штамм Е. coli, у которого обнаружен дефект на стадии переаминирования, оказался неспособным синтезировать именно изолейцин.
С реакциями переаминирования связаны процессы распада тирозина в организме (стр. 418), биосинтез орнитина (стр. 344) и гистидина (стр. 388) и процессы обмена глутамина и аспарагина (стр. 215). В процессе диссимиляции цистеина реакции переаминирования встречаются на трех этапах:

Реакция (1) представляет промежуточное звено одного из механизмов ферментативного десульфирования цистеина; в присутствии редуцирующих веществ вместо элементарной серы образуется сероводород. В реакции (2) акцепторами аминогруппы могут служить а-кетоглутаровая, щавелевоуксусная и пировиноградная кислоты. Реакция между цистеинсульфиновой кислотой и а-кетоглутаратом, вероятно, катализируется аспартат-глутамат-трансаминазой. По некоторым данным, реакция (3) катализируется особым ферментом [340], хотя известно, что очищенные препараты аспартат-глутамат-трансаминазы сердца свиньи [269, 274] способны осуществлять реакции с участием цистеиновой кислоты.
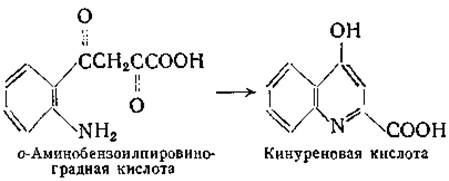
Реакции переаминирования кинуренина и 3-оксикинуренина приводят к образованию кинуреновой и соответственно ксант-уреновой кислот [341—344]. При изучении кинурениназы свиной печени было найдено, что при наличии в опытных пробах пирувата или кетоглутарата наблюдается образование кинуреновой кислоты из кинуренина [344, 345]. Позднее в опытах с одним из штаммов Pseudomonas была изучена реакция переаминирования между кинуренином и а-кетоглутаратом с образованием кинуреновой и глутаминовой кислот. Образование кинуреновой кислоты объясняется, очевидно, спонтанной циклизацией предполагаемого промежуточного продукта этой реакции — о-аминобензоилпировиноградной кислоты:
Эта реакция близка к реакции циклизации а-кето-ε-аминокапроновой кислоты [288]:
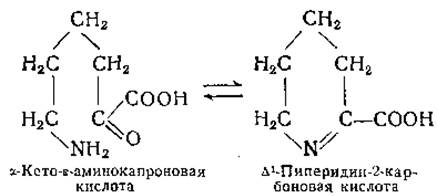
В отличие от этой последней реакции образование кинуреновой кислоты протекает необратимо вследствие образования стабильного ароматического кольца. Реакция переаминирования кинуренина конкурирует с реакцией его расщепления кинурениназой; для обеих реакций в качестве кофермента необходим пиридоксальфосфат. В опытах с экстрактами печени крысы осуществлено разделение этих ферментных систем [346]; при pH 6,3 активность кинурениназы печени крысы значительно снижается по сравнению с активностью кинуренин-трансаминазы [347]. Кинуренин-трансаминаза обнаружена также в почках крысы [347]. Физиологическая функция кинуренин-трансаминазы в почках не совсем понятна, поскольку в ткани почек не происходит заметного превращения триптофана в кинуренин или кинуреновую кислоту, а в крови при нормальных условиях содержание кинуренина ничтожно [344, 348]. Образование ксант-уреновой кислоты из 3-оксикинуренина также происходит путем переаминирования ([344, 349] и стр. 405). Препараты кинуренин-трансаминазы действуют и на 5-оксикинуренин; конечным продуктом реакции переаминирования в этом случае является 6-оксикинуреновая кислота [349, 350].
Число прямых доказательств участия лизина в реакциях переаминирования невелико; однако при исследовании обмена этой аминокислоты получены данные, указывающие на ее превращение в соответствующее а-кетопроизводное путем переаминирования [351] (см. стр. 431); описаны реакции переаминирования с участием 5-аминовалерьяновой кислоты — возможного продукта обмена лизина [308, 309]. Реакции переаминирования играют роль и в обмене у-аминомасляной кислоты, ß-аланина и 3, 5-дийодтирозина [352]. У Bacillus subtilis, В. anthracis и, возможно, у других микроорганизмов этой группы D-трансаминаза, по-видимому, играет роль в образовании D-глутаминовой кислоты, необходимой для синтеза внеклеточной D-полиглутаминовой кислоты (см. стр. 265).
В обмене некоторых растений значительную роль, по-видимому, играют реакции переаминирования между у-метиленглутаминовой кислотой и щавелевоуксусной, а-кетоглутаровой или пировиноградной кислотами [357], что подтверждается наличием в растительных тканях 7-метиленглутаминовой кислоты [353, 354] и а-кето-у-метиленглутаровой кислоты [355, 356].
Сравнительно недавно описано образование оксиаспарагиновой кислоты в результате реакции переаминирования между щавелевогликолевой (диоксифумаровой) и глутаминовой кислотами. Эта ферментативная реакция обнаружена в различных тканях животных, в том числе в тканях мозга, печени и почек [259].
В литературе имеются сообщения об образовании аминокислот путем ферментативного переноса аминогрупп аденина, гуанина, цитозина и пиридоксамина на а-кетоглутаровую кислоту в ферментных препаратах Е. coli [358, 359], а также аминогрупп гуанина, аденозина, гуанозина и адениловой кислоты на глиоксиловую или гликолевую кислоту в срезах печени [360] Продукты превращения пуриновых и пиримидиновых производных при этом не исследовались. Маловероятно, чтобы в этих случаях имели место типичные реакции переаминирования; природа описанных превращений остается неясной.
Нужно считаться с тем, что в реакциях переаминирования, возможно, участвуют соединения, не являющиеся аминокислотами, например глюкозамин, фосфорные эфиры некоторых углеводов, глутатион и другие пептиды. Хербст и Шимин [361] наблюдали неферментативное превращение пирувоил-аланина в аланилаланин; эти данные говорят о возможном существовании аналогичных ферментативных реакций. В литературе были сообщения о ферментативном переаминировании пептидов [322], но эти работы подверглись критике в связи с ненадежностью применявшихся аналитических методов [255, 257, 260, 277]. Описано переаминирование ß-оксалацетиламинокислот с образованием ß-аспартилпептидов [154] (стр. 223).
Хотя переаминирование играет существенную роль в образовании и распаде многих аминокислот, обнаружилось, что превращение некоторых аминокислот, способных вступать в реакции переаминирования (например, триптофана, метионина, фенилаланина), по-видимому, протекает преимущественно иными путями. Нужно помнить, что наши нынешние представления о «главных» путях обмена не окончательны и могут измениться; к тому же превращения, второстепенные в количественном отношении, могут играть существенную физиологическую роль. Превращения а-кетоаналога валина в пантоиновую кислоту у Escherichia coli [362] представляет пример «второстепенного» превращения, приводящего к образованию незаменимого метаболита. Присутствие фенилацетилглутамина в моче здоровых людей позволяет заключить, что фенилаланин частично превращается в организме в фенилпировиноградную кислоту (стр. 421). О механизме ферментативного переаминирования см. стр. 247.
1 При тщательной экспериментальной проверке наблюдения относительно реакций переаминирования с участием аминопуринов и аминопиримидинов не были подтверждены (А. Schein а Е. Brown, Biochem. J. 67, 594, 1957). — Прим. ред.