Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Синтез и катаболизм соединений, входящих в семейство глутаминовой кислоты
Катаболизм глутамата и родственных аминокислот
Обратимость действия глутаматдегидрогеназы означает, что избыток глутамата может легко превратиться обратно в а-кетоглутарат. Кетоглутарат может распадаться до сукцинил-СоА и далее путем ß-окисления — до малата, пирувата и ацетил-СоА. Последний может снова включиться в цикл трикарбоновых кислот и окислиться до СО2:
![]()
Примерно таким же путем осуществляется распад многих других аминокислот. В большинстве случаев имеет место переаминирование в соответствующую а-кетокислоту. Далее следует ß-окисление и расщепление до таких соединений, как пируват и ацетил-СоА.
а. Катаболизм, начинающийся с декарбоксилирования
Существует и другой путь распада глутамата: а-аминобутиратный шунт, рассматриваемый в гл. 9 (рис. 9-4). а-Аминобутиратный шунт начинается не с дезаминирования или переаминирования, а с зависимого от пиридоксальфосфата декарбоксилирования. Поскольку декарбоксилазы известны для большинства аминокислот, обычно существует несколько путей, по которым может пойти начинающееся таким образом расщепление. В ткани мозга у-аминобутират, как полагают, функционирует как важный нейромедиатор (гл. 16, разд. Б, 4, б).
б. Сбраживание глутамата
Особые проблемы возникают у анаэробных бактерий, питающихся аминокислотами. Для удовлетворения их энергетических нужд необходимы сбалансированные реакции брожения. Два примера сбраживания глутамата представлены на рис. 14-5. В первом из них [уравнение (14-23)] [43] глутамат- распадается на СО2, аммиак, ацетат- и бутират-:
![]()
Данная последовательность начинается с реакций у-аминобутиратного шунта (рис. 14-5, стадии а и б), но далее полуальдегид янтарной кислоты восстанавливается в у-оксимасляную кислоту с использованием NADH, образующегося в процессе транс-дезаминирования. С помощью СоА-трансферазы (стадия г) образуются две молекулы ацил-СоА-производного этой оксикислоты с затратой на это двух молекул ацил-СоА. Далее используется β,у-элиминирование молекулы воды аналогично тому, как это происходит при образовании вакценовой кислоты [уравнение (12-14)]. Изомеризация (возможно, с помощью того же фермента, который катализирует и элиминирование) приводит к образованию кротонил-СоА (стадия е). Последний подвергается дисмутации, в результате которой половина молекул восстанавливается в бутирил-СоА, а другая половина гидратируется и окисляется в ацетоацетил-СоА через стандартную последовательность реакций ß-окисления. Ацетоацетил-СоА расщепляется с регенерацией двух молекул ацетил-СоА. В результате расщепления бутирил-СоА организм может получить одну молекулу АТР. Вторую молекулу можно, вероятно, получить путем окислительного фосфорилирования на участке между NADH, генерируемым при образовании ацетоацетил-СоА, и реакциями восстановления кротонил-СоА в бутирил-СоА. Оба процесса идут при уровнях окислительновосстановительного потенциала, достаточно различающихся, чтобы сопряжение подобного рода было возможно.

РИС. 14-5. Две реакции сбраживания глутамата. А. У Clostridium aminobutylicum. Б. У Clostridium tetanomorphurn.
Второй процесс сбраживания глутамата начинается с изомеризации глутамата в ß-метиласпартат; эта реакция катализируется мутазой, «содержащей витамин В12 (табл. 8-6). Происходящая при этом перестройка молекулы делает возможным а,β-элиминирование аммиака — процесс, невозможный для исходного глутамата. Гидратация образующегося ненасыщенного продукта в цитрамалат и альдольное расщепление последнего дает ацетат и пируват. Ацетат является одним из обычных конечных продуктов этого вида брожения. Пируват может расщепляться на Н2, СО2 и ацетил-СоА под действием пируват-формиат-лиазной системы, а расщепление ацетил-СоА может обеспечить образование АТР. Другой путь состоит в превращении двух молекул ацетил-СоА в бутирил-СоА путем конденсации и восстановления. В этой реакции восстановительные эквиваленты, генерируемые при распаде пирувата, должны быть направлены на восстановление кротонил-СоА, а не на освобождение Н2. Таким образом, стехиометрия будет такой же, как и в процессах брожения, происходящих у Clostridium aminobutylicum.
е. Распад пролина
Один из путей катаболизма пролина в сущности сводится к обращению его образования из глутамата. Под действием пролиноксидазы происходит образование ∆1-пирролин-5-карбоксилата.

Соответствующий альдегид с открытой цепью, образующийся путем гидролиза, окисляется обратно в глутамат. Существует и другой путь распада, начинающийся с окисления по другую сторону от азота кольца с образованием ∆1-пирролин-2-карбоксилата. Метаболическая судьба этого соединения не ясна.
Анаэробные бактерии способны восстанавливать пролин в 5-амино-валерат [уравнение (8-34)], сопрягая эту реакцию с окислительным распадом другой аминокислоты (реакция Стикленда).
![]()
Соответствующий путь распада 4-окси-L-пролина, входящего в состав коллагена, дает глиоксилат и пируват [уравнение (14-24)].

У некоторых псевдомонад осуществляется окисление оксипролина по другую сторону от азота кольца с последующим образованием а-кетоглутарата.
г. Катаболизм аргинина
Аргинин тоже подвергается обратному превращению в глутамат и а-кетоглутарат. Начальной стадией служит отщепление гуанидиниевой группы с образованием орнитина. Это может осуществляться действием аргиназы с образованием мочевины (рис. 14-4). Другой, аргинин дигидролазиый путь инициируется особой гидролазой, расщепляющей аргинин на цитруллин и аммиак. Затем в результате фосфоролиза цитруллина образуется карбамоилфосфат. Расщепление последнего с образованием СО2 и аммиака [катализируемое карбаматкиназой; уравнение (14-16)] может быть использовано для образования АТР у микроорганизмов, живущих на аргинине.
Расщепление L-аргинина Streptomyces griseus начинается реакцией, катализируемой гидроксилазой, осуществляющей окислительное декарбоксилирование аминокислоты и ее превращение в амид [уравнение (14-25)].
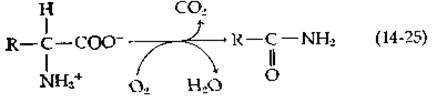
Эта реакция в точности аналогична той, которая катализируется лизиноксигеназой [уравнение (10-49)]. В случае аргинина продуктом реакции является у-гуанидинбутирамид. Дальнейший его распад происходит путем гидролиза амидной группы и отщепления гуанидиниевой группы с образованием мочевины и у-аминобутирата. В клетках Pseudomonas putida расщепление аргинина начинается дезаминированием в соответствующую а-кетокислоту с последующим окислительным декарбоксилированием, которое осуществляет тиаминдифосфатзависимый фермент; продуктом реакции является у-гуанидинобутиральдегид. Дегидрирование и гидролиз и в этом случае приводят к образованию у-аминобутирата [44].