Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Метаболизм ароматических соединений
Антраниловая кислота и триптофан
Триптофан, как и многие другие специализированные метаболиты, образуется из антраниловой кислоты (о-аминобензойной кислоты) при участии антранилатсинтетазы. Одна из двух субъединиц этого фермента содержит глутаминсвязывающий центр, в котором, как полагают, происходит гидролитическое отщепление аммиака (разд. Б, 1). Возможно, сначала образуется амид хоризмовой кислоты (рис. 14-18, реакция а), после чего азот переносится на бензольное кольцо с одновременным элиминированием гидроксил-иона. Из получающегося в результате бициклического производного далее элиминируется пируват. Другая возможность состоит в том, что происходит присоединение аммиака (рис. 14-18, реакция б) с отщеплением гидроксил-иона на первой стадии и элиминированием пирувата на второй [108, 109].
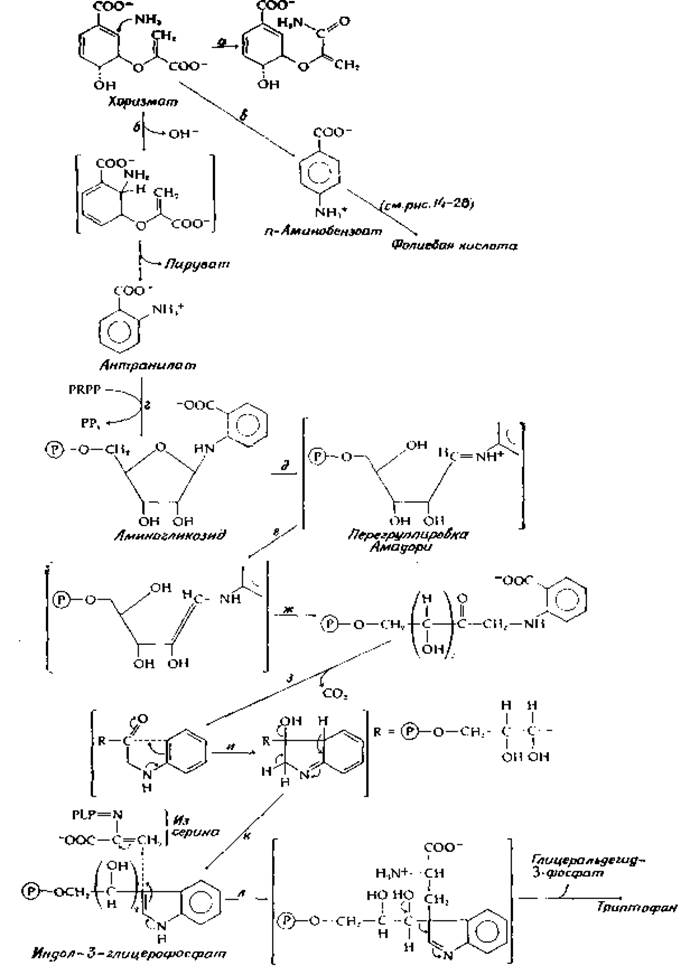
РИС. 14-18. Биосинтез триптофана из хоризмовой кислоты.
Изомер антранилата n-аминобензоат является предшественником фолиевой кислоты. Его биосинтез (реакция в, рис. 14-18) имеет много общего с синтезом антранилата, но происходит путем замещения гидроксильной группы на аминогруппу при том же атоме углерода. Имеются данные в пользу образования следующего промежуточного соединения [110]:

В процессе превращения антранилата в триптофан для образования индольного ядра должны присоединиться еще два атома углерода. Они поступают из фосфорибозилпирофосфата (PRPP), который является важным промежуточным соединением в ходе синтеза как нуклеотидов, так и аминокислот. PRPP образуется из рибозо-5-фосфата путем переноса пирофосфорильной группы с молекулы АТР [111]. Группа НО — при аномерном углероде рибозофосфата, атакуя атом Рβ, вытесняет АМР из АТР ([уравнение (14-42)], рис. 7-7).

Фосфорибозилпирофосфат служит донором фосфорибозильных групп в ходе биосинтеза нуклеотидов (разд. Л). В процессе биосинтеза триптофана он превращается в аминогликозид антраниловой кислоты путем вытеснения пирофосфатной группы аминогруппой (рис. 14-18, стадия г). Аминогликозид далее подвергается внутримолекулярной окислительно-восстановительной реакции, известной под названием перегруппировки Амадори. В ходе этой перегруппировки атом сахара С-1 восстанавливается, тогда как атом С-2 окисляется, переходя в карбонильную группу. Образуется продукт с разомкнутой цепью. Реакцию можно разбить на три стадии д, е и ж, проходящие через гипотетические промежуточные соединения, показанные на рис. 14-18 в прямых скобках. На первой стадии раскрывается пентозное кольцо и образуется протонированное шиффово основание; реакцией подобного типа объясняют чувствительность нуклеотидов к кислотному гидролизу (гл. 2, разд. 3,2). Те же химические процессы, вероятно, протекают при кислотной модификации NADH (гл. 8, разд. 3;7, б). Таутомерное превращение шиффова основания генерирует двойную связь углерод — углерод с енольной структурой. На третьей стадии енол таутомеризуется в более устойчивый кетон. Декарбоксилирование и замыкание кольца (реакции з, и и к) приводят далее к образованию индолглицерофосфата.
Реакция ß-замещения, катализируемая пиридоксальфосфатзависимой триптофансинтетазой, превращает индолглицерофосфат и серин в триптофан. Триптофансинтетаза Е. coli состоит из двух видов субъединиц, ассоциированных в а2β2-тетрамер. ß-Субъединица содержит пиридоксальфосфат и, по-видимому, образует за счет серина шиффово основание аминоакриловой кислоты, как показано на рис. 14-18. Эта субъединица способна катализировать присоединение к шиффову основанию свободного индола, приводящее к образованию триптофана. В то же время а-субъединица способна катализироивать расщепление (по существу — альдольную деконденсацию) индолглицерофосфата на глицеральдегид-3-фосфат и свободный индол. Можно указать на две возможности: либо а-субъединица передает на ß-субъединицу свободный индол, прочно связанный с белком, либо комплекс сначала катализирует конденсацию с дегидратированным шиффовым основанием и уже затем происходит альдольное расщепление, как это показано на рис. 14-18.
Тогда как у Е. coli триптофансинтетаза состоит из двух различных субъединиц, у нейроспоры фермент образован единой полипептидиой цепью. Предполагают, что вначале существовало два отдельных гена этого фермента, как у Е. coli, но затем в ходе эволюции произошло их слияние в один ген. Уже после того как было сформулировано это предположение, слияние генов было продемонстрировано экспериментально на клетках Salmonella, у которых индуцировали две последовательные «мутации со сдвигом рамки» между двумя генами биосинтеза гистидина (гл. 15, разд. Г). Из-за сдвига рамки считывания сигнал к окончанию синтеза белка считывается неправильно, и организм синтезирует одну длинную белковую цепь, соответствующую двум генам. Поскольку известен ряд случаев, когда один и тот же белок проявляет два четко различающихся вида активности, можно предположить, что слияние генов может представлять собой обычное природное явление [111а]. Примерами служат аспартокиназа-гомосериндегидрогеназа Е. coli, катализирующая реакции а и в, показанные на рис. 14-6, а также антранилатсинтетаза в клетках нейроспоры. Последняя, характеризующаяся структурой а2ß2, содержит трифункциональную субъединицу, которая катализирует стадию г (фосфорибозилантранилат-изомераза) и стадии д — к (индолглицерофосфат-синтетаза) на рис. 14-18 и имеет глутаминсвязывающий центр, необходимый для антранилатсинтетазной активности (стадия б) [109]. Два других бифункциональных ферменту упоминались при обсуждении превращения хоризмата в фенилаланин: и тирозин.