Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Трансляция генетической информации. Синтез белка
Синтез белка
Образование полипептидных связей на рибосомах обычно подразделяют на три процесса; инициацию, элонгацию и терминацию [98]. Синтез белка начинается с инициирующего кодона; чаще всего им является кодон метионина AUG. Кодон GUG, расположенный надлежащим образом в цепи мРНК, также может служить инициирующим кодоном. В этом случае он детерминирует метионин, а не валин. Для распознавания «стартового» сигнала важную роль может играть также последовательность оснований, предшествующая инициирующему кодону. На это указывает тот факт, что кодоны AUG и GUG встречаются не только в точках инициации.
а. Инициация [99]
В случае бактерий пептидные цепи всегда начинаются аминокислотой N-формилметионином. Таким образом, первый этап в синтезе белка состоит в выстраивании инициирующего кодона в требуемом месте на рибосоме и в связывании с ним молекулы тРНК, «нагруженной» N-формилметионином1) 2. Этот процесс сравнительно сложен. Отчасти это связано с тем, что рибосомы должны выбрать истинный инициирующий кодон из многих кодонов AUG и GUG, содержащихся в середине цепи мРНК. Это достигается, по-видимому, за счет спаривания оснований ACCUCCU, расположенных на 3'-конце 16S-рибосомной РНК, и комплементарной инициирующей последовательности в мРНК (рис. 15-14) [100, 101]. Для такого связывания нужен также рибосомный белок S1 (известный также под названием і-фактора). Считают, что его функция состоит в удерживании 3'-конца 16S-PHK, находящейся в «открытой» конформации, а не в виде Шпильки [102].
Кроме рибосомных белков существуют еще три необходимых для инициации белка, известных под названием факторов инициации: IF-1, 1F-2 и 1F-3. Последний существует по меньшей мере в двух формах: IF-За и IF-3ß. Роль фактора инициации IF-3 состоит, по-видимому, в образовании инициационного комплекса мРНК—16S-PHK (рис. 15-15, стадия а) и в его стабилизации. На этой стадии «нагруженная» молекула формилметионил-тРНК (fMet-тРНК) связывается со вторым фактором инициации IF-2, котoрый до этого уже связался с молекулой GTP (стадия б)2). Далее этот комплекс связывается с 30S-субчастицей предположительно таким образом, что антикодон тРНК комплементарно «спаривается» со стартовым кодоном мРНК (рис. 15-5, стадия в). Связыванию IF-2 комплекса каким-то образом помогает третий инициирующий фактор IF-1, роль которого до конца не выяснена. Теперь IF-3 покидает комплекс (стадия г) и происходит присоединение рибосомной 50S-субчастицы с образованием целой рибосомы, после чего IF-1 отщепляется (стадия д).
1) Это связывание сопровождается побочным эффектом: сдвигом равновесия между 30S- и 50S-субъедииицами и интактными 70S-рибосомами в сторону усиления диссоциации [91].
2) Некоторые исследователи считают, что комплекс fMet-тРНК—IF-2 свизывается с рибосомной 30S-субчастицей раньше, чем нРНК [103].
В вопросе о том, что происходит на самом деле при этих реакциях, еще очень много неясного, однако сейчас можно считать твердо установленным, что «нагруженная» молекула метионил-тРНК действительно связывается, как это показано на рис. 15-5, с так называемым P-участком (пептидильный участок) рибосомной 50S-субчастицы. Согласно более раннему предположению, которое и сейчас нельзя считать до конца опровергнутым, начальное связывание происходит в «A-участке» (аминоацильный участок), а уже в дальнейшем происходит транслокация на P-участок. Основанием для такого предположения послужило то обстоятельство, что на последней стадии инициации (рис. 15-15, стадия е), на которой IF-2 освобождается в комплексе с GDP, происходит гидролиз GTP. Из данных, которые будут рассмотрены в следующем разделе, следует, что гидролиз GTP необходим для транслокации в процессе роста (элонгации) пептидной цепи.

РИС. 15-14. Предполагаемая схема расположения водородных связей между фрагментом 16S-PHK и участком инициации А-белка в РНК фага R17. Предполагается, что вторичная структура изображенного на этой схеме фрагмента 16S-РЙК при физиологических условиях стабильна. На рисунке не показана другая схема расположения водородных связей, соответствующая столь же стабильному комплексу оснований, выступающая петля которой увеличивается до 9 оснований, а четверка оснований CCUU, расположенная на 3'-конце, спаривается с AAGG на 5'-конце нижней части стебля [101].
О том. что гидролиз GTP действительно необходим для процесса инициации, свидетельствует тот факт, что на начальной стадии связывания вместо GTP можно использовать 5'-гуанилметилендифосфонат (аналог GTP, в котором центральный и последний атомы фосфора соединены метиленовым мостиком). Этот аналог может заменять GTP на всех начальных стадиях процесса инициации вплоть до связывания с 50S-рибосомой, но не способен функционировать на последнем этапе, поскольку он не гидролизуется. Значение гидролиза GTP до настоящего времени точно не установлено. Не исключено, что он служит источником энергии, необходимой для перегруппировки составных частей рибосомы (о чем уже шла речь выше), или нужен просто для освобождения комплекса IF-2—GDP (если, например, комплекс IF-2—GTP связан прочно, а комплекс IF-2—GDP — слабо).
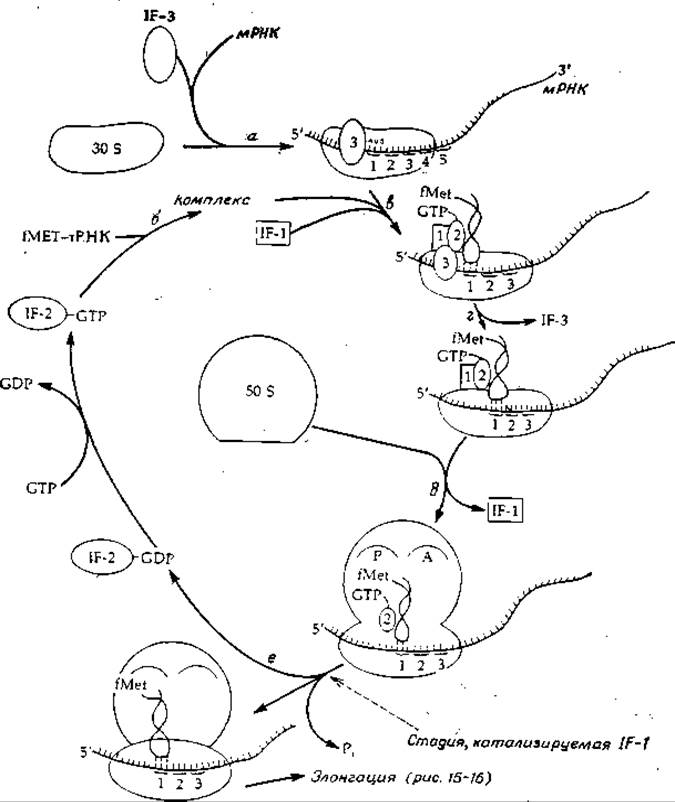
РИС. 15-15. Инициация синтеза белка в рибосомах бактерий.
Очевидно, что оба эти предположения о возможном значении гидролиза GTP не исключают друг друга.
Некоторую информацию о пространственном расположении рибосомных белков, участвующих в инициации, можно получить на основании того, что антитела к белкам S19 и S21 блокируют образование инициирующего комплекса с fMet-тРНК. Известно также, что антитела к белкам S2, S18 и S20 блокируют связывание фактора IF-3. Эксперименты с использованием агентов, образующих поперечные мостики, показали, что IF-2 и S19 расположены близко друг к другу, a IF-3 находится рядом с S12.
б. Элонгация пептидных цепей [104]
После того как инициирующий комплекс f'Met-тРНК занял свое место на P-участке, может начаться рост пептидной цепи, в процессе которого аминокислотные остатки поочередно присоединяются к С-концу растущей полипептидной цепи. Элонгация протекает в три следующих этапа, которые повторяются вновь и вновь до тех пор, пока не закончится образование всего полипептида:
1. Кодонспецифическое связывание молекулы тРНК, «нагруженной» очередной аминокислотой, с А-участком.
2. Образование пептидной связи. На этом этапе тРНК, находящаяся в P-участке, освобождается и вместе с растущей пептидной цепью переносится в А-участок.
3. «Транслокация» пептидил-тРНК с A-участка на P-участок. На этом этапе также происходит освобождение использозванной тРНК с P-участка и перемещение мРНК, в результате которого очередной кодон попадает в A-участок. Энергия, необходимая для процесса транслокации, образуется за счет гидролиза одной молекулы GTP.

РИС. 15-16. Элонгация растущей пептидной цепи.
Первый из этих трех этапов, а именно связывание аминоацил-тРНК с A-участком, зависит от фактора элонгации Т, или EF-T, имеющего белковую природу. Этот фактор представляет собой смешанный димер Ts∙Tu, один из компонентов которого Ts — стабильный белок с мол. весом ~42 000. Другой компонент Tu — белок, связанный с мембраной [104а]; его мол. вес равен приблизительно 44 000, а содержание в EF-T в несколько раз превосходит содержание Ts. Белок Tu образует комплекс с GTP и с молекулами аминоацил-тРНК (но плохо связывает fMet-тРНК). Как показано на рис. 15-16, при взаимодействии GTP с комплексом Ts∙Tu освобождается белок Ts и образуется комплекс GTP-Tu (стадия а), который затем связывается с аминоацил-тРНК и с рибосомой (стадии б и в). Эти реакции происходят в пептидилтрансферазном центре на 50S-субъединице, в участке, в состав которого входят белки L7 и L12.
На следующей стадии (стадия г) пептидная цепь переносится к -аминогруппе аминоацил-тРНК, занимающей A-участок, путем простой реакции замещения. Однако на деле эта реакция протекает сложнее, чем это показано на рисунке. Она сопровождается расщеплением связанного GTP и освобождением Pi и комплекса Tu—GTP. Последний, как показано на рисунке, взаимодействует с Ts; при этом вновь образуется димер Tu∙Ts и освобождается GDP. Таким образом, суммарная реакция состоит в расщеплении GTP, сопряженном с синтезом пептидной связи. Химия реакции не требует гидролиза GTP. Мы, однако, не знаем, насколько близко друг к другу располагаются концы двух соседних молекул тРНК. Расстояние между ними может быть достаточно большим. Белки L7 и L12 содержат необычайно много аланина и характеризуются высоким относительным содержанием а-спиральных участков. В этом отношении они напоминают мышечный белок миозин. В связи с этим было высказано предположение, что эти белки служат частью «мини-мышцы», которая, используя энергию, освобождающуюся при гидролизе GTP, перемещает определенные участки рибосомного комплекса, сближая между собой аминогруппу и пептидильную группу в пептидилтрансферазной реакции.
Интересным с химической точки зрения и вместе с тем трудным представлялся вопрос о том, какая из гидроксильных групп, (2'- или 3'-) концевого остатка аденозина тРНК несет активированную аминоацильную или пептидильную группу. В настоящее время считается, что между этими группами через ортоэфир (тетраэдрический аддукт) может быстро устанавливаться равновесие [уравнение (15-7)].
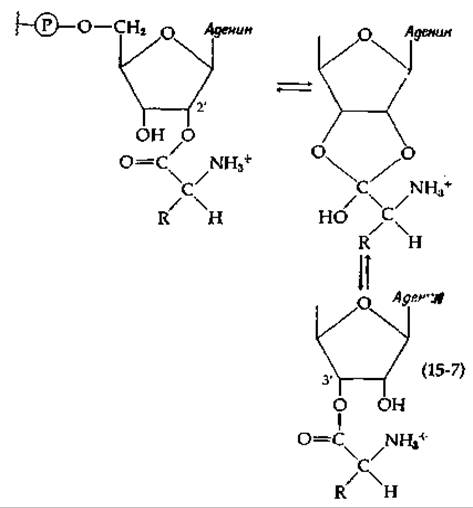
Модифицированный комплекс фенилаланил — тРНК дрожжей, оканчивающийся 3'-дезоксиаденозином, присоединяет аминогруппу при помощи фермента, активирующего аминокислоту (аминоацил-тРНК—синтетазы) [уравнение (11-2)], в то время как фенилаланин-тРНК, оканчивающаяся 2,-дезоксиаденозином, в реакцию не вступает. Это дает основание думать, что местом исходного аминоацилирования служит 2'-гидроксильная группа. Вместе с тем изучением способности синтетической 2'-фенилаланил — тРНК, оканчивающейся 3'-дезоксиаденозином, играть роль акцептора пептида в пептидилтрансферазной реакции на рибосомах было установлено, что она не активна в этой реакции. Активным оказался 3'-фенилаланилдезоксиизомер [105]. Таким образом, аминоацилирование скорее всего исходно осуществляется в 2'-положении, а затем перед транспептидазной реакцией происходит изомеризация [уравнение (15-7)] с образованием 3'-аминоацил-тРНК- Однако в результате более поздних исследований было показано, что как у пекарских дрожжей, так и у Е. coli одни тРНК исходно аминоацилируются по 2'-гидроксильным группам, другие — по 3'-гидроксильным группам [106, 107].
Третья стадия элонгации полипептидной цепи на рибосомах зависит от другого «фактора элонгации», а именно от EF-G, который обладает «GТРазной» активностью. Имеются данные о том, что фактор G также связывается с рибосомными белками L7 и L12 или в непосредственной близости от них и конкурирует за местоположение с EF-Tu. Роль фактора EF-G так же, как и фактора EF-T, не ясна, однако известно, что для осуществления реакции транслокации необходим гидролиз GTP, а использованная тРНК не может отделиться от P-участка до тех пор, пока не свяжется с EF-G.
Были обнаружены мутанты по генам, кодирующим факторы EF-Tu, EF-Ts и EF-G, что может облегчить изучение in vivo роли этих белков (аналогичные мутанты для факторов инициации IF-1, IF-2 и IF-3 еще не получены).
в. Терминация синтеза полипептида [108]
Рибосомы надежно осуществляют трансляцию генетической информации, присоединяя аминокислоты к пептидной цепи до тех пор, пока не будет достигнут стоп-кодон. После этого начинает действовать фактор терминации, который, по-видимому, связывается непосредственно со стоп-кодоном и с мРНК. Согласно имеющимся данным, у Е. coli фактор терминации RF-1, белок с мол. весом ~ 44 000, распознает кодоны UAA и UAG, тогда как фактор RF-2 (мол. вес ~47 000) может распознавать UAA или UGA. В клетке насчитывается несколько сотен молекул этих факторов терминации. Каким-то образом фактор терминации не просто должен распознавать правильный кодон, но должен еще и катализировать гидролитическое отщепление пептидной цепи от тРНК. После того как была расшифрована значительная часть нуклеотидной последовательности молекул вирусных мРНК» неожиданно обнаружилось, что гены, кодирующие белки оболочки РНК-содержащих фагов (рис. 15-19), иногда оканчиваются двумя следующими один за другим стоп-кодонами. Очевидно, этим обеспечивается надежность прекращения трансляции даже в том случае, когда один из стоп-кодонов утерян. Заметим, что на конце і-гена lас-оперона Е. coli наряду с показанным на рис. 15-4 кодоном TGA имеется второй стоп-кодон, расположенный на пять кодонов правее. В настоящее время не ясно, насколько общий характер носит удвоение стоп-кодонов на концах генов.
г. Полирибосомы
При определенных условиях выделенные из клеток рибосомы осаждаются в виде кластеров (полирибосом), состоящих из шести или большего числа рибосом. Можно показать, что в этих полирибосомах (или полисомах) рибосомы соединены друг с другом цепью мРНК. Сейчас принято считать, что образование полирибосом связано с тем, что одна молекула мРНК транслируется одновременно несколькими рибосомами. Как только 5'-конец мРНК покидает рибосому, он может сразу же связаться с другой рибосомой, инициируя трансляцию следующей пептидной цепи и т. д. Количество рибосом, объединяемых в полирибосому, определяется длиной мРНК.
д. Синтез белка в эукариотических клетках
Между синтезом белка в бактериальной и эукариотической клетках много общего. В случае эукариот роль инициаторной тРНК играет специальная метионил-тРНК (Met-тРНКг). (Индекс указывает на то, что эта тРНК может быть формилирована ферментной системой бактерий. Однако в эукариотической клетке данная метионил-тРНК остается без формильной группы.) Так же как и у бактерий, включение метионина во внутренние положения белка осуществляется при помощи другой транспортной РНК (Met-тРНКм). Для синтеза белка в эукариотических клетках необходимы по меньшей мере три фактора инициации: eIF-1—eIF-3 [109]. Существенное отличие от прокариотических систем состоит в том, что в эукариотической клетке сначала с рибосомой связывается инициаторная аминоацил-тРНК и только после этого мРНК. Для распознавания eIF-3 на 5'-конце мРНК в случае эукариот может требоваться наличие «колпачка», содержащего 7-метилгуанозин [109а]. В эукариотических клетках содержатся также факторы элонгации [110] EF-1 и EF-2 и лишь один фактор терминации, а не два, как у бактерий.
е. Спаривание кодона с антикодоном
Теперь мы вновь возвратимся к фундаментальной проблеме: как обеспечивается попадание нужной аминокислоты в нужный момент в рибосому в процессе синтеза полипептидной цепи. Этот процесс основан на правильном «узнавании» антикодоном тРНК комплементарного кодона в мРНК. Неожиданным явилось наличие инозина (I) в антикодонах тРНК дрожжей (но не в большинстве тРНК Е. coli). Неожиданным было также и то, что в одной клетке находится меньше 61 типа молекул тРНК (61 = 64—3 стоп-кодон). Основываясь на этих фактах, Крик сформулировал в 1966 г. так называемую wobble-гипотезу (гипотезу неоднозначного соответствия, или гипотезу «качаний») [111]. Согласно этой гипотезе, первые два основания на 5'-конце кодона (и на 3'-конце антикодона) должны спариваться по тем же законам, что и основания в ДНК. Что же касается третьей пары оснований (3'-конец кодона и 5'-конец антикодона), то для нее стерические ограничения не столь жестки, т. е. в этом случае возможны некоторые отклонения от точной комплементарности. Крик предложил следующее «правило» для спаривания третьего основания:

Исходя из гипотезы, можно объяснить все наблюдаемые отклонения от образования классических пар оснований (AU, CG) в спирали Уотсона—Крика. Так, антикодон с G на 5'-конце может спариваться с кодонами, оканчивающимися С или U. Антикодоны, оканчивающиеся С или А, будут спариваться точно. Антикодоны, оканчивающиеся U, могут образовывать пары с кодонами, у которых в 3'-положении находится А или G. Антикодоны с I в 5'-положении могут узнавать кодоны
с любым из этих трех оснований в третьем положении. Сопоставляя все эти соображения с данными, приведенными в табл. 15-2, можно сразу понять, почему одной клетке может оказаться достаточно меньше 61 антикодона. Одной и той же аминокислоте соответствует несколько кодонов, и часто природа основания, находящегося в 3'-положении, не играет роли для значения кодона. Благодаря этому в природе существует определенная экономия, которая состоит в использовании не всех, а только части антикодонов. Крик показал, что с химической точки зрения его предположение возможно, если даже допустить, что пространственные соотношения между основаниями при «неоднозначном» спаривании отличаются от классического уотсон-криковского-спаривания. Это проиллюстрировано на рис. 15-17, где показано связывание инозина с С (обычная пара оснований по Уотсону — Крику), а также с А и U. Термин wobble (качать, колебаться) не очень хорошо отражает сущность гипотезы, однако сама гипотеза позволила сделать ряд правильных предсказаний. Так, например, в соответствии с этой, гипотезой для распознавания шести кодонов серина достаточно всего лишь трех тРНК. И действительно, у Е. coli было обнаружено три тРНК для серина.
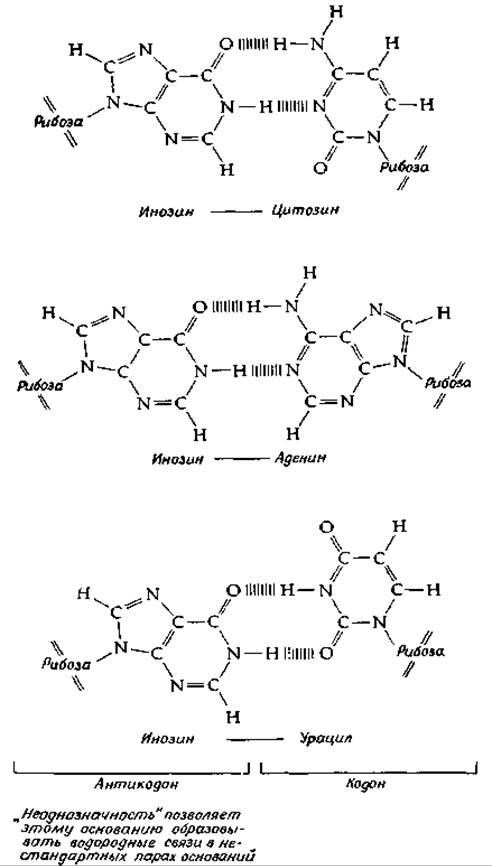
РИС. 15-17. Спаривание инозина с цитозином (спаривание по Уотсону — Крику) и инозина с урацилом (неоднозначные пары) (Уотсон Дж. Молекулярная биология гена, М., Мир, 1978).
ж. Аминоацил-тРНК-синтетазы [112]
Важное значение для синтеза белка имеет также другой процесс, связанный с узнаванием. Это осуществляемый аминоацил-тРНК—синтетазой выбор нужной аминокислоты и ее перенос в активированной форме на соответствующую тРНК [уравнение (11-2)]. У бактерий для каждой из 20 аминокислот имеется одна аминоацил-тРНК—синтетаза. Каждая такая синтетаза должна выбирать специфичную аминокислоту и соответствующую ей тРНК; тот же самый фермент может переносить аминокислоту на все изоакцепторные тРНК, специфичные для данной аминокислоты.
Было предпринято много попыток с целью определить, какая именно часть (или части) молекул тРНК принимает участие в их распознавании синтетазой. С этой целью были сопоставлены нуклеотидные последовательности в изоакцепторных тРНК и проведены исследования химически модифицированных и фрагментированных молекул тРНК. Был использован также целый ряд других подходов. Результаты всех этих исследований позволили предположить, что не существует универсального метода узнавания. В ряде случаев, когда строение антикодона было нарушено, синтетаза не присоединяла аминокислоты к химически модифицированной тРНК. Это примечательный факт, поскольку, как показали опыты с кристаллическими тРНК, кодон отстоит примерно на 7,5 нм от CCA-конца тРНК (рис. 2-24). Несмотря на то что синтетазы являются крупными ферментами (мол. вес большинства из них равен приблизительно 100 000), все же трудно понять, как может происходить точное узнавание антикодона без того, чтобы молекулы тРНК не подвергались значительным конформационным изменениям, сближающим антикодон с CCA-концом тРНК. У некоторых тРНК антикодон не участвует в узнавании. Так, например, в случае Phe-тРНК дрожжей было доказано, что решающее значение в узнавании играют остатки, расположенные в стебле дигидроуридиновой петли и в верхней части акцепторного стебля [112].
Рич обратил внимание на то, что одна из сторон молекулы тРНК в ее нормальной конфигурации имеет относительно постоянное строение, и предположил, что эта часть предназначена для взаимодействия с какой-то частью рибосомной системы. Строение другой стороны молекулы тРНК (рис. 2-24), включающей дигидроуридиновую петлю и акцепторный стебель, значительно более вариабельно. Возможно, что местом связывания аминоацил-тРНК — синтетаз служит именно эта часть. Высказывалось также предположение, согласно которому аминоацилирование и связывание с рибосомами могут сопровождаться изменениями конформации в одном или в нескольких местах молекулы тРНК [113]. Возможно, что петля TψCG, недоступная в нативной тРНК, открывается и взаимодействует с 5S-PHK в рибосоме. Короткое плечо этой структуры может качаться относительно конца более длинного плеча, несущего антикодон. Наиболее эффективным методом обнаружения конформационных изменений является метод протонного магнитного резонанса (ПМР) (гл. 2, разд. 3,7), позволяющий получить сигналы непосредственно от каждого протона молекулы тРНК, участвующего в образовании внутримолекулярной водородной связи [114].
Выбор соответствующей аминокислоты аминоацил-тРНК—синтетазой имеет чрезвычайно важное значение. Однако трудно представить себе активный центр, способный четко различать структуру двух таких похожих соединений, как изолейцин и валин. Одним из путей точного выбора аминокислоты мог бы служить кинетический механизм «корректирования», аналогичный тому, который был описан для ДНК-полимеразы I (разд. Д, 4). Действительно, было показано, что валин, ошибочно присоединенный к изолейциновой тРНК, подвергался под действием синтетазы быстрому гидролизу [114а], значительно уменьшая вероятность включения валина в белок в неправильном положении.
з. Действие антибиотиков на рибосомы
В основе действия мнoгих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальными 705-рибосомами, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток.
Список антибиотиков, действующих на уровне рибосом, весьма велик [115, 116]. Он включает, в частности, соединения, сыгравшие важную роль при выяснении механизма синтеза белка. Хотя аминогликозидный антибиотик стрептомицин (дополнение 12-А), неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. Так, например, если использовать в качестве информационной РНК поли(ІІ), то вместо обычного полифенилаланина образуется продукт, содержащий 40% изслсицина.
Подвергнув популяцию бактерий действию антибиотиков, можно отобрать мутанты, способные расти в присутствии соответствующего антибиотика. Этим путем были получены, в частности, мутанты Е. coli, устойчивые к стрептомицину (однако следует сказать, что частота их появления была очень низкой: примерно 10-12). Было установлено, что измененный ген (rpsL или strA) расположен на генетической карте в области, соответствующей 72 мин1). В дальнейшем было показано, что стрептомицин связывается с рибосомным белком S12, a rpsL — ген этого белка. Среди устойчивых к стрептомицину бактерий можно отобрать мутанты, ставшие зависимыми от этого антибиотика и не способные расти в его отсутствие. Было показано, что такая зависимость от стрептомицина возникает в результате изменений рибосомного белка S4. Из этих экспериментов отчетливо видно, что для существенного изменения чувствительности живого организма к определенному токсину или даже для того, чтобы организм сделался зависящим от этого токсина, оказывается достаточно единичной точковой мутации, изменяющей всего лишь одну аминокислоту.
Как следует из анализа резистентных мутантов, антибиотик спектиномицин связывается с белком S5. Положение гена spcA картировано на 64-й минуте, в связи с чем считают, что в этом участке хромосомы Е. coli расположен оперон рибосомного белка. Казугамицин ингибирует связывание fMet-тРНК (инициацию). В этом случае появляются резистентные мутанты, у которых модифицирована не белковая субъединица, a 16S-PHK; у мутантных штаммов 16S-PHK метилирована в меньшей степени, чем у нормальных.
Вкратце можно упомянуть еще некоторые другие антибиотики. Тетрациклины (рис. 12-10) ингибируют связывание аминоацил-тРНК с A-участком 30S-субчастицы рибосом. Линкомицин, спарсомицин и хлорамфеникол (рис. 14-25) ингибируют образование пептидной связи и действуют на 50S-субчастицу. Хлорамфеникол вызывает также накопление соединения ppGpp (разд. В,2,к). Действие полипептидных антибиотиков — тиострептона, бриамицина и сиомицина— связано с влиянием на факторы G и Tu. Эритромицин (рис. 12-10), а также другие макролидные антибиотики, циклогексимид (рис. 12-10) и фузидиевая кислота (гл. 12, разд. И, 4) блокируют транслокацию. Фузидиевая кислота, кроме того, ингибирует накопление ppGpp. Пуромицин (рис. 15-18) связывается с 50S-субчастицей и вызывает преждевременную терминацию синтеза полипептидной цепи. Достаточно взглянуть на его формулу, чтобы понять, каким образом осуществляется это его действие. По своему строению пуромицин вплоть до тончайших деталей напоминает 3'-конец молекулы тРНК, нагруженной аминоацильной группой, с той лишь разницей, что у пуромицина нет аминоацильиой группы, и как только растущая полипептидная цепь переносится на него, дальнейшее удлинение становится невозможным.
1) В этом же положении обнаруживаются гены, ответственные за синтез рибосомного белка S7 и факторов элонгации EF-G и EF-Tu. Считают, что все они являются частями одной и той же транскрипционной единицы [116а].
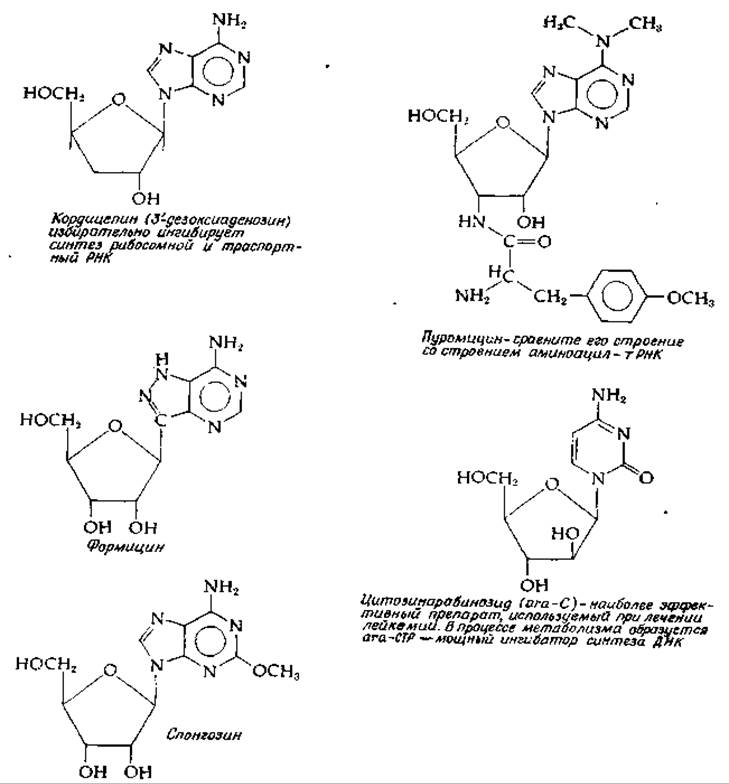
РИС. 15-18. Строение некоторых ингибиторных аналогов нуклеозидов, встречающихся в нуклеиновых кислотах (Suhadolnik R. J., «Nucleosid Antibiotics» Wiley-Interscience, New York, 1970, and R. Meyers, V. A. Malathi, R. P. Cox, S. Siler, JBC 248, 5909—5913, 1973).
и. Изучение нуклеотидных последовательностей в мРНК
Лишь в недавнее время удалось установить нуклеотидные последовательности фрагментов молекул мРНК и непосредственно изучить закодированную в них информацию. Удобным источником молекул мРНК.
несущих только одну информацию, служат РНК-содержащие бактериофаги [117]. Генетическая информация для этих вирусов, переносится молекулами РНК, построенными всего лишь из 3500—4500 нуклеотидов и содержащими только три гена (дополнение 4-Г). Довольно подробно были исследованы РНК фагов f2, R17, MS2 и более далекого им фага Qß. Были полностью установлены аминокислотные последовательности в некоторых белках, кодируемых этими молекулами РНК, а также полная нуклеотидная последовательность одной из молекул вирусной РНК [118].
Удобный метод для идентификации начала гена предложила Стейц [119]. Сущность этого метода состоит в следующем. Выделенные рибосомы Е. coli ингибируют в условиях, при которых они связываются с мРНК, образуя инициаторный комплекс (рис. 15-15). В отсутствие дополнительных аминокислот н молекул тРНК инициаторный комплекс сохраняет стабильность. Если обработать этот комплекс панкреатической или Т1-РНКазой, то большая часть РНК окажется гидролизованной, однако один из участков будет защищен рибосомой, с которой он связан. Установлено, что защищенный участок РНК фага Qß имеет следующую последовательность:
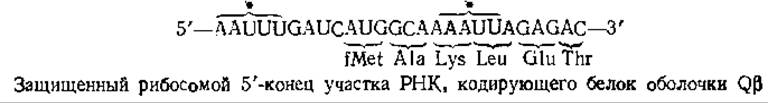
Заметим, что в состав защищенного участка входит инициирующий кодон AUG и что последовательности расположенных вслед за ним кодонов в точности соответствуют известной последовательности аминокислот N-конца вирусного белка оболочки. Еще одна интересная особенность этой последовательности состоит в том, что два участка, обозначенные фигурными скобками со звездочками, могут спариваться друг с другом. В результате инициирующий кодон может образовывать петлю (шпильку). Такие шпильки в инициаторных участках РНК образуются не всегда, однако они встречаются достаточно часто.
Если пройти несколько дальше влево по нуклеотидной последовательности фага Qß, то можно встретить группу из четырех нуклеотидов, которая может связываться с 16S-PHK так же, как это показано на рис. 15-14 для инициаторного участка А-белка в РНК фага R17. Аналогичные защищенные рибосомами инициаторные последовательности были обнаружены в молекулах многих вирусных РНК, а также в молекулах некоторых специфических мРНК [101, 102].
Для РНК фага MS2 была установлена полная последовательность всех 3569 нуклеотидов [118]. Некоторые участки этой последовательности показаны на рис. 15-19. 5'-конец (средняя часть структуры, изображенной в верхнем левом углу) все еще несет трифосфатную группу инициаторного GTP. После ряда шпилек следует защищенный рибосомой участок [119а], который начинается инициаторным кодоном GUG. Этот факт служит прямым доводом в пользу того, что GUG, так же как и AUG, играет роль биологически важного инициаторного кодона. Нуклеотидная последовательность, расположенная вслед за инициаторным кодоном, в точности кодирует почти полностью установленную аминокислотную последовательность вирусного белка. Терминирующий кодон UAG обведен на рисунке рамкой. Вслед за ним расположена короткая межгенная область, включающая одну сторону шпильки, на конце которой расположен инициаторный кодон AUG для следующего гена. Далее расположена последовательность нуклеотидов, точно соответствующая экспериментально установленной последовательности аминокислот N-конца белка оболочки [120]. Другой интересной особенностью приведенной последовательности является наличие в ней терминирующего кодона UGA (обведен рамкой), который располагается сразу же вслед за началом гена, кодирующего белок оболочки (положение 1390). Этот терминирующий сигнал находится вне фазы инициирующего кодона AUG, и, следовательно, он не может служить терминационной точкой гена белковой оболочки. В то же время он находится в одной фазе с кодоном UAG — терминирующим кодоном А-белка. В присутствии различных amber-сулрессорных генов клетки-хозяина (разд. Г, 5 и Г, 6) полипептидная цепь А-белка удлиняется и ее синтез заканчивается этим UGA-сигналом.
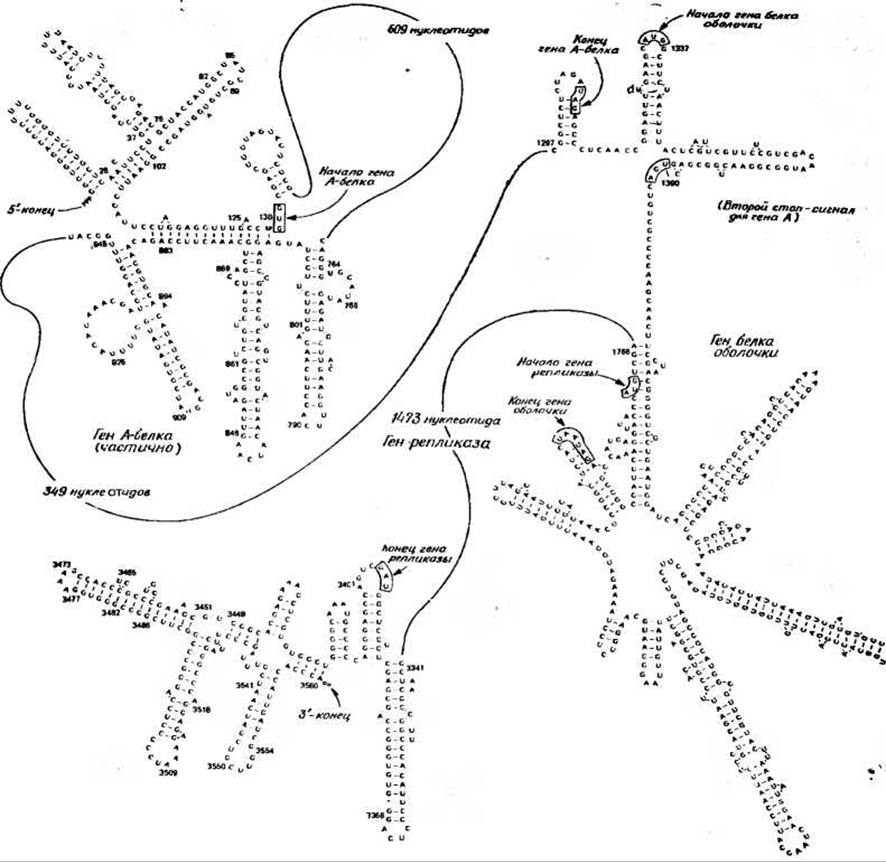
РИС. 15-19. Отдельные участки нуклеотидной последовательности РНК бактериофага MS2 и схематическое изображение их вторичной структуры. Инициирующие и терминирующие кодоны каждого из трех генов, кодирующих А-белок, белок оболочки и репликазу, а также второй стоп-сигнал, находящийся в фазе с геном, кодирующим А-белок, но не с геном, кодирующим белок оболочки, взяты в рамки. Показан весь ген, кодирующий белок оболочки, однако последовательность нуклеотидов приведена менее чем для одной его трети [118, 119а, 120].
Ген оболочки, содержащий всего лишь 390 нуклеотидов, показан полностью. Предложенная модель вторичной его структуры наламинает цветок [120]. Ген заканчивается двойным стоп-сигналом UAAUAG. Далее следует межгенная последовательность из 36 нуклеотидов, после которой кодоном AUG начинается очень длинный ген ренликазы. Этот ген заканчивается 3395-м нуклеотидом, после которого со стороны 3'-конца следует нетранслируемый участок из 174 нуклеотидов.
Другим интересным примером использования рибосом для защиты нуклеиновой кислоты от ферментативного гидролиза могут служить опыты с одноцепочечной ДНК бактериофага —Х174 [121]. В этом случае рибосомы защищали последовательность нуклеотидов, в состав которой входил инициаторный кодон ATG. Этот кодон и следующие за ним семь других кодонов соответствовали известной N-концевой аминокислотной последовательности детерминируемого геном G белка шипов этого бактериофага.
Дополнение 15-Г
Репликация РНК-содержащих бактериофагов
Мелкие икосаэдральные РНК-содержащие бактериофаги представляют интерес в связи с тем, что они содержат небольшое количество генов — обстоятельство, дающее возможность детально разобраться в механизмах их репликацииа,б. В настоящее время полностью расшифрована последовательность 3569 нуклеотидов в РНК фага MS2 (рис. 15-19). Три гена этого фага кодируют белок А (белок созревания фага), белок оболочки и субъединицу репликазы. В зрелой вирусной частице содержится одна молекула белка А. Этот белок необходим для правильной инкапсуляции РНК и для связывания фага с пилями клетки-хозяина. Молекула РНК окружена оболочкой, построенной примерно из 180 молекул белка. Репликаза необходима для удвоения молекул РНК. Несколько более сложно устроен фаг Qß; его РНК имеет длину 4,5kb; причем наряду с белком созревания, который называется белком А2, он содержит также несколько молекул четвертого белка А1. Белок A1 необычен в том отношении, что на его N-конце имеется та же последовательность 130 аминокислот, что и в белке оболочки. Синтез белка оболочки терминируется стоп-кодоном UGA. Однако даже в клетках Е. coli дикого типа имеется небольшое число UGA-специфической супрессорной тРНК, благодаря которой трансляция может продолжаться, охватывая приблизительно еще 270 остатков, пока не достигнет двойного стоп-сигнала UGAUAA, который и вызывает терминацию цепи. В результате образуется много белка оболочки и мало белка А2.
Репликаза фага Qß исследована довольно детально. Для образования полного репликазного комплекса кроме субъединицы, детерминируемой геномом фага, нужны еще три бактериальных белка. Это рибосомный белок S1 и факторы элонгации EF-Tu и EF-Ts. Все эти три белка обычно участвуют в трансляции мРНК. Однако фаг использует их способность связываться с РНК совсем для другой цели.
Репликация одноцепочечного фага должна протекать в две стадии. Сначала на содержащейся в фаговой частице плюс-цепи образуется комплементарная минус-цепь. Для инициации этой стадии необходимы еще один бактериальный белок, а именно фактор HFб, и GTP. Образующиеся минус- цепи не остаются связанными с плюс-цепями. Они, по-видимому, освобождаются от репликазы в одноцепочечной форме и складываются, образуя высокоупорядоченные молекулы с большим числом шпилек. (Как и в случае плюс-цепей РНК фага MS2, показанных на рис. 15-19.) Далее минус-цепи копируются (фактор HF для этого не нужен), образуя большое число новых плюс-цепей, которые включаются в готовые фаговые частицы.
Репликаза фага Qß способна in vitro синтезировать цепи, полностью комплементарные как плюс-, так и минус-молекулам вирусной РНК. Система, однако, специфична для вирусной РНК и не может копировать никаких других полинуклеотидов. Возможно, что для инициации процесса репликации нужно, чтобы на 3'-конце имелись определенные последовательности. В пробирке репликация протекает с ошибками, такими, в частности, как преждевременная терминация цепи и неправильное спаривание оснований. В результате происходит образование мутантных форм РНК, что дает возможность получать молекулы РНК, размеры которой будут значительно меньше, чем у вирусной РНК, и которые будут при этом легко реплицироваться репликазной системой фага Qß. Была установлена нуклеотидная последовательность одного из таких фрагментов, включающего всего лишь 114 нуклеотидовв.
а Weissman С., FEBS, Letters, 40, SIO—S78 (1974).
б Senear A. W., Steitz J. A., JBC, 251, 1902—1912 (1976).
в Mills D. R., Kramer F. R., Dobkin C., Nishihara T., Spiegelman S., PNAS, 72, 4252—4256 (1975).
к. Другие функции рибосом
Рибосомы не только производят белки, но и активно участвуют в регуляторных механизмах, оказывающих влияние на всю клетку. Одно такое загадочное явление известно под названием «stringent» (строгого) ответа [122, 123]. Многие нуждающиеся в аминокислотах ауксотрофные мутанты Е. coli и других бактерий при недостатке в среде какой-нибудь незаменимой аминокислоты сразу же отвечают понижением синтеза рибосомной РНК, рибосомных белков, пуриновых нуклеозидтрифосфатов, липидов и других необходимых соединений, однако мутации гена rel (от англ. relaxed — ослабленный) приводят к тому, что рРНК продолжает синтезироваться даже в отсутствие требуемой аминокислоты (строгий ответ как бы «ослаблен»). Кроме этого и без того непонятного поведения было еще обнаружено, что в строгих штаммах (rel+) накапливаются гуанозинполифосфаты ppGpp и pppGpp (сначала их называли MS или соединения «magic spot»), тогда как в rel--штаммах этого не происходит. Концентрация ppGpp достигает при этом 1мМ. В настоящее время ясно, что гуанозинполифосфаты синтезируются на рибосомах путем переноса лирофосфорильной группы от АТР:
ATP + GDP (GTP) → ppGpp (pppGpp) + AMP. (15-8)
Для этой реакции необходим специальный stringent-фактор — рибосомный белок, состоящий из одной полипептидной цепи с мол. весом приблизительно 75000 [124]. Рибосомы при этом должны быть связаны с мРНК и содержать в A-участках отобранные кодоном ненагруженные тРНК.
Мутации гена rel аннулируют регуляторные эффекты, блокируя синтез гуанозинполифосфатов. Связывание же фузндиевой кислоты и тетрациклина имитирует эти мутации, способствуя продолжению синтеза рибосомной РНК в строгих штаммах при недостатке аминокислоты. Каким образом ppGpp и pppGpp действуют на синтез тРНК или рРНК, точно не установлено; вполне возможно, что этот процесс опосредован регуляцией транскрипции при участии сложной ферментной системы [125—127].
Неожиданно было обнаружено, что фосфатидилсерин-синтетаза Е. coli прочно связывается с рибосомами [128]. Этот фермент, обеспечивающий включение серина в фосфолипиды (стадия ж на рис. 12-8), ответствен за синтез основных липидных компонентов мембран Е. coli. Локализация этого важного фермента на рибосомах, возможно, каким-то образом связана с наличием общей регуляции синтеза белков и липидов.