Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Взаимодействия пептидов с клеточной мембраной
Строение фосфолипидного бислоя мембраны
Уже давно стало очевидным, что недостаточно рассматривать функции мембран живых клеток с точки зрения химических свойств компонентов, их составляющих, — требуется учитывать не только их физико-химические и электрохимические характеристики, но и пространственную организацию этих компонентов: асимметрию элементов и жидкокристаллическое состояние липидов. Липиды отличаются от трех других основных групп веществ, составляющих живые организмы (белки, углеводы, нуклеиновые кислоты), тем, что не растворяются в водных средах. Эти светло-желтые пастообразные вещества хорошо растворяются в “липидных растворителях” — хлороформе, диэтиловом эфире, бензоле. Классификация разделяет липиды на несколько групп, из которых в состав плазматических мембран входят фосфолипиды и стерины, тогда как триглицериды (жиры) располагаются, как правило, в межклеточном пространстве.
Фосфолипиды представляют собой сложные эфиры глицерина, имеющие, как правило, разные заместители при 1, 2 и 3 углеродных атомах, при этом в позициях 1 и 2 располагаются длинноцепные гидрофобные заместители — алкилы или алкенилы. А в позиции 3 через фосфорно-эфирную группу к липиду подсоединяются гидрофильные группы — холин, этаноламин, серин, глицерин, инозит и фосфорелированные формы инозита. Такая амфифильная природа фосфолипидов определяет их склонность к мицеллообразованию в водных растворах (критическая концентрация мицеллообразования — ККМ порядка 10-10 М) и термодинамически выгодную форму мицелл: двойной слой липидов, в котором полярные головки образуют две гидрофильные поверхности на расстоянии 75—80 Å друг от друга, экранируя гидрофобные области (Препаративная биохимия липидов, 1981; Лишко, Шевченко, 1987). На рис. 9 представлены основные элементы структур наиболее часто встречающихся фосфолипидов и схема формирования бислойной липидной мембраны с встроенной в нее полипептидной цепью (Deenen, 1981; Кагава, 1985).
В настоящее время в фосфолипидах из разных источников обнаружено более 40 вариантов полярных групп и порядка 200 вариантов сочетания гидрофобных цепей. В сформированных бислоях насыщенные углеводородные цепи находятся, как правило, в зигзагообразной конформации и параллельны друг другу. Ось первой ацильной цепи совпадает с осью глицеринового остатка; вторая ацильная цепь после изгиба на участке —СО—СН2— выстраивается параллельно первой цепи.
Полярные группы фосфолипидов, экспонированные в водное окружение, ориентированы в зависимости от знака заряда этих групп: отрицательно заряженные группы фосфатидилсерина направлены перпендикулярно к плоскости бислоя, положительно заряженные группы фосфатидилхолина и фосфатидилэтаноламина ориентированы параллельно поверхности липидного бислоя (Браун, Уолкен, 1982).
Фосфатидилхолин (лецитин) содержится в больших количествах в клетках высших организмов (30—60 % от общей суммы фосфолипидов), тогда как его содержание в мембранах бактерий не превышает 6%.
Исследования как природных, так и синтетических фосфолипидов показали, что константы ионизации ионогенных групп, составляющих полярную головку, располагаются в широком диапазоне от рКа = 2.72 (фосфатная группа) до рКа = 11.6 (холин) (Биологические мембраны, 1990; Тоmoaia-Cotisel, 1999). Холин является одним из самых сильных органических оснований, уступая по силе только боковой группе аргинина, так что полярная головка фосфатидилхолина (ФХ) имеет цвиттерионную структуру в широком диапазоне pH. Наоборот, фосфатидилсерин (ФС) несет две постоянно ионизированные кислотные группы. Таким образом, на обеих поверхностях липидной бислойной мембраны располагаются полярные группы, амфолитные свойства которых сравнимы с амфолитными свойствами аминокислот и пептидов. При этом, хотя углеводные цепи фосфолипидов, расположенные между двумя амфолитными поверхностями липидного бислоя, имеют чисто гидрофобную природу, вся структура оказывается достаточно проницаемой для молекул воды. Как искусственные, так и природные бислойные мембраны имеют проницаемость для воды порядка 2 мл/(см2∙с) (Кагава, 1985).
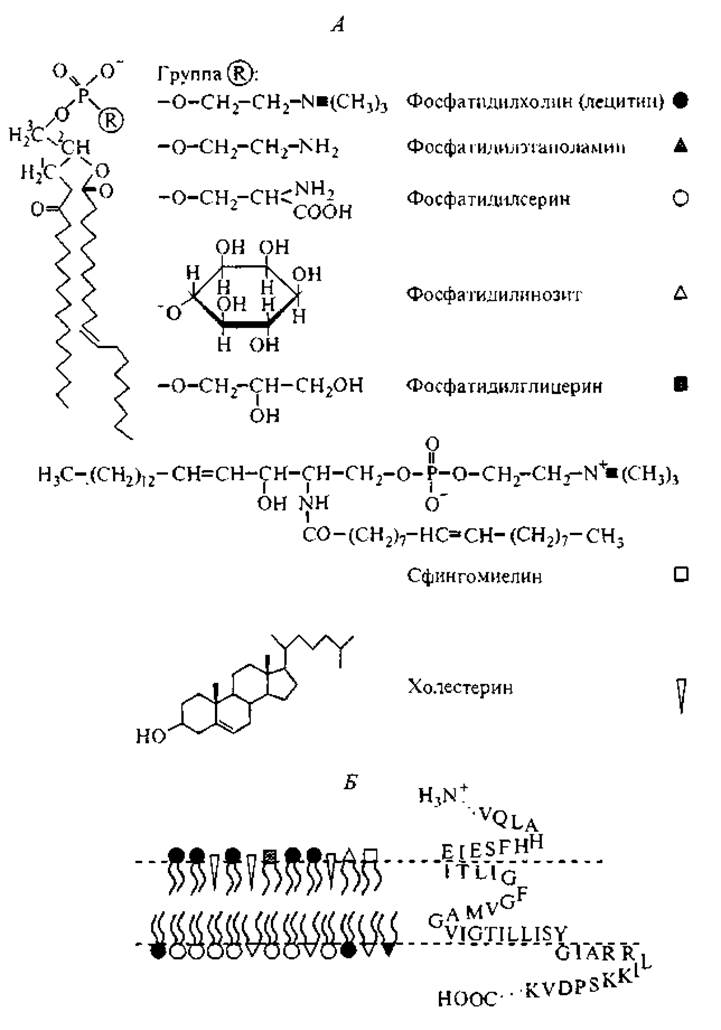
Рис. 9. Основные фосфолипиды, входящие в бислойные структуры плазматических мембран (А), и схема бислойной структуры липидов в мембране эритроцита (Б) с встроенной аминокислотной последовательностью участка цепи гликофорина (Препаративная биохимия липидов, 1981; Кагава, 1985; Лишко, Шевченко, 1987).
Ранее предполагалось, что свойства биологических мембран во многом определяются структурой именно липидного бислоя, так что общая замкнутая граница живой клетки подобна мыльному пузырю. За последние 20 лет в результате детального исследования строения и подвижности компонентов, входящих в состав биологических мембран, произошли существенные изменения в представлениях о структуре и функциях клеточной мембраны. Функциональное значение липидного бислоя оказалось значительно шире, чем значение гидрофобной перегородки между внутренним пространством клетки и внешней средой.
Динамическая структура липидного бислоя наиболее полно изучена на примере искусственных бислойных везикул. Эти исследования показали, что молекула фосфолипида как целое может вращаться вокруг своей продольной оси и имеет достаточно высокую подвижность в слое с коэффициентами латеральной диффузии 10-7—10-9 см2/с. Полярные головки образуют на поверхности короткоживущие (10-6—10-7 с) кластеры из 20—30 молекул, в результате чего могут возникать временные дефекты в структуре бислоя. Диффузия молекул воды через липидный бислой возможна при их попадании в эти свободные объемы между гидрофобными хвостами липидов. Молекулы фосфолипидов, находясь в бислое, могут осуществлять перескок из одного слоя в другой (флип—флоп). Однако в искусственных бислойных мембранах это происходит сравнительно редко из-за энергетической невыгодности переноса полярной головки через гидрофобный слой (Deenen, 1981). Только селективное взаимодействие с интегральными белками природных мембран может обеспечить быстрый переход фосфолипида из одного слоя в другой. Например, из печени быка был выделен белок, селективно взаимодействующий с ФХ и транспортирующий его с внешней стороны мембраны на внутреннюю, из искусственных везикул в плазматическую мембрану. После гидролиза этого комплекса был
выделен фрагмент пептида, селективно взаимодействующий с фосфолипидом (Etemadi, 1980):
![]()
Предполагается, что гидрофобный блок (подчеркнутый) может быть участком, способным связываться с гидрофобной цепью фосфолипида. Обратим внимание на то, что из этих 6 аминокислотных остатков 4 имеют ароматическую боковую группу.
Распределение фосфолипидов разного вида между внешним и внутренним слоем подчинено определенным закономерностям, характерным для каждой ткани. В частности, ФС уникален потому, что он всегда находится на внутренней поверхности мембраны эритроцита. При добавлении экзогенного меченого ФС к эритроцитам он немедленно переносится на внутреннюю поверхность мембраны, так как мембранные белки поддерживают асимметричное распределение зарядов на двух поверхностях плазматической мембраны. Если же эндогенный ФС появляется на внешней поверхности из-за локального разрушения мембраны, то эритроцит оказывается непригодным для гомеостаза и удаляется из кровотока ретикуло-эндотелиальной системой (Connor, Schroit, 1988).
Липидный состав цитоплазматических мембран имеет определенную тканеспецифичность. В табл. 10 представлены вариации фосфолипидных составов цитоплазматических мембран некоторых клеток. В то же время видовые различия фосфолипидного состава значительно меньше тканевых различий (МсМurrау, 1973).
Более 60 лет назад Дж. Бернал (1969) предлагал рассматривать отдельные внутриклеточные структуры как жидкие кристаллы. Наиболее очевидный пример глубокой аналогии между жидкими кристаллами и биологической структурой — липидный бислой плазматической мембраны (Браун, Уолкен, 1982).
Фазовое состояние фосфолипидов зависит от температуры: при нагревании наблюдается эндотермический фазовый переход из гелеобразного в жидкокристаллическое состояние. По-видимому, фосфолипиды, имея ограниченное число молекулярных конформаций, самоорганизуются в бислойные мембраны и восполняют разнообразие конформационных состояний за счет фазовых переходов в жидкокристаллических структурах. Эти переходы связаны с возрастанием конформационной свободы углеводородных частей липидных молекул. Например, измерение температурной зависимости теплоемкости и энтальпии везикул ФХ обнаружило два фазовых перехода — при 34 и при 41 °С. При этом расстояние между цепями жирных кислот увеличивалось от 0.48 до 0.53 нм (Волькенштейн, 1981). В зависимости от компонентного состава липидного бислоя в нем могут сосуществовать несколько квазиравновесных жидкокристаллических фаз.
Таблица 10 Липидный состав плазматических мембран, % (по: Браун, Уолкен, 1982; Кагава, 1985)
Липидный компонент |
Эритроциты |
Миелин |
Палочки сетчатки |
Гепатоциты |
Фосфатидилэтаноламин |
20 |
14 |
38.5 |
20 |
Фосфатидилсерин |
11 |
7 |
9.2 |
4 |
Фосфатидилхолин |
23 |
11 |
44.5 |
43 |
Фосфатидилинозитол |
2 |
0 |
0 |
7 |
Сфингомиелин |
18 |
6 |
1.3 |
20 |
Холестерин |
25 |
25 |
0 |
6 |
Цереброзид |
0 |
21 |
6.5 |
— |
В физиологических условиях (выше температуры фазового перехода), фосфолипидный бислой имеет жидкокристаллическое состояние, т. е. обладает одновременно текучестью и упорядоченным расположением элементов. Результатом этой текучести и достаточно высокого поверхностного натяжения на границе с водой является самозамыкание бислоя. Фактически плазматические мембраны никогда не возникают заново: они вытекают и складываются из предшествующих мембран путем добавления дополнительных составных частей (Браун, Уолкен, 1982). Однако принципы самосборки фосфолипидных слоев плазматических мембран пока недостаточно выяснены, хотя процесс новообразования мембран эндоплазматического ретикулума de novo детально исследован методом электронной микроскопии (Бирюзова, 1993). Эти мембраны синтезируются методом репликации на внешней поверхности двойной мембраны клеточного ядра, которое на это время принимает форму боба. На его вогнутой поверхности происходит самосборка мембран, а когда ядро расправляется до сферической формы, они соскальзывают и распрямляют рельеф. Этот пример показывает, что не только одномерные последовательности в полипептидных цепях и спиральных структурах ДНК могут быть матрицами для синтеза комплементарных им одномерных структур. Двумерная поверхность фосфолипидного бислоя также является матрицей для сборки комплементарного фосфолипидного слоя.
Текучесть бислоев зависит от ненасыщенности гидрофобных цепей и от присутствия в мембране дополнительных веществ. В частности, холестерин — один из основных компонентов плазматической мембраны всех эукариотических клеток — существенно влияет на текучесть бислоя (Deinum et al., 1988). В составе мембран эритроцитов присутствует до 30 % холестерина, так как он легко взаимодействует с фосфолипидами, образуя комплексы 1:1. Его плоское стероидное ядро легко проникает в структуру мембраны и увеличивает ориентацию углеводородных цепей в жидкокристаллической фазе: ядра стероидов перекрывают 9—12 углеродных звеньев в липиде. Наибольшее сродство к холестерину проявляют сфингомиелины. Однако селективность межмолекулярных взаимодействий фосфолипидов друг с другом — отдельная проблема клинической биохимии и в данном разделе мы ее рассматривать не будем (Никифорова, 1981).
Асимметричное расположение положительно и отрицательно заряженных групп фосфолипидов на противоположных сторонах плазматической мембраны приводит к возникновению значительной разности электрохимического потенциала между внешним и внутренним слоями этой структуры. До недавнего времени сравнение электростатических потенциалов фосфолипидных монослоев с потенциалом бислоя, разделяющего две водные фазы, проводилось только для искусственных симметричных мембран, где дипольные составляющие липидных молекул взаимно скомпенсированы. Электростатическая емкость такого липидного бислоя зависит от длины цепи остатков жирных кислот использованных фосфолипидов и достигает величины 0.7— 0.8 мкФ/см2 (Богуславский, 1978), при этом электросопротивление бислоя составляет 103—106 Ом ∙ см2 (Волькенштейн, 1981).
Особенности, которые отличают клеточные мембраны и их модели от традиционных объектов электрохимических исследований, начинаются с их размеров: это в буквальном смысле слова наносистемы, так как толщина липидного бислоя имеет порядок 7.0—7.5 нм, при том что толщина полярного внешнего слоя составляет 1.4 нм, а остальная часть, мембраны, построенная из углеводородных цепей, представляет собой изолятор. Известные трудности исследования электрохимических процессов на границе раздела “изолятор—раствор электролита” увеличиваются при переходе к этим тонким бислойным мембранам, так как их полярная часть соизмерима с толщиной приповерхностного слоя растворителя.
Неоднородность структуры приграничной зоны клетки определяется не только распределением зарядов фосфолипидов на внешней поверхности мембраны и низкомолекулярных противоионов, с ними связанных, но и структурой прилежащих слоев молекул воды, а также расположением пептидных молекул вблизи этой поверхности. В частности, в структуре аполипопротеинов имеются участки цепи с асимметричным распределением гидрофильных групп, которые способны к организации спиральных структур (“колес Эдмундсона”, см. рис. 4). В процессе выделения и очистки эти участки, как правило, теряют спиральную структуру, но при добавлении фосфолипидов доля спиральных участков восстанавливается. Этому способствует взаимодействие боковых групп пептида с полярными (ионизированными) головками фосфолипидов. При этом пептид располагается на фосфолипидном монослое таким образом, чтобы ось а-спирали была ориентирована параллельно поверхности слоя (Поляков, Панин, 2000).
Упорядоченность жидкокристаллического состояния фосфолипидов определяет два свойства цитоплазматической мембраны — спонтанную поляризацию и ее изменения при вариации внешних условий (температуры, внешнего электрического поля, механического давления).
Нативная асимметрия распределения положительно и отрицательно заряженных групп на разных сторонах плазматической мембраны присуща всем природным мембранам. В результате внутренние области липидного бислоя, обладающие низкой диэлектрической проницаемостью, всегда оказываются как бы между обкладками конденсатора, т. е. под действием разности потенциалов между полярными внешней и внутренней поверхностями мембраны. Под влиянием этого внутримембранного электростатического поля гидрофобные части фосфолипидов поляризуются. При этом может иметь место как молекулярная (электронная) поляризация, так и ориентационная поляризация, определяющая упаковку алифатических цепей в мембране и их жидкокристаллическое состояние. Изменение этого состояния бислоя под действием внешнего электростатического поля влечет за собой в первую очередь изменение мембранного потенциала.
Эффективным внешним электрическим воздействием может быть световая волна. Оптический диапазон частот таков, что они возбуждают колебания только в электронных оболочках, а конформации молекул в структуре бислоя не меняются. Таким образом, гидрофобная прослойка мембраны представляет собой регулярную диэлектрическую среду, которая может служить волноводом для электромагнитных волн, в частности фотонов.
Исследование структуры липидных слоев хлоропластов показало, что в процессе фотосинтеза они, подобно линзе, фокусируют свет на активном слое пигмента хлорофилла (Браун, Уолкен, 1982). Анизотропия жидкокристаллической структуры мембраны определяет ее чувствительность к направлению плоско поляризованного света (Jaffe, 1981). Плотные межклеточные контакты обеспечивают трансляцию подобных электромагнитных сигналов от клетки к клетке, так что вся ткань (или орган) оказывается “информированной” практически одновременно.
Внешние электростатические поля также влияют на клеточную мембрану, но уже воздействуя главным образом на латеральное распределение зарядов на ее поверхности, что существенно меняет поляризацию клетки как целого. Это воздействие экспериментально изучено на ранних этапах развития зародыша лягушки (Hinkel et al., 1981). Было обнаружено, что отростки развивающихся нервных клеток — нейриты — быстрее растут в сторону катода, чем в сторону анода. Аналогично росли дорсальные корешки ганглиев цыпленка — преимущественно в сторону катода. Направление постоянного внешнего электрического поля влияло и на развитие миобластов зародыша лягушки. Миобласты, изначально имевшие сферическую форму, росли перпендикулярно к направлению приложенного поля, так что клетки образующейся мышцы вытягивались поперек линий электрического поля. Это явление наблюдалось только при слабых внешних полях от 70 мВ/мм и ниже, что составляло около 1 мВ на диаметр растущей клетки. Предполагается, что его можно объяснить латеральным электрофорезом мембранных рецепторов, специфических для связывания ростовых факторов, по поверхности клетки в сторону катода (Jaffe, 1981).
Жидкокристаллическая природа липидного бислоя определяет его высокую чувствительность не только к изменению внешних температурных условий и электрических полей, но и к внешним механическим напряжениям. Для плазматических мембран разработана модель двумерного эластомера, который состоит из свободной сети гибких углеводородных цепей (Ивенс, Скейлак, 1982).
В общем случае нельзя рассматривать деформацию двумерной системы как изотропную. Однако, если радиусы кривизны поверхности мембраны много больше расстояния между слоями алифатических цепей бислойной мембраны (а для эукариотических клеток это условие всегда соблюдается), деформация поверхности всей мембраны будет почти такая же, как для каждого отдельного слоя, и изменение энтропии мембраны будет обратно пропорционально ее растяжению. Эта модель аналогична хрестоматийному примеру уменьшения энтропии при механическом растяжении каучуковой ленты. Основной вклад в изменение свободной энергии этой системы вносит работа, необходимая для упорядочения элементов сети, если при этом плотность материала постоянна. Для таких эластомеров деформация растяжения приводит к малым изменениям внутренней свободной энергии G, так как ее основные изменения напрямую связаны с приращением конфигурационной энтропии S:
dG = -TdS,
где Т — температура. Как уже указывалось, энтропия определяется по уравнению Больцмана через распределение энергии по возможным конфигурациям молекулярной сети, в число которых входят конфигурации разных жидкокристаллических состояний бислоя.
Интересная особенность энтропийных эластомеров состоит в том, что для них модуль сдвига растет с температурой. Иначе говоря, работа по растяжению эластомерной поверхности направлена против процессов теплового разупорядочения, которые протекают в системах, стремящихся к равновесию. Соответственно обратимый теплообмен при растяжении энтропийного эластомера сопровождается в среднем уменьшением степеней свободы молекулярных цепей, уменьшением энтропии и соответствующим возрастанием упорядоченности структуры. В результате возрастает чувствительность мембраны к механическому давлению, в том числе к переменным механическим напряжениям звуковых волн. А сегнетоэлектрические свойства жидкокристаллических структур билипидного слоя позволяют преобразовать эти механические напряжения в электрический сигнал.
Можно предполагать, что таким образом термодинамические свойства липидного бислоя вносят свой вклад в формирование и распространение информационных сигналов о внешней среде и тем самым участвуют в саморегуляции живой клетки и в стабилизации гомеостаза.
Совокупность представленных выше химических, динамических и структурных характеристик липидных бислойных мембран определяет их функциональные свойства: электровозбудимость; сопряжение механических свойств и поляризуемости; совместимость с ориентированными блоками полипептидных цепей.
Последнее свойство фосфолипидного бислоя имеет фундаментальный характер и заслуживает отдельного рассмотрения.