Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Физико-химические особенности пептидов
Окислительно-восстановительные свойства простых пептидов
Известно, что пептиды, боковые группы которых способны участвовать в окислительно-восстановительных реакциях, т. е. в процессах присоединения и передачи электрона, обладают высокой биологической активностью. Дыхательные цепи и реакции фосфорилирования в значительной степени определяются ходом окислительно-восстановительных реакций.
Окислители и восстановители всегда функционируют как сопряженные пары, аналогично кислотно-основным равновесиям (Ленинджер, 1974):
[донор электрона] = е- + [акцептор электрона].
Равновесие этой реакции определяется величиной окислительно-восстановительного потенциала. В настоящее время в качестве стандартного принят потенциал реакции
Н2 = 2Н+ + 2е-,
который при pH 7.0 в водном растворе равен -0.42 V.
Измерение окислительно-восстановительного потенциала позволяет оценить изменение свободной энергии при переносе электрона. Например, перенос пары электрон-эквивалентов от молекулы НАД+ через всю дыхательную цепь к молекуле кислорода (потенциал +0.82 V) освобождает 22.1 кДж/моль химической энергии, которой достаточно для обеспечения синтеза нескольких молей АТФ из АДФ.
Боковые группы цистеина и гистидина проявляют слабые кислотные свойства: значения рКа этих групп равны 8.3 и 6.0 соответственно, однако атом серы цистеина и атом азота в имидазольном кольце гистидина могут принимать и передавать электрон в зависимости от состояния окружающей среды. Окислительно-восстановительное состояние системы определяется как отношение концентраций окисленного и восстановленного компонента окс-редокс пары, например Fe3+/Fe2+ или НАД+/НАД ∙ Н. На схеме представлена реакция восстановления никотинамидного кольца никотинамидаденилдинуклеотида (НАД+) под действием сульфгидрильной группы цистеина:
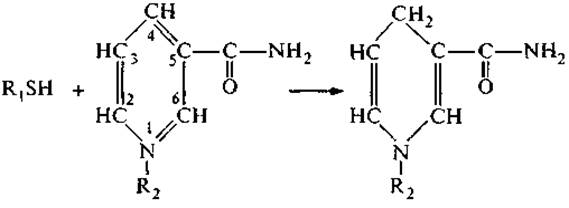
Результатом переноса гидрид-иона (:Н-) от атома серы является восстановление кольца в позициях 1 и 4.
Пептиды, содержащие остатки гистидина или цистеина, участвуют как коэнзимы или активные центры ферментных систем в каталитических реакциях и обеспечивают многие антиоксидантные системы организма. Находясь в составе мембранных пептидов, они отвечают за формирование электрического потенциала клетки и передачу электрохимического сигнала во внешнюю среду.
Многие пептидные регуляторы содержат в своем составе остатки цистеина. При окислении их сульфгидрильные группы образуют внутримолекулярные S—S-связи, которые формируют петли основной пептидной цепи (третичную структуру) и фиксируют определенную конфигурацию всей молекулы. Меркаптоэтанол и тиогликолевая кислота (восстановители) эти связи разрушают. Отсутствие антиоксидантов при выделении цистеинсодержащих пептидов из природных источников всегда приводит к получению молекул с более устойчивой третичной структурой.
Глутатион
Известно, что свободный цистеин в нейтральной или слабощелочной области легко окисляется в присутствии кислорода или других окислителей и димеризуется, образуя цистин. Аналогичная реакция лежит в основе активности глутатиона.
Глутатион (у-глутамил-цистеинил-глицин, или Glu—Cys—Gly) — широко распространенный трипептид, встречающийся практически во всех тканях живых организмов в концентрации 1—5 мМ, но в некоторых тканях она еще выше: в корковом слое хрусталика глаза млекопитающих концентрация глутатиона достигает 20 мМ. В клетках на его долю приходится до 90 % свободных тиоловых групп (Кричевская и др., 1983). Очевидно, что его пространственная структура с двумя сближенными карбоксильными группами обладает хорошими хелатообразующими свойствами и способна селективно связывать ионы переходных металлов и поливалентные катионы:
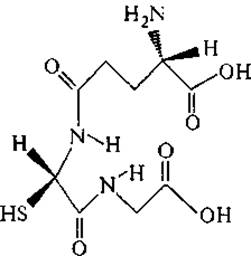
Окисление завершается обычно установлением дисульфидного мостика между двумя молекулами глутатиона:
![]()
Поэтому глутатион действует как антиоксидант, защищая сульфгидрильных групп ферментов и других белков. Он также играет особую роль в восстановлении окисленного аскорбата.
Еще одна функция глутатиона состоит в участии в транспорте аминокислот. Концентрация аминокислот в клетках поддерживается на сравнительно постоянном уровне и обеспечивается переносом их через клеточные мембраны с помощью специальных транспортных систем. Глутатион участвует в так называемом у-глутамиловом цикле, т. е. в последовательности химических реакций, в которых у-карбоксильная группа глутамата используется для активного транспорта аминокислот через клеточную мембрану. Глутатион предоставляет активированную у-глутамиловую группу, связанную изопептидной связью, которая в результате транспептидазной реакции объединяется с транспортируемой аминокислотой. Полученная у-глутамил аминокислота проникает в клетку, где дипептид расщепляется на свободную аминокислоту и 5-оксипролин. Последний преобразуется в глутамат в реакции с АТФ. Эта система транспорта специфична по отношению к нейтральным аминокислотам, глутамату и цистину (Кричевская и др., 1983).
На схеме представлен один из компонентов метаболизма глутатиона — офтальмовая кислота, аналог глутатиона, в котором тиоловая группа замещена метиловой:
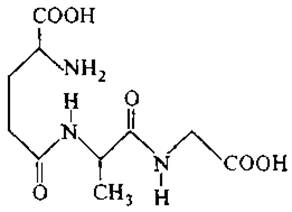
Этот пептид впервые был выделен из хрусталика глаза, и его регуляторные функции еще недостаточно изучены.
Пептиды, содержащие гистидин
Другим примером олигопептидов, способных к изменению электронного состояния боковой группы, могут служить пептиды, содержащие в своей структуре гистидин. Мы уже упоминали, что гистидин практически не встречается в тканях в свободном виде. Но он входит в состав многих ферментов и пептидов-регуляторов. Строение боковой группы гистидина обеспечивает широкий спектр активности его пептидам.
Таблица 2 Влияние концентрации трипептида GHK и его синтетических аналогов на синтез ДНК в клетках гепатомы* (определяли увеличение включения 3Н-тимидина, %) (по: Pickart, 1983)
|
Пептид |
Концентрация, нг/мл |
|||
2 |
20 |
200 |
2000 |
|
Gly—His—Lys |
50 |
408 |
339 |
91 |
Gly—His—Lys—His |
82 |
604 |
387 |
84 |
His—Lys—Gly |
31 |
368 |
353 |
56 |
Gly—Lys—His |
2 |
36 |
65 |
31 |
His—Gly—Lys |
2 |
13 |
81 |
29 |
His—Lys |
0 |
8 |
зо |
26 |
Gly—His |
0 |
0 |
6 |
3 |
* В случае других типов клеток в тканевой культуре концентрация, превышающая 1 мкг/мл, всегда угнетала рост клеток.
Из плазмы крови был выделен термостабильный трипептид Gly—His—Lys (GHK), регулирующий скорость роста и дифференциацию клеток при их выращивании в тканевых культурах (табл. 2). Наибольшая концентрация этого пептида обнаружена в почках и мозге, а наименьшая — в коже и мышечной ткани. Интересно отметить, что аминокислотный состав GHK идентичен, а последовательность остатков зеркальна по отношению к структуре бурсина (Lys—His— Gly—NH2) — регуляторного пептида, который селективно определяет стадию дифференцировки В-лимфоцитов. Высокую биологическую активность трипептида GHK обусловливают не только его хелатирующие свойства — в некоторых ферментах остаток гистидина фосфорилирован по 1-му или 3-му атому азота и служит донором в процессах фосфорилирования сахаров.
Одно из нетривиальных качеств этого трипептида — высокая селективность связывания ионов меди и других переходных металлов за счет их взаимодействия с имидазольным кольцом гистидина, благодаря чему пептид приобретает способность участвовать в окислительно-восстановительных реакциях.
Ниже приводятся константы стабильности к комплексов меди с сывороточным альбумином и пептидами (по: Pickart, 1983):
Хелатирующий агент |
Ln k |
Сывороточный альбумин |
16.2 |
Gly—His—Lys |
16.4 |
Gly—His |
8.7 |
Gly—Gly—His |
7.6 |
Gly—His—Lys + свободный His |
29.0 |
Представленные данные свидетельствуют о том, что комплекс меди с трипептидом GHK соизмерим по прочности с комплексом меди и сывороточного альбумина (СА). Но самый неожиданный результат этих измерений состоит в том, что добавление свободного гистидина почти в 2 раза увеличивает энергию связывания. Можно предполагать, что и для регуляторных пептидов, содержащих гистидин, свободный гистидин является в определенной степени агонистом.
Имидазольное кольцо гистидина имеет несколько резонансных форм:
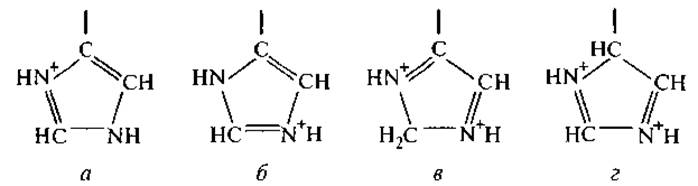
Относительный вклад этих форм в общую энергию состояния кольца оценивается как 40% (а), 32 (б), 23 (в) и 5% (г) (Ching-Fa Wu et al., 1995). Резонанс электронных структур влияет на взаимодействие гистидила с соседними аминокислотными остатками, имеющими ароматические боковые группы, и определяет универсальность строения каталитических центров многих протеиназ, в частности так называемого блока “Charge-relay-system” (D—Н—S), который мы рассмотрим в разделе 1.2.3. Теоретические расчеты максимальных и минимальных расстояний между п- и т-атомами азота боковой группы и основной цепью полипептида показали, что близко расположенные вдоль цепи остатки гистидина склонны к ассоциации, т. е. к пространственному сближению, и таким образом стабилизируют активную конформацию пептида (Karlin et al, 1994). Примером высокой активности и тканеспецифичности действия пептидов, содержащих близко расположенные звенья гистидина, может служить щелочной пептид гистатин, выделенный из околоушной слюнной железы человека. В его структуре содержится шесть остатков гистидина из имеющихся в нем 22 аминокислот. Самый активный участок этого пептида состоит из восьми остатков, три из которых — остатки гистидина:
![]()
Этот пептид из семейства гистатинов индуцирует рост периодонтальных фибробластов при концентрации 0.1 мкг/мл и рекомендован для лечения парадонтозов (Takemura et al., 1994). По своим регуляторным характеристикам он может быть отнесен к классу цитомединов, а его специфическая биологическая активность определяется совокупностью всех физико-химических характеристик гистидиновых звеньев, которые были рассмотрены в этом разделе. Следует только подчеркнуть, что два гистидиновых остатка, расположенных рядом, значительно повышают селективность пептида в реакциях хелатирования полизарядных ионов металлов, что, по-видимому, важно как для нормальной регенерации периодонта, так и для осуществления других регуляторных функций.