Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Хроматография
Ионообменная хроматография - Процедура хроматографирования белков методом ионообменной хроматографии
Разделение смесей веществ на компоненты является одной из сложнейших задач химии. На данный момент нет способов, которые гарантировали бы абсолютно полное разделение. Все существующие методы разделения смесей есть по сути своей методы разделения смеси на фракции, в большей или меньшей степени обогащенные каким-либо одним компонентом.
В хроматографии, разделение на фракции достигается пропусканием смеси веществ через колонку с неподвижной фазой или сорбентом, который удерживает разные вещества с различной эффективностью только в тех случаях, если эти вещества обладают достаточно выраженными различиями в химических или физических свойствах. Если различия невелики приходится увеличивать длину колонки, уменьшать размеры частиц сорбента (увеличивать площадь соприкосновения). Как результат, сопротивление прохождению раствора через колонку резко возрастает. Это одна из трудных позиций в технике жидкостной хроматографии. Современные насосы жидкостных хроматографов развивают давление до 1-10 тыс.атм, что делает сами хроматографы дорогими и малодоступными приборами. Чаще, поэтому, прибегают к более простым приемам обычной колоночной хроматографии.
Суть этих методов. Ионообменную смолу, обрабатывая кислотой или щелочью, переводят в активную форму и помещают в стеклянную колонку. В верхнюю ее часть вводят раствор смеси белков в подходящем буферном растворе. На этой стадии происходит связывание белков со смолой-ионообменником и уже здесь происходит первичное их распределение (небольшое размывание) по колонке. Более склонные к связыванию с ионообменником белки остаются в самой ее верхней части, менее активные - продвигаются вслед за буферной смесью на большее расстояние. Причины различной способности белков вытеснять подвижные ионы из ионообменной смолы связаны с неодинаковыми числом и природой заряженных групп в их пептидных цепях, различиями в размерах белковых молекул и их конформации.
Следующая стадия - элюирование. Это процесс вытеснения закрепленных на ионообменнике белков солевыми растворами высокой концентрации. На этой стадии происходит регенарация ионобменника в результате вытеснения ионами соли связанных со смолой функциональных групп белковых молекул. При этом, легче вытесняются и быстрее элюируются из колонки белки, которые обладают меньшим сродством к ионообменнику. На этой стадии первичный эффект размывания смеси вдоль колонки резко усиливается и смесь постепенно разделяется на обогащенные каким-либо одним компонентом фракции. Разделяющую способность колонки можно повысить, если по ходу элюирования наращивать концентрацию солей (так называемое градиентное элюирование). Иногда оказывается полезными вариации рН раствора элюэнта. Короче говоря, в каждом конкретном случае экспериментатор должен искать и находить наиболее подходящие условия для достижения наиболее полного и четкого разделения смеси на фракции.
Выходящий из колонки элюат собирают небольшими порциями (1-3 мл.) и анализируют на содержание в них белков. Для этих целей применяют коллекторы фракций.
Эффективность разделения смесей белков на колонках с ионообменниками достаточно высока. Удается разделять, как правило, даже весьма сложные смеси с незначительными различиями в свойствах компонентов. В качестве примера можно привести результаты разделения смеси пепсина и пепсиногена на ДЭАЭ-целлюлозе. Оба белка относятся к кислым. Поэтому их хроматографическое разделение проведено на анионообменнике при рН=5.6 в ацетатном буфере, т.е. в условиях наличия на молекулах отрицательного заряда. Элюирование проводили раствором с нарастающей концентрацией хлористого натрия в ацетатном буфере с рН=5.6. Вид полученной в эксперименте хроматограммы приведен на рисунке. Как видно, в эксперименте достигнуто достаточно четкое разделение белков, несмотря на то, что различия между ними как по молекулярной массе, так и по количеству и характеру ионогенных групп и др. свойствам очень незначительны.
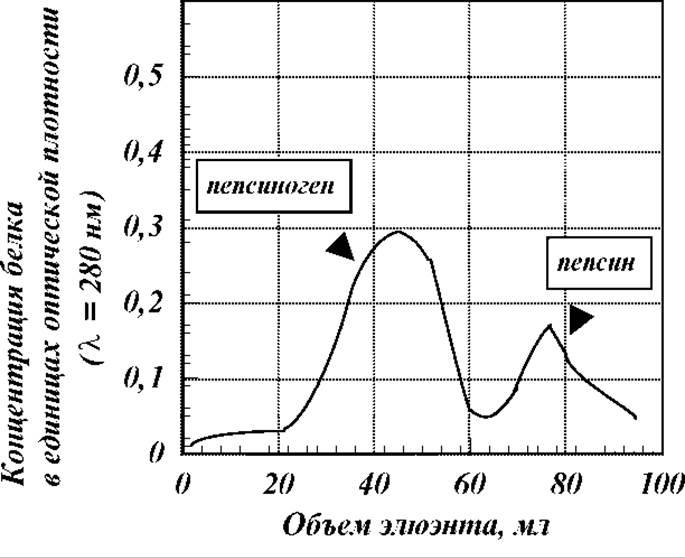
Недостатки ионообменной колоночной хроматографии. Основной - это большие потери белка за счет размывания по колонке и часто неполным вытеснением элюэнтом. Второй - за довольно продолжительное время проведения анализа ряд лабильных белков в результате взаимодействия со смолой - ионообменником существенно денатурируют или изменяют конформацию пептидной цепи.
Разделяющая способность колонки
Основными характеристиками хроматографической колонки являются ее селективность и эффективность. Как определяются эти параметры выясним на простом визуальном примере.
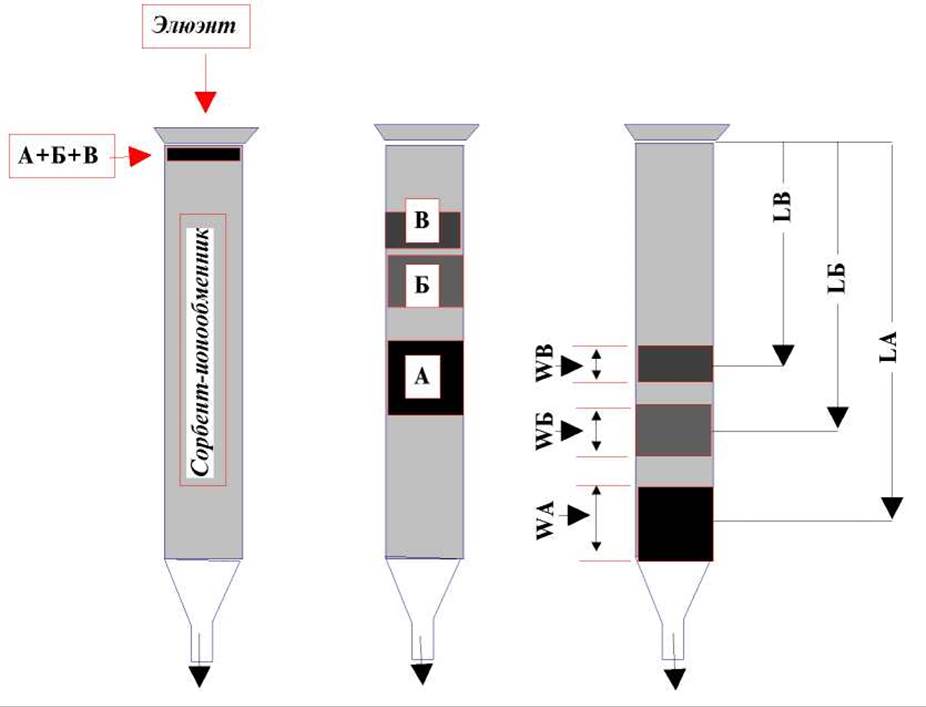
Внесем в верхнюю часть колонки смесь трех красителей А, Б, В и начнем пропускать через колонку элюэнт для вымывания этих красителей. Наблюдающаяся при этом картина характерна для любого вида колоночной хроматографии.
На первой стадии сразу после внесения смеси красителей в колонку будет видна только узкая полоска в верхней ее части. По мере пропускания элюэнта эта полоска растянется и при хорошем разделении распределится между тремя более или менее выраженными зонами соответствующего цвета. Обозначим ширину каждой из зон через W, а расстояние от начала колонки до середины зоны через L. Тогда, Селективность процесса (колонки) принято характеризовать отношениями LА/LБ, LБ/LВ, а эффективность - как отношения Li/Wi (LA/WA, LБ/WБ, LВ/WВ).
Чем больше величины селективности и эффективности для колонки, тем более сложную смесь можно на ней, в принципе, анализировать. Важно и полезно помнить следующее.
> Селективность определяется в первую очередь химической природой самих разделяемых веществ и активностью их взаимодействия с сорбентом. Поэтому, основанная на большом опыте интуиция экспериментатора в значительной мере определяют успех в выборе подходящей неподвижной фазы в каждом конкретном случае. Есть, безусловно, масса эмпирических правил, но они редко приводят к желаемому результату без соответствующего опыта и навыков.
> Эффективность, в отличие от селективности, практически не зависит от природы разделяемых веществ и является преимущественно характеристикой самой колонки. Она определяется типом сорбента, размером его частиц, плотностью их упаковки. Качественные выводы таковы: чем меньше размер частиц и чем плотнее они упакованы, тем эффективнее колонка. В опыте это проявляется уменьшением ширины зоны компонента по колонке. Расстояние между центрами полос сохраняется практически без изменений
Высокоэффективная жидкостная хроматография
Значительные успехи хроматографических методов обеспечены тем, что к настоящему времени найдены и изготовлены весьма эффективные новые материалы для стационарных фаз. Эти новые материалы характеризуются очень малыми размерами гранул (5-10 мкм. в диаметре), что позволяет производить очень плотную набивку колонок (250м х 4мм, например). Высокая плотность набивки колонок микроскопическими частицами неподвижной твердой фазы резко повышает их эффективность. Трудность, как мы уже отмечали выше, одна - это большое сопротивление колонки. Современные насосы обеспечивают давление в несколько сотен килопаскалей. В настоящее время этот метод получил название высокоэффективной жидкостной хроматографии (ВЭЖХ) и дает прекрасные результаты за короткое время (10-45мин). ВЭЖХ применима для разделения и анализа смесей практически любых типов соединений.
Методом ВЭЖХ удается разделить оптические L- и D-стереоизомеры аминоксилот. В качестве неподвижной фазы используют полистирольные и полиакриламидные матрицы. Эффективность разделения на энантиомеры существенно повышается, если к полимерным матрицам ковалентно присоединить хиральные лиганды, которые образуют комплексы с ионами двухвалентной меди.
Разработаны варианты обращенно-фазовой ВЭЖХ (ОФ ВЭЖХ). В этом случае, ионы металла в комплексе с хиральными лигандами находятся в подвижной жидкой фазе, например комплекс Cu2+-L-пролин - подвижная фаза, а стационарная фаза - катионнообменная смола или силикагель. Дальнейший прогресс в этой области связан с синтезом серии N,N-диалкиламинокислот и применением их в комплексах с ионами Cu2+ в качестве подвижных хиральных фаз для ОФ ВЭЖХ. На хиральном комплексе N,N-ди-н-пропил-L-аланинацетат меди удалось разделить на энантиомеры все белковые аминокислоты.