Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Установление аминокислотного состава белков
Аминокислотная последовательность полипептида или белка представляет собой его первичную структуру. Установление аминокислотной последовательности включает следующие этапы:
> определение суммарного аминокислотного состава (брутто состава);
> установление структуры N- и С-концевых аминокислот;
> фрагментация (расчленение) больших пептидных цепей белка на фрагменты с меньшим числом аминокислотных остатков (20 - 60)
> установление аминокислотной последовательности в небольших пептидных фрагментах по Эдману;
> составление пептидных карт;
> окончательное установление полной аминокислотной последовательности пептидной цепи исходя из результатов всех вышеперечисленных этапов.
Анализ суммарного (брутто) аминокислотного состава белков включает две стадии: полный (неспецифичный) гидролиз белка и количественный анализ смеси образовавшихся аминокислот.
Полный гидролиз проводят в стеклянных ампулах, которые предварительно очищают горячей смесью серной и азотной кислот (3:1 по объему) в течении 10-15 часов. После кислотной обработки ампулы промывают дистиллированной деионизированной водой и высушивают в воздушном термостате (сушильном шкафу) при 110 ∘С.
Стандартный метод кислотного гидролиза (полного расщепления белка) состоит в следующем. 1-5 мг. белка помещают в стеклянную ампулу, заливают 6 н. НСl, вакуумируют, заполняют азотом, запаивают и выдерживают эту смесь при 110 ∘С в течении 12 - 36 часов.
Раствор НСl готовят так. Пропускают газообразный НСl через воду и получают 12 н. раствор соляной кислоты. Этот раствор смешивают с водой в соотношении 9:11 и перегоняют. После перегонки получается 5.7 н. раствор НСl.
Расщепление белка при кислотном гидролизе протекает практически без рацемизации аминокислот. Серьезной проблемой является полное разрушение индольного фрагмента триптофана, если он входит в состав белка. Поэтому, во избежание этих осложнений, вместо НСl можно использовать метансульфоновую кислоту. Она не разрушает триптофан.
При кислотном гидролизе амиды глутамин и аспарагин превращаются в аммиак и глутаминовую, аспарагиновую кислоты соответственно. Такое превращение обнаруживают и учитывают, измеряя количество образовавшегося аммиака, а также на основании полученной при секвенировании информации.
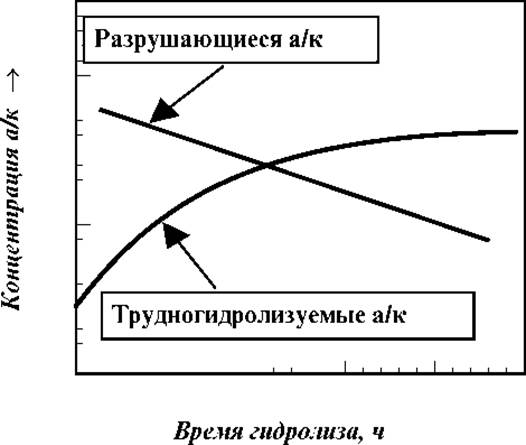
Частично разрушаются при кислотном гидролизе серин, треонин, цистеин, тирозин, метионин. Трудно и неполностью протекает гидролиз белка по пептидным связям с Вал, Лей, Иле. Для учета этих эффектов изучают кинетику гидролиза и строят зависимость концентрации вышеназванных аминокислот от времени. На основании полученных графиков количества частично разрушающихся аминокислот находят экстраполяцией к нулевому времени, а трудно гидролизуемых по выходу кривой на плато.
Качественно, сказанное проиллюстрировано на рис.
Соляную кислоту, по окончанию гидролиза, выдувают из ампулы. Помимо кислотного применяется и щелочной гидролиз. В этом случае необходимо учитывать следующие осложнения: разрушение цистеина, цистина, серина и треонина. Кроме того, щелочной гидролиз приводит к рацемизации всех аминокислот.
Анализ смесей аминокислот по завершению гидролиза
Количественное определение аминокислот полученных по завершению неспецифического гидролиза белков и пептидов проводят, как правило, различными методами разделительной хроматографии. Ниже приведены примеры некоторых (простейших) из них.
Тонкослойная хроматография - простейший и наиболее доступный метод разделения аминокислот. Возможности количественной оценки ограничены и требуют больших трудозатрат. Как правило, после разделения смесей в тонком слое строго количественный анализ не проводят. Даются, если это возможно, только оценки (больше, меньше и т.п). Идентификацию (отнесение) проявленных пятен аминокислот проводят сравнением хроматограмм с результатами хроматографирования стандартных смесей аминокислот известного состава в идентичных условиях.
Колоночная хроматография. Для разделения аминокислот чаще применяют вариант колоночной ионообменной хроматографии. Неподвижная фаза - сульфированный полистирол сшитый дивинилбензолом. Аминокислоты в этом варианте колоночной хроматографии переводят в катионную форму при низких значениях рН. Они связываются с заряженными сульфогруппами носителя. Элюирование проводят буфером (цитрат натрия, например) с возрастающей величиной рН. Повышение рН уменьшает эффективные положительные заряды аминокислот и, соответственно, силы связи их со смолой. Тем самым достигается последовательное (поочередное) вытеснение (вымывание) аминокислот из колонки. Очередность выхода аминокислот из колонки в значительной мере определяет рН буфера-элюэнта. В процессе элюирования ионы Na+ вытесняют аминокислоты по связям их с сульфогруппами.
Известен вариант двухколоночной методики. Первая колонка с амберлитом IR-120, например, служит для разделения кислых и нейтральных аминокислот, а на второй колонке проводят анализ основных аминокислот. Широкого распространения эта методика не нашла, поскольку ее не совсем просто реализовать чисто технически. Кроме того, возрастает примерно вдвое расход анализируемых материалов (потери из-за необратимого связывания) и существенно увеличивается погрешность измерений.
Величина рН буферной смеси, как уже сказано, в ходе элюирования должна возрастать. Этот градиент может быть как непрерывным так и дискретным. Последний много проще, поэтому и более распространен.
Внутренний стандарт. К раствору белка перед гидролизом в качестве внутреннего стандарта добавляют точно известное количество известной аминокислоты. Количественные показатели ее вытеснения (выхода) из колонки служат базовыми для расчета выходов всех полученных при гидролизе аминокислот. Таким способом учитываются потери аминокислот в результате анализа.
Выявление (детектирование) выходящих из колонки аминокислот и установление их структуры. Как уже говорилось выше белковые аминокислоты являются неокрашенными соединениями, поэтому отслеживать визуально их движение вдоль колонки и на ее выходе невозможно. Для этих целей необходимо использовать УФ-детектор, или "окрашивать" модифицировать аминокислоты. Это окрашивание выполняют двумя способами.
1. Постколоночная модификация. До начала 70-х годов вымываемые из колонки аминокислоты детектировали реакцией с нингидрином. Интенсивность возникающей окраски измеряли при двух длинах волн: вначале при 580нм, а затем при 440нм для определения содержания пролина и гидроксипролина.
В 1972 году в качестве селективного флуорогенного реагента на первичные амины был предложен флуорескамин. Он обеспечивает чувствительность в 10-100 раз большую, чем нингидриновый метод. Для измерений используют флуориметр с длиной волны возбуждения 340 нм и эмисии - 450 нм (стоксово смещение полосы).
Флуорескамин - очень дорогое и нестабильное в водных средах соединение, поэтому применяется редко. Его с успехом можно заменить и заменяют орто-фталевым альдегидом (ОФА). Флуоресцирующее производное ОФА аминокислот имеет полосу возбуждения с максимумом полосы поглощения 360 нм, эмиссии - 455 нм. Это производное легко образуется при рН=9-11. Некоторые осложнения в детектировании аминокислот с ОФА возникают при анализе цистеина, цистина, пролина, гидроксипролина. Чувствительность определения аминокислот с ОФА - 5пмоль (для сравнения, с нингидрином - 100 пмоль).
2. Предколоночная модификация. Постколоночная модификация аминокислот - сложная и трудоемкая процедура. Необходимо постоянно (с некоторой периодичностью) отбирать аликвоты (пробы) элюэнта, обрабатывать соответствующими реагентами и фотоколориметрировать или анализировать методом флуорометрии. Проще провести предколоночную модификацию всех аминокислот непосредственно после проведения гидролиза, а полученную после этого смесь модифицированных аминокислот разделить (проанализировать) методом тонкослойной, колоночной, жидкостной, высокоэффективной жидкостной (ВЭЖХ) и т. д. хроматографии. По воспроизводимости этот способ несколько уступает методу постколоночной модификации. Наиболее распространенный способ предколоночной модификации - это превращение аминокислот в фенилтиогидантоиновые производные по реакции с реактивом Эдмана (см. раздел 1.1.6).
Для облегчения и интенсификации массовых (серийных) анализов аминокислот созданы и производятся приборостроительной промышленностью автоматические анализаторы аминокислот. Это достаточно сложные приборы, в основу работы которых положен метод высокоэффективной жидкостной хроматографии.
Газожидкостная хроматография (ГЖХ). В этом варианте хроматографического анализа смесей аминокислот их превращают в легколетучие производные. Известен метод одностадийной модификации - триметилсилилирование по группам NH2, COOH, OH, SH. Недостаток: некоторые аминокислоты дают при хроматографировании мультиплетные пики.
Более удачными являются варианты двухстадийной модификации. 1 стадия - этерификация карбоксильных групп. Вторая - ацилирование других реакционноспособных функциональных амино-, сульфгидрильных, гидрокси-, гуанидино- групп.
Метод ГЖХ обеспечивает удовлетворительные качественные результаты анализа, но получить корректные количественные данные удается с большим трудом. Возникают к тому же осложнения с определением гистидина, аргинина, цистина. Последние разрушаются на некоторых неподвижных фазах. С появлением автоматических анализаторов аминокислот метод ГЖХ утратил свою ценность и применяется все реже.
Полный неспецифичный гидролиз белка (пептида) позволяет установить только его брутто состав, т.е. какие аминокислоты входят в пептидную цепь и в каких количественных соотношениях (пропорциях). Однако, полученный результат не несет в себе никакой информации о том, в какой последовательности соединены между собой эти аминокислоты. Для решения этой задачи проводят так называемое секвенирование пептидной цепи. Составной частью этой процедуры является установления структуры N- и C-концевых аминокислот.