Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Химическая фрагментация - Предварительные исследования белков перед секвенированием
Прежде, чем приступить к секвенированию белок подвергают некоторым предварительным исследованиям:
1. Очищают.
2. Определяют тип и число простетических групп. Иногда простетическую группу перед секвенированием отделяют от пептидной цепи.
3. Определяют наличие внутри- и межмолекулярных дисульфидных связей. Этот тип связей есть не во всех белках, но если она есть, то она играет обычно важную роль. Такие связи обнаруживают химической модификацией:
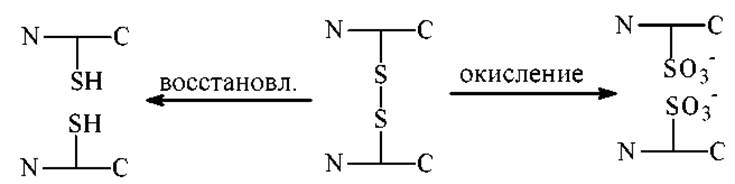
Избирательным и удобным методом расщепления S-S связей является восстановление. Типовая методика сводится к обработке белка избытком низкомолекулярного тиола. В качестве тиолов используют: цистеин, восстановленный глутатион, 2-меркаптоэтиламин, тиогликолевую кислоту меркаптоэтанол - HSCH2CH2OH, реагент Клеланда - HSCH2(CHOH)2SH и др.
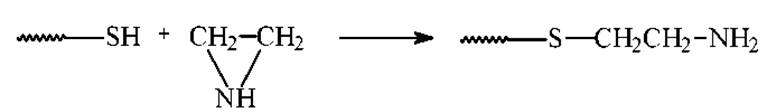
После восстановления SH-группы легко окисляются кислородом воздуха с замыканием S-S-связей. Поэтому восстановленные SH-группы защищают непосредственно в реакционной смеси, в которой проводилось восстановление.
Для защиты SH-групп используют: этиленимин
4-винилпиридин
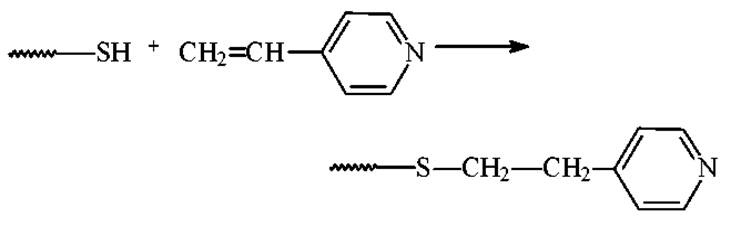
и ряд других алкилирующих агентов.
Дисульфидные связи можно восстанавливать другими реагентами, например боргидридом натрия. Однако, эти методики практически не находят применения в химии белка из-за побочных реакций. Так, например, боргидрид натрия расщепляет пептидные связи, диборан восстанавливает карбоксильные группы.
Иногда восстановление S-S-связей в белках проводят на ртутном капельном электроде, т.е. электрохимически. Для окисления часто используют надмуравьиную кислоту.
Помимо дисульфидных связей в белках встречаются и иные типы межмолекулярных связей, которые с трудом поддаются анализу и специфическому расщеплению. Это альдиминовая связь (I) в коллагене, десмозин (II) и изодесмозин в эластине, изопептидные связи между ε-аминогруппой лизина и амидной группой глутамина (III) в экстрацеллюлярных структурных белках и, по-видимому, ди- и тритирозины (IV).
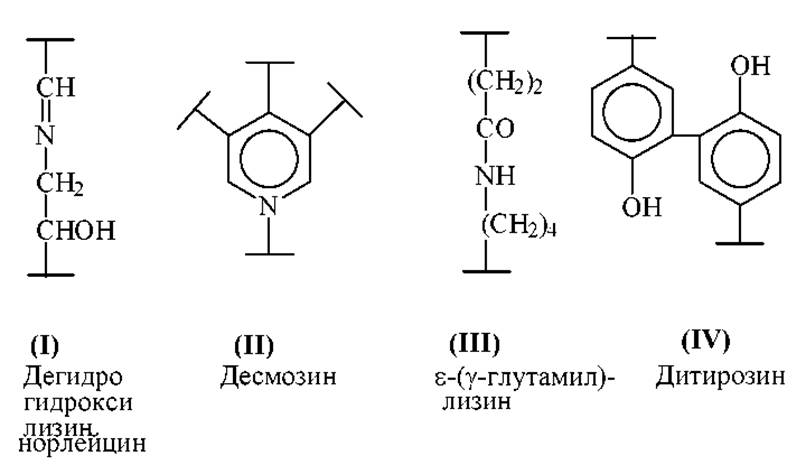
Для идентификации альдиминной связи в коллагене, ее вначале стабилизируют в белке восстановлением цианоборгидридом натрия. Затем проводят ферментативный гидролиз и выделяют сшитые между собой пептиды. Эти фрагменты идентифицируют, используя восстанавливающий агент с тритиевой меткой.
Десмозины в эластине выявляют восстановлением белка NaBD4 в воде или в D2O. Проводят гидролиз и анализируют аминокислоты хроматографически или методом масс-спектрометрии.
Наиболее известным изопептидным фрагментом типа (ІІІ) является ε-(у-глутамил) лизин. После полного ферментативного гидролиза белка этот фрагмент можно выявить непосредственно методами анализа аминокислот.
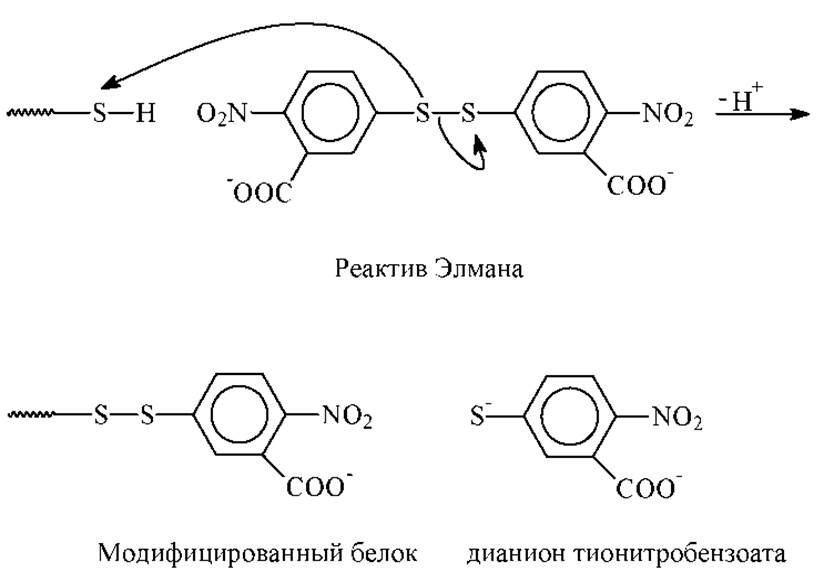
4. Определяют наличие в белке сульфгидрильных (S-H) групп цистеина. Одним из эффективных методом является обработка белка 5,5’-дитиобис-2-нитробензойной кислотой (реагент Элмана). Он избирательно реагирует со свободными SH-группами, образуя модифицированный белок и окрашенный тионитробензоатанион (λmax = 412 нм.). Это позволяет проводить после соответствующей калибровки количественный анализ.
5. Предварительная обработка белков, имеющих четвертичную структуру, для разделения (диссоциации) интактных агрегатов и выделения индивидуальных пептидных цепей. Диссоциация белковых агрегатов достигается простыми но эффективными приемами: изменение рН, обработка ПАВ (додецилсульфат натрия, например), слабое нагревание, многократное повторение с небольшой амплитудой температур процедуры замораживание-оттаивание.