Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
Четвертичная структура белков
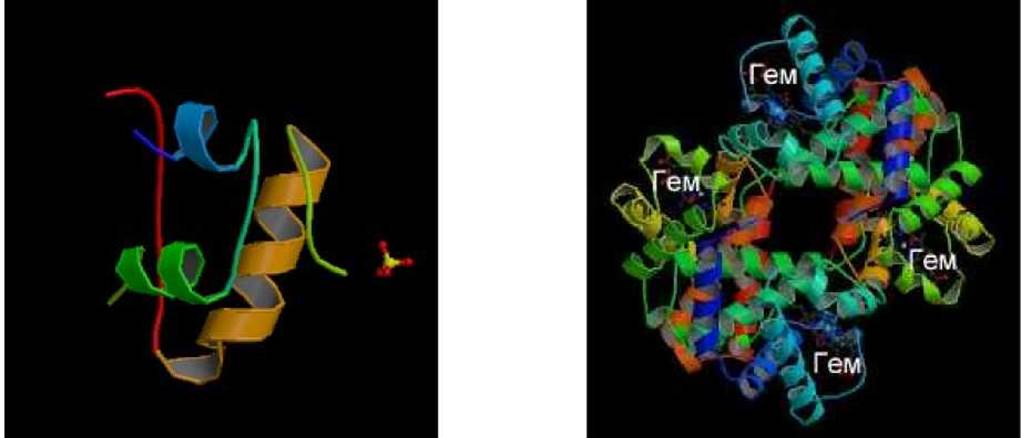
Четвертичная структура присуща только белкам, которые существуют в виде агрегатов из двух и более пептидных цепей, связанных между собой невалентными взаимодействиями. Ковалентные связи, в том числе и дисульфидные мостики, отсутствуют. Белки такого типа называют олигомерами. Это могут быть ди-, три- и т.д. - меры. Ниже, для примера, на рисунке приведены модели установленных методом РСА структур инсулина и гемоглобина (рисунки взяты из банка данных белков по сети "Internet").
Известны олигомерные белки и с большим числом пептидных цепей.
Если входящие в олигомер пептидные цепи идентичны, то он называется гомогенным. Если цепи не идентичны - гетерогенным. Стабилизация агрегатов осуществляется в основном за счет электростатических и водородных связей между боковыми цепями, расположенными на поверхности отдельных пептидных цепей. Гидрофобные взаимодействия могут быть, но их значение невелико, поскольку большинство неполярных остатков находится внутри каждой глобулярной субъединицы.
Из олигомерных белков наиболее изучен гемоглобин - гетерогенный тетрамер. Для него методом РСА установлены третичная и четвертичная структуры. Успешное решение этой задачи явилось результатом кропотливых исследований на протяжении 25 лет, которые выполнены Перутцем с сотрудниками в Кембридже. Одновременно и параллельно в этой же лаборатории был исследован методом РСА и миоглобин.
Молекула гемоглобина состоит из двух идентичных а- и двух ß-цепей. Каждая цепь вместе с гем-группой очень сходна с молекулой миоглобина. Каждая из 4-х цепей свернута нерегулярным образом и состоит из ряда а- спиральных участков, разделенных между собой местами сгибов. Подобно миоглобину, а- и ß-цепи гемоглобина содержат около 70% а-спиральных участков.
По третичной структуре а- и ß-цепи очень близки. Они состоят из а-спиральных участков одинаковой длины, согнутых под одинаковыми углами и в одних и тех же направлениях. Кроме того, обе цепи гемоглобина имеют весьма сходную с миоглобином третичную структуру. Это сходство связывают со значительным числом одинаковых аминокислотных остатков в ключевых положениях пептидной цепи.
Многие олигомерные белки диссоциируют на субъединицы при высоких и низких значениях рН, а также под действием больших концентраций мочевины или солей.
Денатурируют олигомерные белки в две стадии:
> первая стадия - разделение на субъединицы (отдельные цепи);
> вторая - разворачивание (денатурация) отдельных цепей.
Олигомерные белки наделены способностью к самосборке. Например, в смеси, содержащей а- и ß-цепи при благоприятных условиях идет самосборка гемоглобина. Этот факт свидетельствует о том, что в аминокислотной последовательности (первичной структуре) белков закодированы все структурные особенности вторичной, вторичной, третичной и четвертичной структур. Одна из отличительных особенностей олигомерных белков - способность проявлять кооперативный эффект.
Суть кооперативного эффекта рассмотрим на конкретном примере. Сравним между собой процессы насыщения кислородом молекул миоглобина (одноцепочечный белок, не имеющий четвертичной структуры) и гемоглобина - олигомерного белка. Полученные в эксперименте кривые насыщения кислородом для этих двух белков существенно различаются между собой (см.рис.2.4).
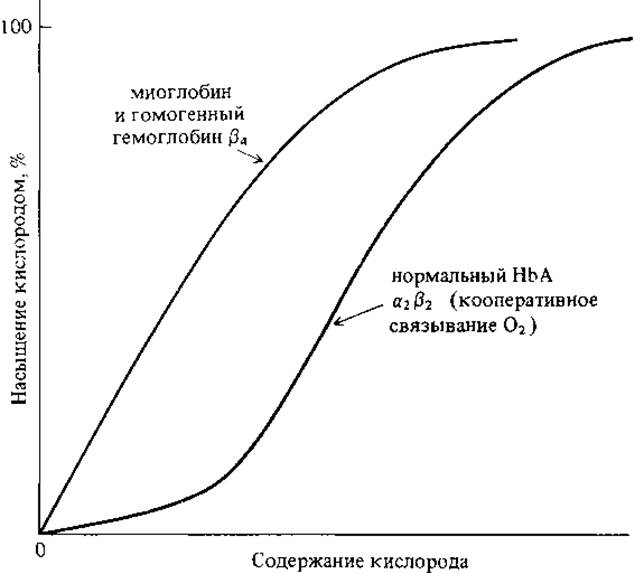
Рис. 2.4 Кривые поглощения кислорода миоглобином и гемоглобином
Кривая с насыщением у миоглобина характерна для процесса связывания единственного лиганда. Сигмоидная кривая характерна для белков с несколькими пептидными-цепями. В данном случае проявляется положительный кооперативный эффект. Подобное явление можно наблюдать у белков с различными функциями.
Качественно, положительную кооперативность можно описать так. Первоначальное связывание одного лиганда в олигомерной молекуле белка облегчает связывание второго лиганда этой молекулы, затем третьего, четвертого и т.д. В гемоглобине, в частности, связывание молекулы О2 с первой гем-группой облегчает связывание с кислородом второго гема, третьего и четвертого.
В основе кооперативной связи между субъединицами в олигомерной молекуле белка лежит аллостеризм. Суть аллостеризма состоит в том, что белковые молекулы способны принимать различные конформации в пространстве с различной активностью. Важность этого свойства белков весьма велика. Очень многие ферменты, контролирующие регуляторные функции (функции, обеспечивающие поддержание требуемых скоростей реакций), относятся к классу олигомерных белков.