Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Поведение белков в растворах
Кислотно-основные свойства белков
Кислотно-основные свойства нативных белков определяются, главным образом, наличием в них и числом ионизируемых R-групп в аминокислотных остатках. Две концевые функциональные группы пептидной цепи: амино- и карбоксигруппа практически не оказывают влияния на кислотно-основные свойства белковой молекулы в целом.
Степень ионизации функциональных групп в R-остатках, входящих в белковую молекулу аминокислот определяется не только его первичной структурой (аминокислотной последовательностью), но и структурами более высокой иерархии. Нельзя, поэтому, только на основании известной аминокислотной последовательности в точности предсказать кислотно-основные свойства белковой молекулы и ее суммарный заряд.
Рассмотрим кривую потенциометрического тирования рибонуклеазы.
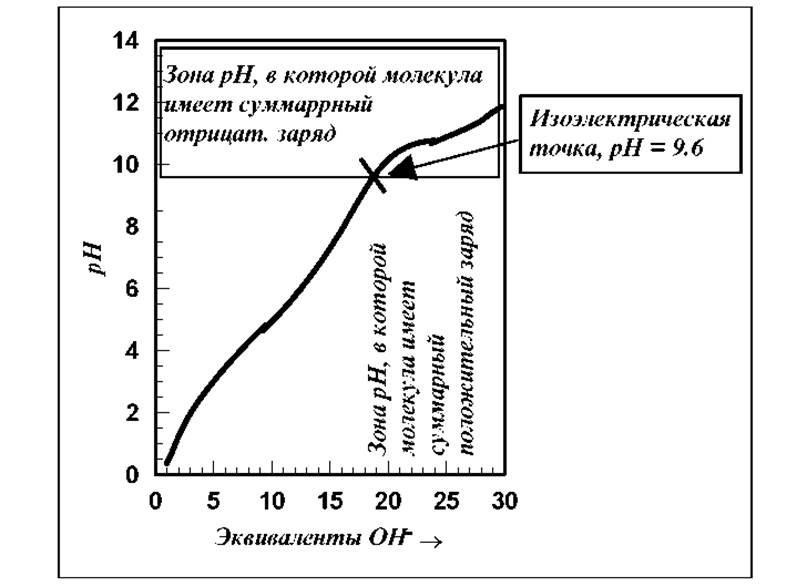
Рис. 2.6 Кривая потенциометрического тирования рибонуклеазы
Пептидная цепь молекулы этого белка свернута в плотную глобулу, состоящую из 124 аминокислот, последовательность которых известна. Помимо концевых остатков с -NH2 и -COOH группами, в пептидной цепи содержится 34 ионизируемые R-группы, большая часть которых обладает основными свойствами. Поэтому кривая титрования имеет достаточно "сглаженную" форму, по сравнению с кривыми титрования простых соединений, например двухосновной кислоты (см. рис.).
Как видно из кривой титрования рибонуклеазы (см. рис. 2.6), изоэлектрическая точка для этого белка смещена в сторону больших значений рН, т.е. для молекулы в целом характерны основные, а не кислотные свойства. Очень сходные результаты были получены при титровании ß-лактоглобулина, яичного альбумина и ряда других глобулярных белков. На основании полученных данных был сделан вывод о доступности подавляющего большинства входящих в пептидную цепь ионизирующихся R-групп кислотно-основному титрованию. Этот вывод хорошо согласуется с данными рентгеноструктурного анализа о том, что почти все ионогенные R-группы в глобулярных белках расположены на внешней поверхности молекулы, а большинство неполярных (гидрофобных) групп скрыто внутри клубка. В некоторых глобулярных белках одна или несколько ионизирующихся R-групп тем не менее не тируются. Предполагают, что они либо находятся внутри глобулы, либо вовлечены в образование прочных водородных связей. Так например, в миоглобине 5 из 11 содержащихся в нем R-групп гистидина удается оттитровать только после денатурации белка.
Для белков, так же как и для аминокислот характерно наличие изоэлектрических точек, т.е. таких значений рН, при которых их молекулы имеют суммарный нулевой заряд. На этом свойстве основан метод изоэлектрофокусировки белков. Положения изоэлектрических точек определяются числом и типом входящих в белок аминокислот с ионизирующимися R-группами. Изоэлектрическая точка будет располагаться тем выше величины рН = 7, чем больше в пептидной цепи белка содержится основных R-групп, например, Лиз, Арг. И наоборот, чем больше в молекуле белка кислотных R-остатков (Асп, Глу и др.), тем ниже величина изоэлектрической точки. У большинства глобулярных белков изоэлектрические точки лежат в пределах рН 4.5 - 6.5 (см. табл. 2.1)
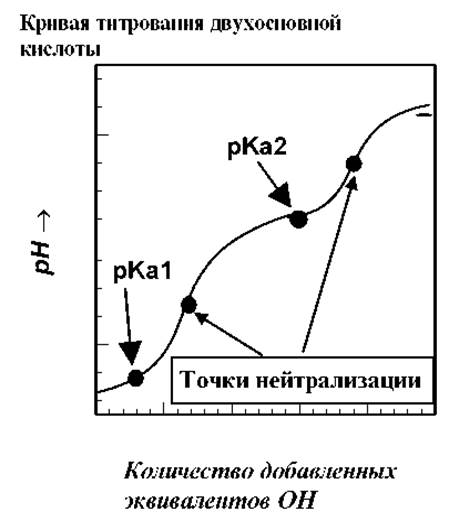
Таблица 2.1 Положения изоэлектрических точек некоторых белков
|
Белок |
рН изоэлектрической точки |
Пепсин |
< 1.0 |
|
Яичный альбумин |
4.6 |
|
Сывороточный альбумин |
4.9 |
|
Уреаза |
5.0 |
|
ß-Лактоглобулин |
5.2 |
|
y1-Глобулин |
5.6 |
|
Гемоглобин |
6.8 |
|
Миоглобин |
7.0 |
|
Химотрипсиноген |
9.5 |
|
Цитохром с |
10.65 |
Лизоцим |
11.0 |
Кривые потенциометрического титрования позволяют определять величину и знак суммарного заряда белковой молекулы при заданном значении рН. При рН выше изоэлектрической точки молекула белка заряжена отрицательно и в электрическом поле будет двигаться к аноду. По мере повышения рН величина отрицательного заряда белковой молекулы будет возрастать в соответствии с формой кривой титрования. При рН ниже изоэлектрической точки молекула белка заряжена положительно и движется к катоду.
Вид кривой титрования сильно зависит от присутствия в растворе нейтральных солей. Они по разному влияют на степень ионизации отдельных R-групп. Кроме того белки склонны связывать неорганические катионы (Cu2+, Mg2+, например) и анионы (например, хлор- и фосфат-ионы). По этой причине положение изоэлектрической точки для одного же белка может значительно варьировать в зависимости от состава среды.