Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Белки кровеносной и мышечной тканей
Белки сократительной системы
Функции белков мышечной ткани - Миозин
В мышце миозин является основным структурным элементом толстых филаментов. Он обладает тремя важными функциями.
1. При физиологических значениях рН и ионной силы среды миозин спонтанно образует волокна.
2. Миозин обладает АТФ-азной активностью, извлекая необходимую для мышечного сокращения энергию из макроэргических связей АТФ.
3. Миозин связывает полимеризованную форму актина и это взаимодействие является ключевым в процессе относительного скольжения тонких и толстых нитей при мышечном сокращении.
Молекулы миозина представляют собой длинные (около 1600Å) асимметричные нити. ММ этого белка составляет 470000 - 480000. Молекула состоит из двух идентичных пептидных цепей. Эти цепи можно разделить при обработке миозина концентрированными растворами мочевины или гуанадина. В них содержится 1800 аминокислотных остатков (см рис. 3.5).
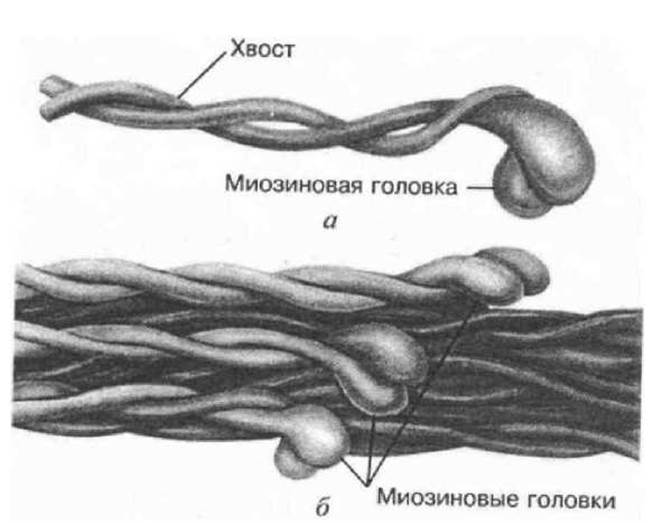
Рис. 3.5 Строение молекулы миозина (а) и миозинового (толстого) филамента (б)
Каждая из 2-х пептидных цепей миозина состоит, в свою очередь, из одной тяжелой (ММ = 200тыс) и двух легких (ММ около 20тыс) цепей. На большем своем протяжении каждая из тяжелых цепей имеет конформацию а-спирали. Две тяжелые цепи образуют закрученную относительно друг друга суперспираль. Обе пептидные цепи миозина на выходе из суперспирали заканчиваются глобулярной головой, которая состоит из двух легких цепей.
Информация о структуре миозина и его АТФазной активности получена в экспериментах по фрагментации молекулы трипсином или химотрипсином. При кратковременной обработке этими протеазами происходит расщепление в средней примерно части двойной суперспирали миозина с образованием тяжелого и легкого фрагментов. Эти фрагменты названы соответственно тяжелым и легким меромиозином. Они выделены и получены в очищенном виде.
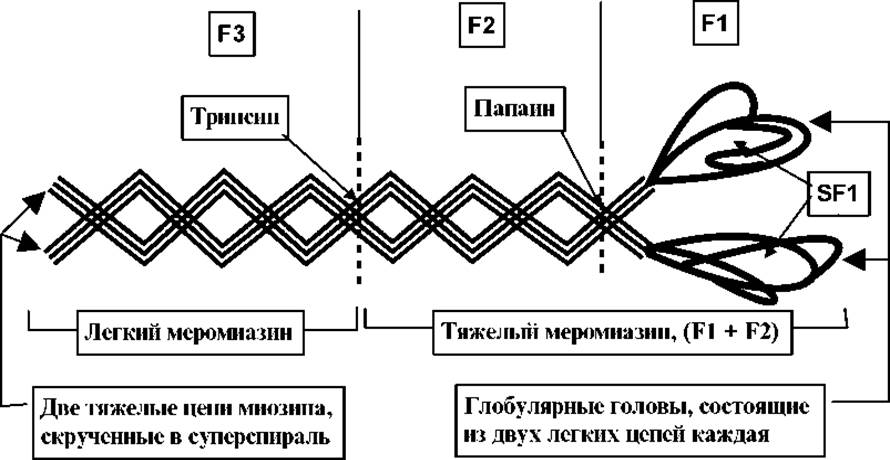
При фрагментации миозина папаином от двойной суперспирали отщепляются глобулярные части молекулы. Они названы SF1-фрагментами. Эти фрагменты можно получить и при обработке папаином тяжелого меромиозина (F1 + F2). Все фрагменты протеолитического расщепления миозина выделены в чистом виде и охарактеризованы (см.таблицу 3.3)
Легкий меромиозин (ЛММ), как и миозин, образует нити, но не обладает АТФ-азной активностью и не связывает актин. Тяжелый меромиозин (ТММ), наоборот, катализирует гидролиз АТФ и связывает актин. Есть предположения, что АТФ-азная активность и способность связывать актин в молекуле миозина и фрагменте ТММ обусловлена одними и теми же сульфгидрильными группами.
Таблица 3.3 Характеристики фрагментов молекулы миозина
Фрагмент |
Молек. масса |
Содерж. а-спиральных участ., % |
Длина, Å |
Миозин |
470 000 |
60 |
1600 |
F1 + F2 |
350 000 |
44 |
750 |
F2 + F3 |
211 000 |
95 |
1100 |
F2 |
61 000 |
80 |
400 |
F3 |
150 000 |
99 |
700 |
F4 |
120 000 |
36 |
90 |