Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Электронные спектры поглощения и кислотно-основные свойства аминокислот в растворах - Кислотно-основные свойства аминокислот
В соответствии с принципом кислотно-основного равновесия и в зависимости от рН среды а-карбоксильные и а-аминогруппы аминокислот находятся в следующих взаимопревращаемых формах:
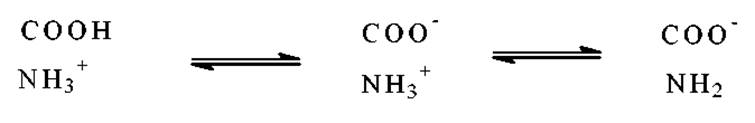
Состояние с группами -COOH и -NH3+ группами - полностью протонированная форма аминокислоты, которая по Бренстеду является двухосновой, т.е. способна отдать два протона. Диссоциация двухосновной кислоты идет в две стадии если рКа протоногенных групп различны. Для большинства аминокислот рКа1(СООН) находится в районе 2, а рКа2(NH3+) около 9 -10. Для глицина, например, процесс диссоциации выражается следующим равновесием:
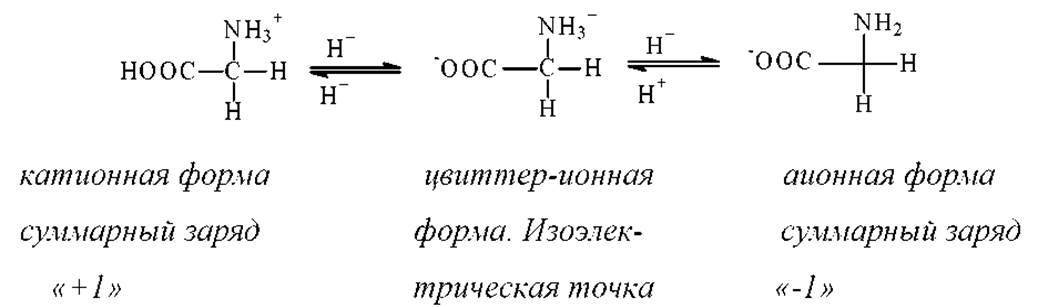
Состояние с зарядом “+1” (-COOH/-NH3+) реализуется в сильнокислых (рН ≤ 1) средах. В сильноосновных средах (рН ≥ 2 11) молекула аминокислоты несет на себе отрицательный заряд “-1” (состояние -COO-/NH2). При рН, соответствующем изоэлектрической точке положительный заряд на аминогруппе аминокислоты компенсируется отрицательным зарядом на карбоксильной группе и молекула в целом имеет суммарный нулевой заряд. Области существования различных форм для конкретных аминокислот определяют по данным потенциометрического титрования. Типичная кривая потенциометрического титрования аминокислоты не содержащей кислых групп в радикале R, приведена на рис.1.1
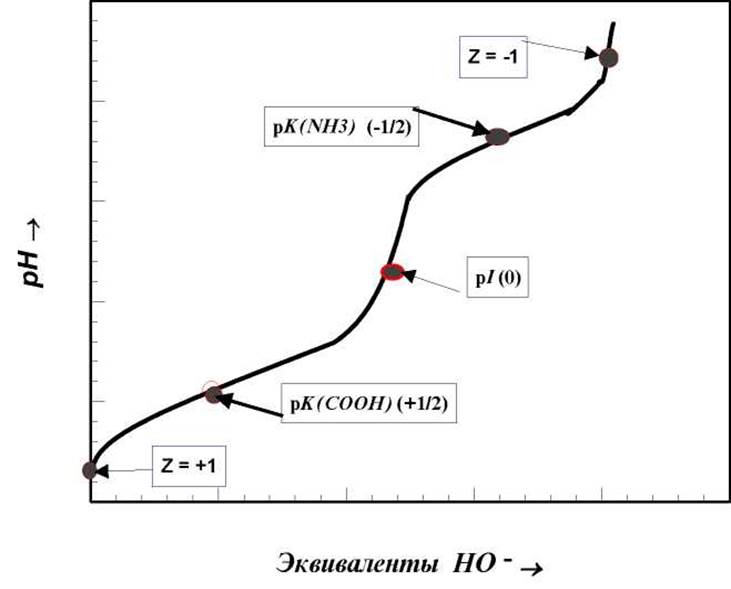
Рис.1.1 Кривая потенциометрического титрования двухосновной кислоты (аминокислоты). pK(NH3), pK(COOH) - pKa диссоциации амино- и карбоксигрупп соответственно; pI - изоэлектрическая точка. В скобках приведены значения суммарного заряда (Z) на молекуле аминокислоты
Аминокислоты, в которых остаток R не содержит кислотно-основных ионогенных групп, называют нейтральными. В ряду 20-ти белковых их 13. Величина рН, при которой молекула аминокислоты имеет суммарный нейтральный заряд называется изоэлектрической точкой (рНІили рI). Численно, величина рI равна среднему арифметическому величин рКа1 и рКа2.
pI = 1/2(pKa1 + pKa2)
В любой другой точке кривой потенциометрического титрования (фактически при любом другом значении рН кроме рН = рI) молекула аминокислоты несет на себе заряд той или иной полярности. Величина и знак этого заряда определяются относительными концентрациями частиц с зарядом “+1” и “-1”. Например при рН = рКа1 в растворе будет находиться 50% СОО-МН3+ (заряд “0”) и 50% COOH/NH3+ (заряд “+1”). Суммарный заряд для этой точки - +1/2. В т. рН = рКа2 - -1/2. Суммарный заряд при любом другом значении рН можно оценить по уравнению Гендерсона - Хассельбальха.
В общем случае, суммарный заряд молекулы аминокислоты определяется не только а-амино- и а-карбоксильной группами, но и наличием ионогенных групп в остатке R. Аминокислоты с такими остатками приведены в табл. 1.2.
Таблица 1.2 Аминокислоты с ионогенными группами в R-остатке
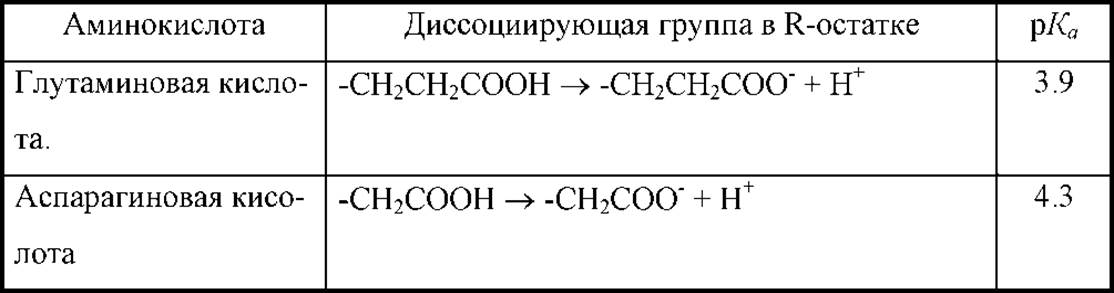
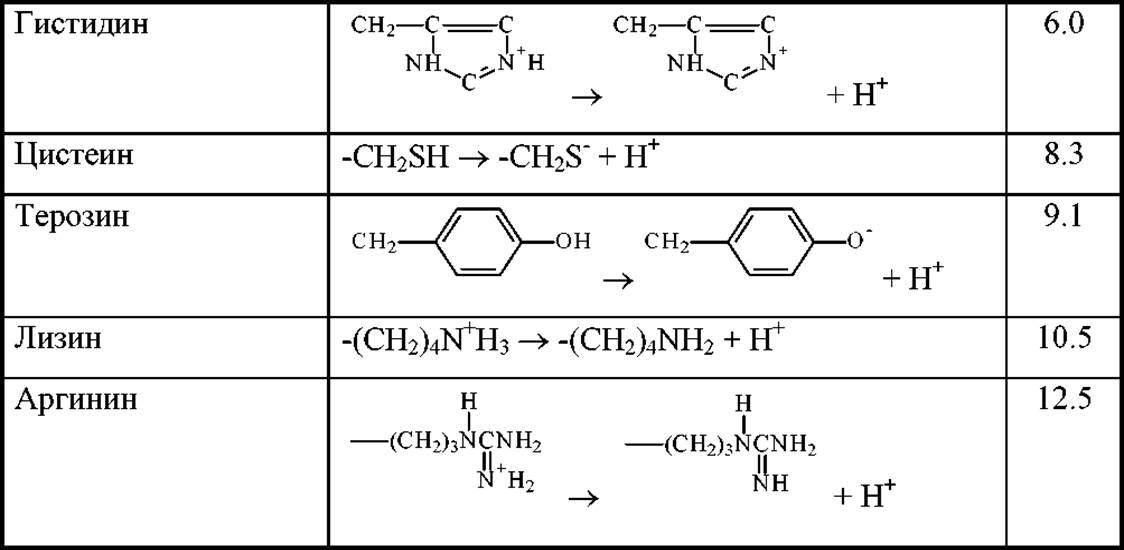
Значения pKa для всех кислотно-основных ионогенных групп белковых аминокислот приведены в табл. 1.3. Знание этих величин позволяет рассчитывать значения изоэлектрических точек для отдельных аминокислот и устанавливать знак заряда, который несет молекула при заданном значении рН среды. Это весьма полезная информации, которая позволяет оптимизировать условия проведения некоторых экспериментов. Например, задание величины рН среды для наилучшего разделения смесей аминокислот методом электрофореза или изоэлектрофокусировки, ионообменной хроматографии и т.д.
Таблица 1.3 Величины рКа ионогенных групп белковых аминокислот
Аминокислота |
рКа ионгенных групп |
||
а-СООН |
a-NH3+ |
RH или RH+ |
|
Глицин |
2.34 |
9.60 |
|
Аланин |
2.34 |
9.69 |
|
Валин |
2.32 |
9.62 |
|
Лейцин |
2.36 |
9.68 |
|
Изолейцин |
2.36 |
9.68 |
|
Серин |
2.21 |
9.15 |
|
Треонин |
2.63 |
10.43 |
|
Метионин |
2.28 |
9.21 |
|
Фенилаланин |
1.83 |
9.13 |
|
Триптофан |
2.38 |
9.39 |
|
Аспарагин |
2.02 |
8.80 |
|
Глутамин |
2.17 |
9.13 |
|
Пролин |
1.99 |
10.6 |
|
Аспарагиновая кислота |
2.09 |
9.82 |
3.86* |
Глутаминовая кислота |
2.19 |
9.67 |
4.25* |
Гистидин |
1.82 |
9.17 |
6.0* |
Цистеин |
1.71 |
10.78 |
8.33* |
Тирозин |
2.20 |
10.07 |
9.11* |
Лизин |
2.18 |
8.95 |
10.53 |
Аргинин |
2.17 |
9.04 |
12.48 |
*- В этих аминокислотах группа R ионизируется раньше, чем a-NH3+.
Величины рКа для R-групп в глутаминовой и аспарагиновой аминокислотах (4,25 и 3,86 соответственно, см. табл. 1.3.) свидетельствуют о том, что эти группы являются кислотными. Эти две аминокислоты относят, поэтому, к кислым. R-группы лизина и аргинина имеют основный характер. Их относят к основным. Между этими явно основными и кислыми аминокислотами расположены гистидин, цистеин и тирозин, рКа которых близко к 7 и не дает веских оснований для отнесения их к кислым или основным.
Для нахождения изоэлектрической точки три- и более основных аминокислот вычисляют среднее арифметическое двух последовательных значений рКа, между которыми расположена точка pI. Полезно усвоить и помнить, что pI численно равна значению рН среды, при котором количества положительных и отрицательных зарядов на молекуле равны по абсолютной величине, т.е. молекула имеет суммарный нулевой заряд. Это позволяет, рассчитав значение pI для конкретной аминокислоты, соотнести его с легко измеряемой экспериментально величиной рН раствора и оценить каких зарядов (положительных или отрицательных) на молекуле при этом значении рН больше. При этом, можно без особых опасений пользоваться следующим простым правилом: при рН > pI - молекула приобретает избыточный отрицательный, а при рН < pI - избыточный положительный заряд. В силу этого, при наложении внешнего электрического поля (при электрофорезе, например), молекула в среде с рН > pI будет двигаться в направлении положительно заряженного электрода (анода), а при рН < pI - отрицательно заряженного электрода (катода). Этим правилом можно пользоваться для аминокислот и сравнительно небольших пептидов. С увеличением числа аминокислотных остатков в пептидах погрешность расчета pI через pKa отдельных ионогенных групп быстро возрастает и делает описанный выше способ оценки знака суммарного заряда малоэффективным или неприемлемым.
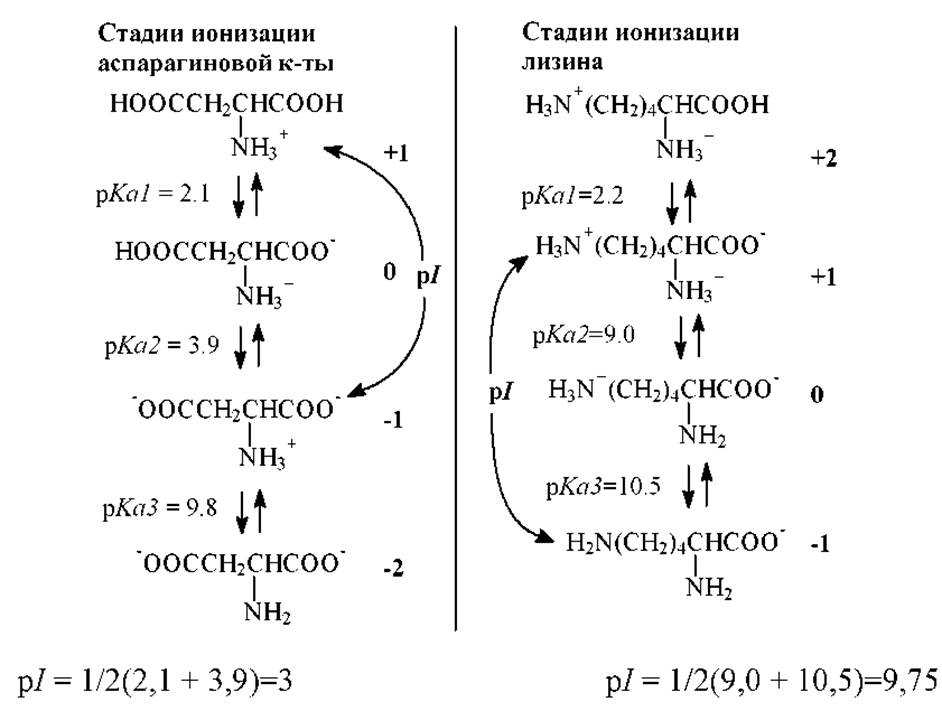
Ниже, в качестве примера, приведены расчеты величин pI для некоторых двух- и трехосновных белковых а-аминокислот, которые вычислены с использованием приведенных в табл. 1.3 значений pKa ионогенных групп этих аминокислот
Аланина - нейтральная аминокислота:
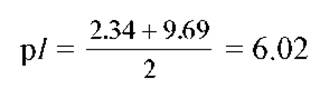
Аспарагиновая кислота - кислая аминокислота:
![]()
Лизин - основная аминокислота:
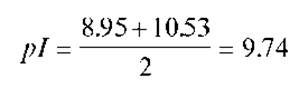
Чтобы не ошибиться в выборе пары величин pKa, которые необходимо использовать для расчета значения pI для более чем двухосновной аминокислоты или пептида, можно просто выписать последовательность постадийной ионизации всех входящих в состав молекулы ионогенных групп. Выстраивая последовательность стадий диссоциации аминокислоты или пептида нужно пользоваться величинами pKa ионогенных групп, выстраивая различные формы в ряд по возрастанию pKa, начиная с полностью протонированной (с наибольшим по величине положительным зарядом). Цвиттер-ионная (изоэлектрическая) форма будет всегда находится между состояниями с зарядами (+1) и (-1). Все сказанное выше наглядно иллюстрируют приведенные ниже схемы для трехосновных (кислой и основной) аминокислот.