БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 5. МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ: СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ
5.6. На поверхности гемоглобина серповидных клеток имеются «липкие» участки
Валин имеет неполярную боковую цепь, тогда как глутамат-высокополярную. Замена глутамата валином в 6-м положении р- цепи приводит к тому, что на поверхности гемоглобина S оказывается неполярный остаток (рис. 5.8). В результате растворимость дезоксигенированного гемоглобина S значительно снижается, тогда как растворимость оксигенированного гемоглобина S практически не изменяется. Этот факт лежит в основе всей клинической картины серповидноклеточной анемии, а также особенностей, характерных для признака серповидноклеточности.
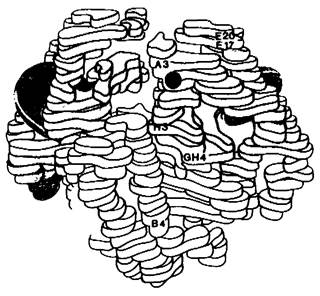
Рис. 5.8. Модель дезоксигемоглобина А при низком разрешении, α-Цепи показаны желтым, β- цепи-голубым. Участок, в котором произошла замена аминокислоты в гемоглобине S, отмечен красным. Обратите внимание, что этот участок находится на поверхности молекулы
Молекулярный механизм появления серповидных эритроцитов можно представить себе следующим образом.
1. Замена глутаминовой кислоты на валин приводит к появлению «липкого» участка (sticky patch) на наружной стороне каждой Р-цепи гемоглобина S (рис. 5.9). Такой «липкий» участок имеется как в окси-, так и в дезоксигемоглобине S, но не в гемоглобине А.
Рис. 5.9. Красными треугольниками показаны «липкие» участки, имеющиеся как в окси-, так и дезоксигемоглобине S, но отсутствующие в гемоглобине А. Комплементарный участок изображен в виде зазубрины, соответствующей треугольнику. Этот комплементарный участок имеется в дезоксигемоглобине S и не исключено, что и в дезоксигемоглобине А
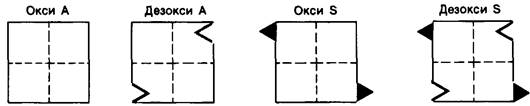
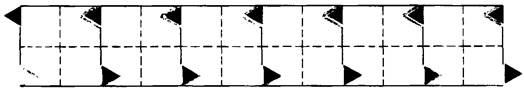
2. В дезоксигемоглобине S имеется участок, комплементарный «липкому» участку (рис. 5.9). Локализация комплементарного участка пока не установлена. Комплементарный участок одной молекулы дезоксигемоглобина S взаимодействует с «липким» участком другой молекулы дезоксигемоглобина S, что приводит к образованию агрегатов большой длины, деформирующих эритроцит.
3. В оксигемоглобине S комплементарный участок замаскирован. «Липкий» участок в нем имеется. Однако недоступность комплементарного участка препятствует соединению молекул гемоглобина S друг с другом.
4. Таким образом, эритроциты серповидной формы появляются в условиях, когда дезоксигенированная форма гемоглобина Б достигает высокой концентрации (рис. 5.10).
Рис. 5.10. Взаимодействие «липкого» участка в дезоксигемоглобине S с комплементарным участком другой молекулы дезоксигемоглобина S приводит к образованию длинных агрегатов. Здесь показана одна из сформированных таким образом нитей спирализованного волокна
Исходя из этих фактов, можно объяснить ряд клинических симптомов серповидноклеточной анемии. Так, при появлении серповидных эритроцитов в мельчайших сосудах возникает порочный круг. Серповидные клетки блокируют кровеносный сосуд, что создает локальную недостаточность кислорода. В результате в этом участке больше гемоглобина переходит в дезоксиформу и еще больше образуется деформированных, серповидных эритроцитов. У носителей признака серповидноклеточности симптомов болезни обычно не наблюдается, потому что содержание гемоглобина S в этом случае не превышает половины общего количества гемоглобина. При нормальной концентрации кислорода такое содержание гемоглобина S не настолько велико, чтобы вызвать деформацию эритроцита. Однако при значительном снижении парциального давления кислорода (на большой высоте, например) серповидные эритроциты могут появиться и у носителей признака серповидноклеточности.
5.7. Дезоксигемоглобин S образует длинные спирализованные волокна
Как указывалось, выше, дезоксигемоглобин S образует волокнистый осадок, который деформирует эритроциты, придавая им серповидную форму (рис. 5.2). При электронно-микроскопическом исследовании выявляются волокна двух типов: диаметром 170 А (рис. 5.3) и чаще диаметром 215 А (рис. 5.11). По-видимому, в основном образуются волокна, представляющие собой спираль из 14 нитей, в которой 10 молекул гемоглобина Б расположены снаружи и 4 молекулы - внутри (рис. 5.12). Существенная особенность этой построенной из нитей спирали состоит в том, что каждая молекула гемоглобина S контактирует по крайней мере с восемью другими. Ясно, что спираль стабилизирована многочисленными связями. Связь с участием валина-6 в β-цепи сдвигает термодинамическое равновесие дезоксиформы гемоглобина в сторону образования волокон, однако это не единственный фактор стабилизации спирали.
Рис. 5.11. Электронная микрофотография негативно окрашенного волокна дезоксигемоглобина S

5.8. Скорость образования волокон в высокой степени зависит от концентрации дезоксигемоглобина S
Кинетика образования волокон дезоксигемоглобина S имеет большое значение, поскольку именно от нее зависит, успеет ли эритроцит приобрести серповидную форму за то время, когда он проходит через капилляры, т.е. примерно за 1 с. Наиболее важным фактором при этом является концентрация дезоксигемоглобина S; это было показано в опытах in vitro, в которых был использован тот факт, что растворимость дезоксигемоглобина S при низких температурах значительно выше, чем при высоких. Полимеризацию дезоксигемоглобина Sвызывали, быстро повышая температуру раствора от 4 до 37°С. Об образовании волокон судили по изменению физических свойств раствора, а именно светорассеяния. При достаточно низкой концентрации гемоглобина S образование волокон происходит с задержкой на много минут (рис. 5.13). Время задержки т зависит от концентрации с (точнее от термодинамической активности) дезоксигемоглобина S в соответствии с уравнением
![]()
где С8 - растворимость гемоглобина S при равновесии, к -константа, зависящая от условий среды, n-показатель степени. Полученное экспериментальным путем, значение nоказалось поразительно большим числом-около 10. Другими словами, скорость образования волокон пропорциональна 10-й степени активности гемоглобина 8. Следовательно, формирование волокон представляет собой высокосогласованный процесс. Изучение кинетики этого процесса показало, что фазой, лимитирующей скорость образования волокон, является образование центра агрегации (нуклеация). После возникновения конгломерата критического размера (примерно из 10 молекул дезоксигемоглобина S) дальнейший рост волокна происходит очень быстро (рис. 5.14). Указанный размер агрегата соответствует, по-видимому, большей части одного витка спирали из 14 нитей (рис. 5.12). Эти данные имеют большое клиническое значение. Они показывают, что кинетические, а также термодинамические факторы играют важную роль в формировании серповидных эритроцитов. Даже при высоком содержании дезоксигемоглобина S эритроциты не приобретут серповидной формы, если время их прохождения от капилляров тканей к альвеолам легких, где происходит оксигенация, короче, чем лаг-период процесса волокнообразования. Высокая степень зависимости скорости полимеризации от концентрации дезоксигемоглобина S объясняет также, почему носительство признака серповидноклеточности протекает обычно бессимптомно. Дело в том, что концентрация дезоксигемоглобина S в эритроцитах гетерозигот примерно в 2 раза ниже, чем в эритроцитах, соответствующих гомозигот, а, следовательно, скорость образования волокон должна быть примерно в 1000 раз медленнее (210 = 1024).
Рис. 5.12. Модель волокна дезоксигемоглобина S, построенного из 14 спирализованных нитей. А - продольный разрез, Б-поперечный разрез. Каждый кружок соответствует тетрамеру гемоглобина S
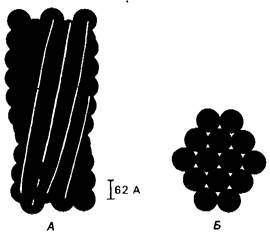
Рис. 5.13. Кинетика образования волокон дезоксигемоглобина S in vitro по данным измерения светорассеяния. Полимеризацию вызывали быстрым повышением температуры от 4 до 37°С. Длительный лаг-период соответствует фазе агрегации (комплексообразованию)
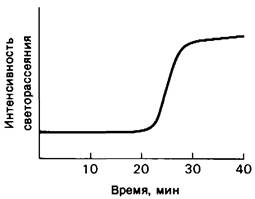
Рис. 5.14. Фаза агрегации при формировании волокон дезоксигемо- глобина А. Сборка центров агрегации происходит медленнее, чем дальнейший рост агрегатов
