БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 5. МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ: СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ
5.14. В результате некоторых мутаций гемоглобины утрачивают стабильность из-за деформаций третичной структуры
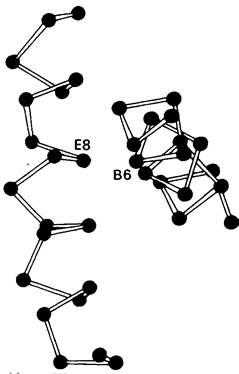
Замены аминокислот в отдаленных от гема участках могут препятствовать возникновению нормальной конформации гемоглобина и тем самым резко нарушать его функцию. Большой интерес в этом отношении представляет гемоглобин Riverdale-Bronx, у которого в положении В6 вместо глицина стоит аргинин. Из-за больших размеров аргинин не умещается в том узком пространстве, в котором должны пересекаться спирали В и Е (рис. 5.18). Действительно, во всех нормальных гемоглобинах и миоглобинах положение В6 всегда занято глицином. Гемоглобин Riverdale-Bronx в результате произошедшей аминокислотной замены оказывается нестабильным.
Рис. 5.18. Молекула гемоглобина принимает нормальную структуру, только если в положении В6 стоит остаток глицина. Поскольку именно в этом участке перекрещиваются спирали В и Е, для большей, чем у глицина, боковой цепи нет места
Гемоглобин Gun Hill принадлежит к числу редко встречающихся аномальных гемоглобинов, у которых не один, а несколько аминокислотных остатков затронуты мутацией. В указанном гемоглобине произошла потеря пяти аминокислот в каждой β-цепи, а именно выпал последний аминокислотный остаток в F-спирали и следующие четыре остатка в углу, образованном F- и G спиралями. В нормальном гемоглобине соответствующий фрагмент полипептидной цепи образует контакты с гемом. Выпадение указанного фрагмента в результате мутации приводит к тому, что β-цепи гемоглобина Gun Hill не содержат гема. Клиническое проявление этой мутации-гемолитическая анемия.
5.15. Мутации в области контактов нарушают аллостерические взаимодействия
Для функционирования гемоглобина в качестве эффективного переносчика кислорода необходимо сохранение всех его аллостерических свойств. Целостность участка, связывающего гем, и правильная укладка субъединиц гемоглобина-условие необходимое, но отнюдь не достаточное для полноценного функционирования. Важная роль принадлежит аминокислотным остаткам, локализованным в области контактов между субъединицами, так как некоторые из этих остатков передают информацию от одной субъединицы к другой. Контакты между одноименными субъединицами гемоглобина немногочисленны и по своей природе полярны, тогда как контакты между разноименными субъединицами обширны и в основном неполярны. Существуют два типа контактов между α- и β-цепями, обозначаемые соответственно α1β1 и α1β2. Как уже отмечалось, а 1р2-контакт играет, по-видимому, ключевую роль в передаче аллостерических взаимодействий, судя по тому, что именно в этой области наблюдается значительное перемещение атомов при оксигенировании гемоглобина. Об этом свидетельствует и тот факт, что почти все гемо г ловимы с заменами в области α1β2-контактов проявляют пониженную кооперативность. Более того, обычно и сродство этих гемоглобинов к кислороду отличается от нормы.
Например, гемоглобин Kempsey характеризуется Р50 = 15 торр, тогда как для нормального гемоглобина Р50 равно 26 торр. При этой мутации аспартат в положении G1 в β-цепи заменен аспарагином. Почему такая замена проявляется в значительном повышении сродства к кислороду? Вспомним, что в дезоксигемоглобине область ai (32-контакта в норме стабилизирована водородной связью между остатками аспартата G1 и тирозина в a-цепи (разд. 4.9). Эта водородная связь обеспечивает устойчивость Т-состояния (tense, напряженное), характерного для нормального дезоксигемоглобина. Отсутствие указанной водородной связи в гемоглобине Kempsey уменьшает стабильность Т-состояния, сродство к кислороду в результате повышается. В обратной ситуации в тех же случаях, когда в результате мутации нарушается стабильность R (релаксированного) состояния, следует ожидать снижения сродства к кислороду. Действительно, Р50 гемоглобина Kansas равен 70 торр. У больных с таким гемоглобином резко выражен цианоз, поскольку уровень насыщения кислородом их артериальной крови составляет 0,6 против 0,97 в норме. В гемоглобине Kansas произошла замена аспарагина G4 на треонин, вследствие чего не образуется той водородной связи, которая в норме стабилизирует оксигемоглобин.
5.16. Значение открытия мутантных гемоглобинов
Выявление мутаций белков-переносчиков кислорода оказало большое влияние на молекулярную биологию, медицину, генетику и антропологию. Мутантные гемоглобины используются в трех линиях исследований.
1. Мутантные гемоглобины позволяют понять взаимосвязь между структурой и функцией нормального гемоглобина. Мутация по одному аминокислотному остатку представляет собой высокоспецифическую химическую модификацию молекулы, осуществленную самой природой. Такие мутации помогают выявить, какая часть молекулы имеет наиболее важное значение для функции.
2. На примере мутантных гемоглобинов было впервые обнаружено, что болезнь может возникнуть в результате замены одной-единственной аминокислоты в одной полипептидной цепи определенного белка. Вся концепция о молекулярных болезнях, составляющая теперь неотъемлемую часть медицины, возникла при изучении гемоглобина серповидных клеток.
3. Выявление мутантных гемоглобинов расширяет наши представления об эволюционных процессах. Мутации служат «сырьем» для эволюции. Как показало изучение серповидноклеточной анемии, мутация может быть одновременно и полезной, и вредной. Процесс эволюции может приводить к болезни у отдельных особей; это красочно описали Цукеркандл и Полинг (Zuckerkandl, Pauling 1962):
«С субъективной точки зрения эволюция чаще всего сводилась к страданиям от болезни. Эти болезни были, безусловно, молекулярными. Выражение концепции добра и зла, которую человек изобразил как свое печальное изгнание из рая, это, может быть, молекулярная болезнь, обернувшаяся эволюцией».