БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
Рассматривается на примере взаимосвязи между пространственной структурой белков и их биологической активностью
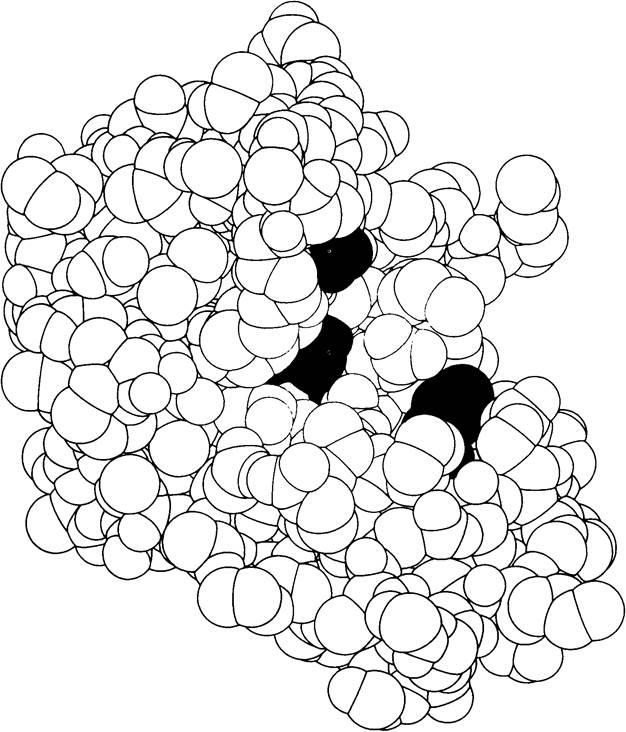
Модель рибонуклеазы S - фермента, гидролизующего рибонуклеиновые кислоты. Цветом выделены аминокислоты в активном центре, критически необходимые для осуществления катализа. Пространственная структура этого фермента была раскрыта Фредериком Ричардсом и Гарольдом Уикофом (по рисунку, любезно предоставленному д-ром F. Richards, S. Anderson и A. Perlo).
ГЛАВА 2. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ БЕЛКОВ
Белки играют решающую роль практически во всех биологических процессах. Значение и удивительное разнообразие их функций очевидно из следующих примеров.
1. Ферментативный катализ. В биологических системах почти все реакции катализируются специфическими макромолекулами, называемыми ферментами, Некоторые из этих реакций, такие как гидратирование диоксида углерода, очень просты. Другие же, например, репликация всей хромосомы, в высшей степени сложны. Почти все ферменты-мощные катализаторы, повышающие скорости реакции по крайней мере в миллион раз. Так, в отсутствие ферментов химические превращения in vivo удается выявить очень редко. В настоящее время охарактеризовано несколько тысяч ферментов, причем многие из них выделены в кристаллической форме. Поразителен тот факт, что все известные ферменты являются белками. Следовательно, именно белки определяют ход химических превращений в биологических системах.
2. Транспорт и накопление. Транспорт многих небольших молекул и ионов осуществляется специфическими белками. Например, содержащийся в эритроцитах гемоглобин переносит кислород к тканям, тогда как близкий к нему белок миоглобин запасает кислород в мышцах. В плазме крови железо транспортируется в виде комплекса с трансферрином, а в печени оно накапливается в виде комплекса с другим белком - ферритином.
3. Координированное движение. Белки-основной компонент мышц. Сокращение мышцы обеспечивается скольжением двух типов белковых нитей относительно друг друга. Координированные движения на микроскопическом уровне, например, расхождение хромосом во время митоза или продвижение спермия при помощи жгутика, также обеспечиваются сократительными структурами, состоящими из белков.
4. Механическая опора. Высокая упругость кожи и кос гей обусловлена наличием фибриллярного белка коллагена.
Рис. 2.1. Микрофотография кристалла гексокиназы-ключевого фермента утилизации глюкозы

Рис. 2.2. Поперечный срез летательной мышцы насекомого под электронным микроскопом. Видно, что белковые нити двух типов образуют гексагональные структуры

5. Иммунная защита. Антитела-это высокоспецифические белки, способные узнавать и связывать такие чужеродные объекты, как вирусы, бактерии и клетки других организмов. Таким образом, белки играют жизненно важную роль, различая свое и чужое.
Рис. 2.3. Электронная микрофотография коллагенового волокна

6. Генерирование и передача нервных импульсов. Ответ нервных клеток на специфические импульсы опосредован рецепторными белками. Например, родопсин - фоторецепторный белок клеток палочек сетчатки. Молекулы рецепторов, приводимые в действие специфическими веществами небольшой молекулярной массы типа ацетилхолина, обеспечивают передачу нервных импульсов в синапсах, т.е. в местах соединения нервных клеток.
Рис. 2.4. Микрофотография ганглия, Видна пролиферация нервов после добавления фактора роста нервов, представляющего собой комплекс белков

7. Регуляция роста и дифференцировки. Строгая регуляция последовательности экспрессии генетической информации имеет крайне важное значение для упорядоченного роста и дифференцировки клеток. В любой отрезок времени жизни огранизма экспрессируется только небольшая часть генома клетки. У бактерий основным элементом регуляции служат репрессорные белки, которые заставляют «молчать» специфические участки клеточной ДНК. Совершенно другим путем происходит регуляция белками процесса дифференцировки клеток, что видно на примере фактора роста нервов-белкового комплекса, под действием которого формируется сеть нейронов у высших организмов.
2.1. Белки построены из аминокислот
Основной структурной единицей белков являются аминокислоты. Каждая аминокислота состоит из аминогруппы, карбоксильной группы, атома водорода и определенной R-группы, присоединенной к атому углерода, называемому α-углеродом (рис. 2.5). R-группы называют боковой цепью по причинам, которые станут очевидными в ходе дальнейшего изложения. При нейтральном значении pH аминокислоты в растворах находятся не в виде неионизированных молекул, а преимущественно в виде биполярных ионов (цвиттерионов). При этом аминогруппа оказывается протонированной (—NH3+), а карбоксильная группа диссоциированной ( — СОО-). Ионизация аминокислоты зависит от значения pH (рис. 2.6). В кислых растворах (например, при pH 1) карбоксильная группа находится в неионизированной форме (—СООН), а аминогруппа ионизирована (—NH3+). В щелочных растворах (например, при pH 11), наоборот, ионизирована карбоксильная группа (—СОО-), а аминогруппа не ионизирована ( —NН2). Представления о роли pH и кислотно-щелочных свойствах аминокислот дополнительно обсуждаются в приложении к этой главе.
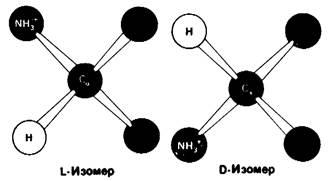
Расположение в виде тетраэдра четырех разных химических групп вокруг α-углеродного атома обусловливает оптические свойства аминокислот. Структуры, представляющие собой зеркальное отражение друг друга, называются L- и D-изомерами (рис. 2.7). В состав белков входят только L-аминокислоты. Поэтому в последующем изложении мы будем опускать обозначение изомера, имея в виду, что в тех случаях, когда речь идет о структуре белков, подразумеваются L-аминокислоты (за исключением специально оговоренных случаев).
Рис. 2.5. Структура аминокислоты в неионизированной форме и в форме цвиттериона
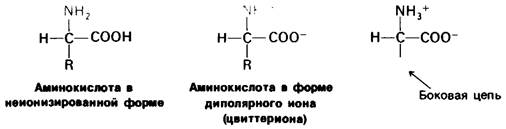
Рис. 2.6. Зависимость ионизации аминокислоты от значения pH
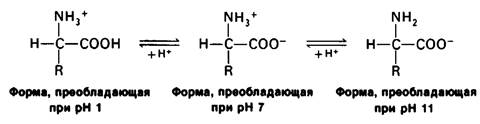
Рис. 2.7. Абсолютные конфигурации L- и D-изомеров аминокислот
В белках встречается 20 видов боковых аминокислотных цепей, различающихся по размерам, форме, способности образовывать водородные связи и химической реакционноспособности. Подчеркнем, что все белки всех видов живых существ- от бактерии до человека-построены из одного и того же набора 20 аминокислот. Этот универсальный белковый алфавит существует уже около 2 млрд. лет. Тот факт, что белки способны выполнять различные функции, обусловлен разнообразием и гибкостью свойств составляющих их 20 структурных элементов. В последующих главах мы увидим, как на основе этого алфавита возникают сложнейшие трехмерные структуры, благодаря которым белки способны участвовать в столь большом числе биологических процессов.
Рассмотрим этот набор аминокислот. Простейший в их ряду-глицин, у которого на месте боковой цепи находится атом водорода. У аланина боковая цепь представлена метальной группой. Валин, лейцин, изолейцин и пролин содержат углеводородные боковые цепи. Пролин, однако, отличается от других 19 аминокислот основного набора тем, что имеет вторичную, а не первичную аминогруппу. Строго говоря, пролин является имино- (а не амино-) кислотой. Боковая цепь в проли- не присоединена как к аминогруппе, так и к α-углероду, и в результате получается циклическая структура.
Две аминокислоты-серин и треонин-содержат алифатические гидроксильные группы.
Имеются три широко распространенные ароматические аминокислоты: фенилаланин, тирозин и триптофан.
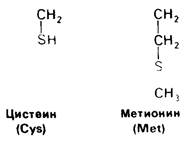
У всех вышеперечисленных аминокислот боковые цепи не несут заряда при физиологических значениях pH. Обратимся теперь к аминокислотам с заряженными боковыми цепями. При нейтральном значении pH лизин и аргинин несут положительный заряд, а гистидин - либо заряжен положительно, либо нейтрален в зависимости от микроокружения. Боковые цепи глутаминовой и аспарагиновой кислот несут отрицательный заряд. Далее мы будем называть эти аминокислоты соответственно глутамат и аспартат, подчеркивая тот факт, что при физиологических значениях pH они несут отрицательный заряд. Существуют незаряженные производные глутамата и аспартата-глутамин и аспарагин, которые вместо концевой карбоксильной группы содержат амидную группу. Наконец, у двух аминокислот в боковой цепи находится атом серы. Это метионин и цистеин (рис. 2.15). Как будет показано далее, цистеин во многих белках играет особую роль, обеспечивая образование поперечных дисульфидных связей.
Рис. 2.15. Цистеин и метионин имеют серусодержащие боковые цепи