БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.17. Согласованный механизм аллостерических взаимодействий
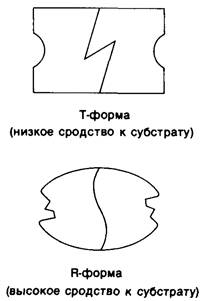
Изящную и четкую модель кинетики аллостерических ферментов предложили в 1965 г. Жак Моно, Джефри Уайман и Жан-Пьер Шанжё (1. Monod, J. Wyman, J.-P.Chan- geux). Используя их подход, рассмотрим аллостерический фермент, состоящий из двух идентичных субъединиц, каждая с одним активным центром. Допустим, что субъединицы могут находиться в двух конформациях-R и Т. Конформация R (relaxed -релаксированная) обладает высоким сродством к субстрату, тогда как конформация Т (tense-напряженная)-низким сродством (рис. 6.20). Вспомним, что так же обозначались две формы четвертичной структуры гемоглобина (разд. 4.10). Формы R и Т могут переходить одна в другую. В данной модели делается важное допущение, что для сохранения симметрии димера обе субъединицы должны находиться в одном и том же конформационном состоянии. Таким образом разрешены состояния RR и ТТ и не разрешено состояние RT. Символами R0и Т0 обозначают разрешенные состояния в отсутствие субстрата и L-соотношение их концентраций:
Ro ⇄ To, (27)
L = T0/R0. (28)
Чтоб упростить рассуждения, допустим, что субстрат не присоединяется к Т-форме фермента. В R-форме димер может связать одну или две молекулы субстрата; эти состояния обозначают соответственно R1 и R2:
R0+S ⇄ R1, (29)
R1+S ⇄ R2, (30)
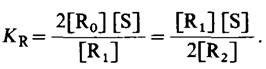 (31)
(31)
Согласно полученному уравнению, присоединение как первой, так и второй молекулы субстрата к R-форме димерного фермента имеет одну и ту же микроскопическую константу диссоциации КR. Коэффициент 2 в уравнении (31) указывает на то, что субстрат может связаться с любым из двух активных центров на R0 с образованием R1, и аналогичным образом субстрат может высвободиться из любого из активных центров на R2 с образованием R1.
Рис. 6.20. Схематическое изображение R- и Т-форм аллостерического фермента
Выразим степень насыщения У (т.е. долю активных центров, имеющих связанный субстрат) как функцию концентрации субстрата
 (32)
(32)
Произведя замены в этом уравнении в соответствии с уравнениями (27) и (31), получаем искомое выражение для У :
![]() (33)
(33)
Изобразим уравнение (33) графически, приняв KR=10-5М и L= 104. Зависимость У от [S] выражается сигмоидной, а не гиперболической кривой (рис. 6.23). Другими словами, это уравнение соответствует кооперативному связыванию субстрата. Если число оборотов в расчете на один активный центр одинаково для фермент-субстратных комплексов R1и R2, то график зависимости скорости реакции от концентрации субстрата также будет сигмоидным, поскольку
![]() (34)
(34)
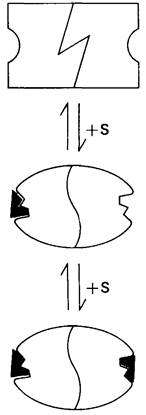
Рассмотрим теперь этот процесс связывания (рис. 6.21). В отсутствие субстрата почти все молекулы фермента находятся в Т-форме. В приведенном выше примере на 104молекул в Т-форме приходится только одна молекула в R-форме. Добавление субстрата сдвигает к он формационное равновесие в сторону образования R-формы, поскольку именно R-форма связывает субстрат. Когда субстрат присоединяется к одному активному центру, второй активный центр должен быть также в R-форме, согласно основному постулату данной модели. Другими словами, переход от Т к R и обратно все субъединицы фермента осуществляют согласованно. Следовательно, по мере добавления субстрата доля молекул фермента в R-форме прогрессивно возрастает и связывание субстрата происходит кооперативно. При полном насыщении активных центров все молекулы фермента оказываются в R-форме.
Рис. 6.21. Модель согласованного механизма кооперативного связывания субстрата аллостерическим ферментом. Присоединение первой молекулы субстрата сопровождается переходом ТТ-формы с низким сродством к субстрату в RR-форму с высоким сродством
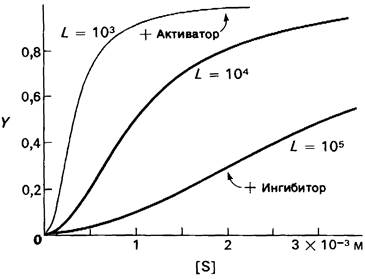
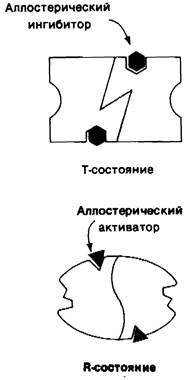
На основе модели согласованного механизма нетрудно объяснить влияние аллостерических ингибиторов и активаторов. Аллостерический ингибитор связывается преимущественно с Т-формой, тогда как аллостерический активатор связывается преимущественно с R-формой (рис. 6.22). Следовательно, аллостерический ингибитор сдвигает конформационное равновесие R ⇄ Т в сторону Т, а аллостерический активаторов сторону R. Эти эффекты можно выразить количественно через изменение константы аллостерического равновесия которая входит в виде переменной в уравнение (33). Аллостерический ингибитор повышает величину L, тогда как аллостерический активатор понижает ее. Эти влияния показаны на рис. 6.23, где У отложено против [S] при следующих значениях L : 103 (в присутствии активатора), 104 (без активатора и без ингибитора), 105 (в присутствии ингибитора). Степень насыщения γ при всех значениях [S] снижается в присутствии ингибитора и повышается в присутствии активатора.
Рис. 6.22. В соответствии с моделью согласованного механизма аллостерический ингибитор (изображен в виде шестиугольника) стабилизирует форму Т, тогда как аллостерический активатор (изображен в виде треугольника) стабилизирует форму R
Здесь полезно остановиться еще на двух понятиях: это гомотропные эффекты, которые представляют собой аллостерические взаимодействия между идентичными лигандами (связанными молекулами или ионами), и гетеротропные эффекты, т. е. взаимодействия между различными лигандами. В рассмотренном выше примере кооперативное связывание субстрата ферментом представляло собой гомотропный эффект. В отличие от этого влияние активатора или ингибитора на связывание субстрата является гетеротропным, поскольку в этом случае взаимодействие происходит между молекулами разного типа. При согласованном механизме аллостерических взаимодействий гомотропные эффекты всегда положительны (кооперативны), а гетеротропные- либо положительны, либо отрицательны.
Рис. 6.23. Насыщение γ как функция концентрации субстрата [S] в соответствии с моделью согласованного механизма [уравнение (33)]. Показано также влияние аллостерического ингибитора и активатора