БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.23. Вандерваальсовы взаимодействия играют важную роль в случаях стерической комплементарности
Если два каких-либо атома находятся на расстоянии 3-4 А друг от друга, то между ними возникает неспецифическое притяжение. Такое притяжение, называемое вандер- ваальсовым взаимодействием, менее специфично и значительно слабее, чем электростатические взаимодействия или водородные связи, однако оно имеет не менее важное значение в биологических системах. В основе возникновения вандерваальсовых взаимодействий лежит тот факт, что распределение электронного заряда вокруг атома меняется во времени. В любой взятый момент времени распределение заряда не является полностью симметричным. Эта преходящая асимметрия электронного заряда одного атома вызывает изменение распределения электронов вокруг соседних атомов. По мере сближения двух атомов до так называемого расстояния вандерваальсова контакта сила притяжения между ними возрастает (рис. 6.27). На расстоянии, более коротком, чем контактное, начинают преобладать очень большие силы отталкивания, поскольку происходит перекрывание двух внешних электронных облаков. Контактное расстояние между атомами кислорода и углерода, например, составляет 3,4 А, т. е. сумму контактных радиусов атома О (1,4 А) и С (2,0 А).
Рис. 6.27. Энергия связей, обусловленных вандерваальсовыми взаимодействиями, как функция расстояния между двумя атомами
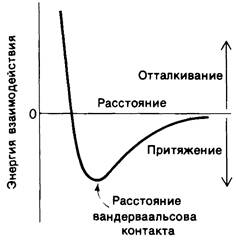
Энергия связи двух атомов, обусловленной вандерваальсовыми взаимодействиями, составляет около 1 ккал/моль. Это значительно меньше энергии водородных связей, а также связи, возникающей под влиянием электростатических сил, которая составляет 3-7 ккал/моль. Таким образом, одно отдельно взятое вандерваальсово взаимодействие имеет очень небольшое значение: сила возникающей связи едва превышает среднюю тепловую энергию молекул при комнатной температуре (0,6 ккал/моль). Вандерваальсовы взаимодействия приобретают большое значение только при одновременном сближении множества атомов субстрата с множеством атомов фермента. Вандерваальсово взаимодействие между двумя атомами резко уменьшается, если расстояние между ними превышает контактное всего лишь на 1 А. Поэтому одновременное взаимодействие многочисленных атомов субстрата со множеством атомов фермента возможно только при условии совпадения форм субстрата и фермента. Другими словами, эффективное вандерваальсово взаимодействие между субстратом и ферментом возможно лишь при наличии стерической комплементарности. Следовательно, хотя каждое отдельно взятое вандерваальсово взаимодействие неспецифично, специфичность возникает при одновременном образовании большого числа вандерваальсовых связей. Нужно отметить, что отталкивание, возникающее при сближении двух атомов на расстояние меньше вандерваальсова контактного, столь же необходимо для создания специфичности взаимодействия, как и притяжение.
6.24. Биологически важные свойства воды: полярность воды и ее способность к когезии
До сих пор мы не касались вопроса о том, как влияет вода на три основных типа связей, которые мы только что рассмотрели. На самом деле вода - активный участник молекулярных взаимодействий в биологических системах. В этом отношении два ее свойства имеют совершенно особое значение.
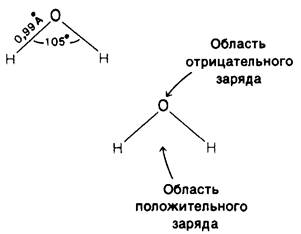
1. Молекулы воды полярны. Они имеют не линейную, а треугольную форму, вследствие чего распределение заряда оказывается асимметричным. Ядро атома кислорода оттягивает электроны от атомов водорода, и вокруг последних возникает область с общим положительным зарядом. Если вокруг атома кислорода описать тетраэдр так, чтобы в двух его углах находились атомы водорода, то два других угла тетраэдра окажутся электроотрицательными. Таким образом, молекула воды представляет собой полярную структуру:
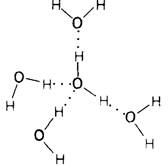
2. Молекулы воды обладают высоким сродством друг к другу. Группа молекул воды образует конгломерат, в котором область положительного заряда отдельной молекулы ориентируется относительно области с отрицательным зарядом одной из близлежащих молекул. Каждая из двух областей с отрицательным зарядом притягивает протон от соседней молекулы. В то же время их собственные протоны притягивают кислородный конец соседней молекулы. Таким образом, каждый атом кислорода является центром тетраэдра, образованного другими кислородами, причем расстояние О—О составляет 2,76 А.
На рис. 6.28 показана одна из структур льда. При таянии льда высокоупорядоченная структура его кристаллов разрывается во многих местах. Однако при этом разрушается лишь около 15% связей. В жидкой воде каждая молекула Н2О образует водородные связи в среднем с 3,4 соседних молекул. Таким образом, в жидком состоянии вода сохраняет частично упорядоченную структуру. Процесс образования и распада объединенных водородными связями агрегатов молекул воды идет беспрерывно. Самая удивительная особенность воды, это способность ее молекул соединяться друг с другом. И действительно, в воде число протонов и число свободных пар электронов, создающих соответственно положительные и отрицательные полюсы для образования водородных связей, всегда равны между собой. Расположение этих связей в виде тетраэдра приводит к образованию развитой трехмерной структуры. Таким образом, вода обладает высокой когезионной силой.
Рис. 6.28. Структура одной из форм льда