БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
ВОПРОСЫ И ЗАДАЧИ
1. В осуществлении биосинтетических реакций, например, синтеза ДНК, важную роль играет гидролиз пирофосфата до ортофосфата. У Е. coli этот гидролиз катализируется пирофосфатазой, имеющей мол. массу 120 к Да и состоящей из 6 идентичных субъединиц. Vmax очищенной пирофосфатазы составляет 2800 ед. на 1 мг белка. За единицу активности данного фермента принято количество фермента, гидролизующее 10 мкмоль пирофосфата за 15 мин при 37°С в стандартных условиях определения.
а) Сколько молей субстрата в секунду гидролизует 1 мг фермента, если концентрация субстрата значительно выше Км?
б) Сколько молей активных центров содержится в 1 мг фермента? Примем, что в каждой субъединице имеется по одному активному центру.
в) Каково число оборотов данного фермента? Сравните его с упомянутыми в этой главе числами оборота других ферментов.
2. Пенициллин гидролизуется и тем самым инактивируется пенициллиназой - ферментом, имеющимся у ряда резистентных бактерий. Молекулярная масса пенициллиназы из Staphylococcus aureus составляет 29,6 кДа. Измеряли количество пенициллина, гидролизуемого в 12 мл раствора в течение 1 мин в присутствии 10-9 г очищенной пенициллиназы как функцию концентрации пенициллина. Примем, что в ходе определения концентрация пенициллина практически не менялась.

а) Постройте по этим данным график в координатах 1/V против 1/[S]. Подчиняется ли пенициллиназа кинетике Михаэлиса-Ментен? Если да, то чему равна Км?
б) Чему равна Кmах?
в) Каково число оборотов пенициллиназы в этих экспериментальных условиях? Примем, что на одну молекулу фермента приходится один активный центр.
3. Измеряли кинетику ферментативной реакции в зависимости от концентрации субстрата в присутствии или в отсутствие ингибитора (I); были получены следующие данные:
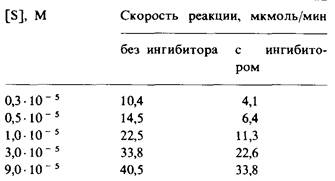
а) Чему равны Vmах и Км в отсутствие ингибитора? В присутствии его?
б) Каков тип ингибирования?
в) Чему равна константа связывания ингибитора?
г) Если [S] = 1 • 10-5 М и [I] = 2 • 10-3 М, то какова доля молекул фермента, связавших субстрат? Связавших ингибитор?
д) Если [S] = 3 • 10-5 М, то какова доля молекул фермента, связавших субстрат в присутствии 2 • 10- 3 М ингибитора и в отсутствие его? Сравните соотношение полученных величин с соотношением скоростей реакции при тех же условиях.
4. Анализировали кинетику фермента, рассмотренного в задаче 3, в присутствии другого ингибитора, добавленного в концентрации 10-4 М:
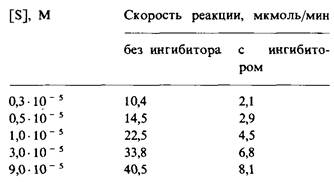
а) Каковы значения Vmах и Км в присутствии ингибитора? Сравните их с величинами, полученными в задаче 3.
б) Каков тип ингибирования?
в) Какова константа диссоциации этого ингибитора?
г) При [S] = 3 • 10-5 М какая доля молекул фермента связана с субстратом в присутствии 10-4 М ингибитора? В отсутствие его?
5. График в координатах 1/V против 1/[S] называют графиком Лайнуивера-Бёрка. Кинетические данные можно изобразить также в координатах V против V/[S], т. е. в координатах Эди — Хофсти.
а) Преобразуйте уравнение Михаэлиса- Ментен так, чтобы получить V как функцию V[S].
б) Каков физический смысл наклона кривой и точек ее пересечения с осью х и осью у на графике V против V[S]?
в) Изобразите, как должна выглядеть зависимость V от V[S] в отсутствие ингибитора, в присутствии конкурентного ингибитора, в присутствии неконкурентного ингибитора?
6. В случае аллостерических ферментов ингибитор в низких концентрациях часто оказывает активирующее действие. Почему? (Подсказка: подумайте об аналогии с СО-гемоглобином.)
7. Гормон прогестерон содержит две кетонные группы. О свойствах рецепторного белка, узнающего прогестерон, известно очень мало. Боковые цепи каких аминокислот могли бы образовать водородные связи с прогестероном при pH 7? (Примем, что боковые цепи в белке-рецепторе имеют те же значения рК, что и в свободных аминокислотах, растворенных в воде.)
8. Допустим, что субстраты А и В конкурируют за фермент. Составьте выражение, связывающее соотношение скоростей использования А и В (V/А/Vв) с концентрацией этих субстратов и с величинами их к3 и Км. (Подсказка: выразите VА как функцию к3/Км для субстрата А и затем сделайте то же для субстрата В.) Можно ли считать, что специфичность определяется только Км?