БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 9. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ: КОЛЛАГЕН, ЭЛАСТИН И ПРОТЕОГЛИКАНЫ
9.10. Дополнительные пептиды цепей-предшественников отщепляются ферментативно
Цепи про-α1 (I) и про-α2 синтезируются фибробластами и сек ретируются в межклеточное пространство соединительной ткани. Здесь дополнительные пептиды, стоящие на N- и С-концах этих цепей-предшественников, отщепляются специфическими протеолитическими ферментами - проколлаген-пептидазами.
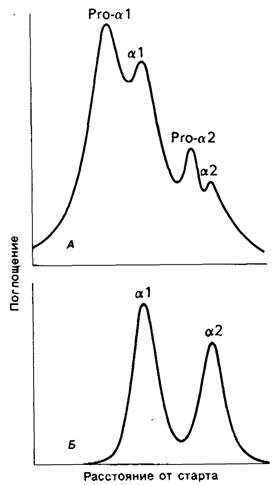
Нарушение превращения цепей-предшественников в α1 - и α2-цепи приводит к генерализованному повреждению соединительной ткани. Так, например, больные с синдромом Элерса-Данлоса отличаются малым ростом, повышенной растяжимостью кожи и избыточной гибкостью суставов. При одной из форм этого заболевания в экстрактах кожи и сухожилий больных обнаруживается значительное количество проколлагенов (рис. 9.14). Одновременно в фибробластах выявляется снижение проколлаген-пептидазной активности. Известно также наследственное (наследуемое по рецессивному типу) заболевание крупного рогатого скота - дерматоспараксис, которое обусловлено отсутствием проколлаген-пептидазы. Кожа животных в этом случае становится крайне хрупкой, так как нити коллагена находятся в ней в виде дезорганизованных пучков. При этом значительная часть имеющегося зрелого коллагена типа I содержит α1 (I)- и α2-цепи с сохранившимися N-концевыми пептидами проколлагена. Все изложенное показывает, что отщепление N-концевых пептидов необходимо для формирования упорядоченных коллагеновых фибрилл.
Рис. 9.14. Электрофоретическое разделение экстракта кожи в полиакриламидном геле. В кислых экстрактах кожи больных с синдромом Элерса-Данлоса типа VII (А) присутствует значительное количество проколлагена (про-α1 и про-α2). В норме (В) проколлаген отсутствует
9.11. Коллагеновое волокно состоит из ступенчато расположенных молекул гропоколлагена
Образование коллагенового волокна происходит во внеклеточном пространстве в результате спонтанного, специфического соединения между собой тропоколлагеновых фибрилл. Структура коллагенового волокна была изучена методами рентгеноструктурного анализа и электронной микроскопии. Коллагеновое волокно имеет поперечную исчерченность с интервалом 680 А (см. рис. 9.1). В то же время длина молекулы тропоколлагена составляет 3000 А. Таким образом, период структуры волокна в несколько раз меньше, чем длина составляющих волокно молекул; это показывает, что ряды молекул тропоколлагена не могут лежать точно друг над другом. И в самом деле, один ряд тропоколлагенов смещен по отношению к соседнему ряду примерно на 1/4 длины молекулы. Отсюда следует, что основу структурной организации коллагенового волокна составляют сдвинутые на четверть ступенчато расположенные параллельные ряды тропоколлагеновых молекул (рис. 9.15). Такая «аранжировка» напоминает музыкальную фугу (рис. 9.16).
Рис. 9.15. Схематическое изображение структурной организации коллагенового волокна. Молекулы тропоколлагена (показаны синими стрелками) расположены рядами, последовательно смещенными на 1/4 одна по отношению к другой. Промежутки в рядах между молекулами тропоколлагена (показаны красными квадратами) могут служить центрами кальцификации при формирование кости
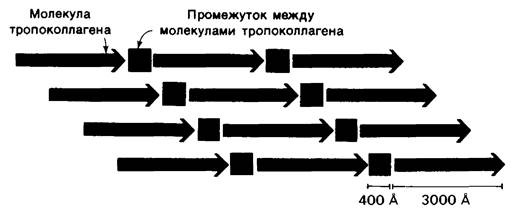
Рис. 9.16. Пассаж из фуги D-мажор, «Хорошо темперированный клавир» И. С. Баха

Любопытная структурная особенность волокна состоит в том, что расположенные в ряд молекулы тропоколлагена не связаны «конец в конец». Между концом одной молекулы и началом следующей имеется промежуток около 400 А (рис. 9.15). Этот промежуток играет особую роль при формировании кости. Кость состоит из органической фазы, почти целиком представленной коллагеном, и неорганической, а именно фосфата кальция. Последний по своему строению близок к гидроксиапатиту с составом Са10 (РO4)6 (ОН)2. Коллаген необходим для образования кости как место отложения кристаллов фосфата кальция. Оказалось, что первые кристаллы откладываются с интервалом порядка 680 А, что совпадает с периодом коллагенового волокна. Вполне вероятно, что промежутки вдоль ряда молекул тропоколлагена выполняют роль центров отложения минеральных составных частей кости.
9.12. Образование коллагенового волокна регулируется проколлаген-пептидазами
Молекулы проколлагена в отличие от тропоколлагена не способны к спонтанному образованию волокна: для этого необходимо предварительное отщепление N- и С- концевых пептидов. Таким образом, формирование коллагеновых волокон аналогии по формированию нитей фибрина. Проколлаген аналогичен фибриногену, тропоколлаген - мономерам фибрина, а проколлаген-пептидазы -тромбину. В обеих системах условием образования волокна является специфическое протеолитическое расщепление.
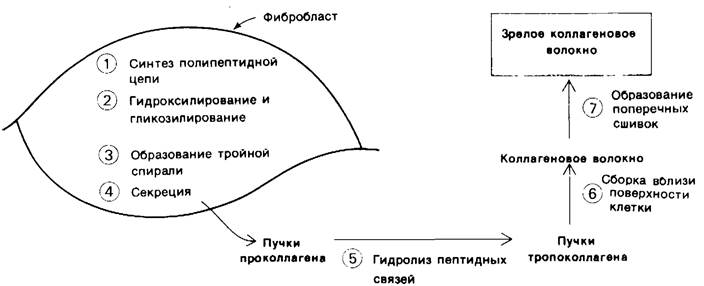
Фибробласты секретируют проколлаген, но не тропоколлаген (рис. 9.17). Механизмы биосинтеза и секреции аналогичны тем, которые действуют в случае проферментов поджелудочной железы (разд. 8.1) и других секреторных белков (разд. 29.29). Коллагеновое волокно формируется во внеклеточной жидкости вблизи поверхности фибробласта, но не внутри него, поскольку проколлаген-пептидазы находятся вне клетки. Концевые пептиды в цепях-предшественниках препятствуют несвоевременному формированию волокна. Возможно также, что они участвуют в переносе проколлагена через мембрану фибробласта. На более раннем внутриклеточном этапе эти дополнительные пептиды способствуют взаимной ориентации и соединению трех цепей для последующего образования тройной спирали. Особое значение при этом имеют межцепочечные дисульфидные связи.
Рис. 9.17. Этапы формирования зрелого коллагенового волокна
9.13. Поперечные связи повышают прочность коллагенового волокна
Коллаген, подобно фибрину, стабилизирован ковалентными поперечными связями. Коллагеновым волокнам свойственно два типа поперечных связей: внутримолекулярные (в пределах одной тропоколлагеновой единицы) и межмолекулярные (между отдельными тропоколлагеновыми единицами). Рассматриваемые связи встречаются только в двух близких белках - коллагене и эластине.
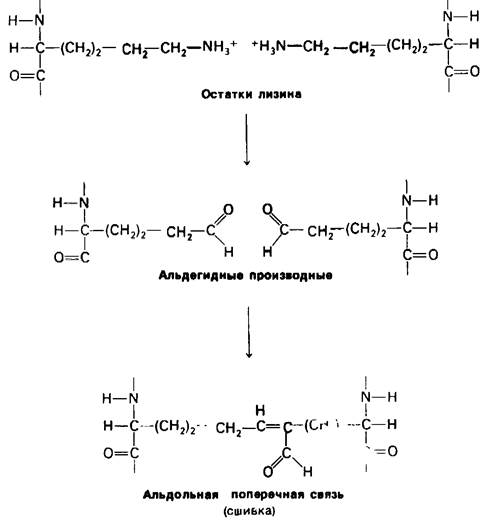
В образовании внутримолекулярных поперечных связей в коллагене участвуют боковые цепи лизина. На первом этапе происходит превращение ε-аминоконца лизина в альдегид под действием фермента лизилоксидазы. Далее два альдегида вступают в реакцию альдольной конденсации (рис. 9.18). При этой реакции енолат-ион, образовавшийся из одного альдегида, присоединяется к карбонильной группе другого альдегида. Интересна локализация этой внутримолекулярной поперечной связи. В последовательности аминокислот аминоконцевого участка α1 (I)-цепи коллагена глицин становится каждым третьим остатком, лишь начиная с положения 13. Следовательно, лизин-5 находится в неспирализованной области полипептидной цепи, вблизи начала тройной спирали. Гибкость этого неспира- лизованного фрагмента способствует формированию рассматриваемой поперечной связи.
Рис. 9.18. Образование альдольной поперечной сшивки из двух боковых цепей лизина
Альдольная поперечная связь может превращаться - в результате взаимодействия с боковой цепью хистидина в гистидинальдольную поперечную связь (рис. 9.19). Альдегидная группа этого альдоль-гистидинового комплекса способна давать шиффово основание с друюй боковой цепью, такой, как боковая цепь гидроксилизина. В итоге возможно ковалентное связывание четырех боковых цепей друг с другом, причем некоторые из этих цепей могут принадлежать разным молекулам тропоколлагена (рис. 9.20).
Рис. 9.19. Боковая цепь гистидина может присоединяться по месту двойной связи С=С в альдольной сшивке, при этом образуется гистидин-альдольная поперечная сшивка
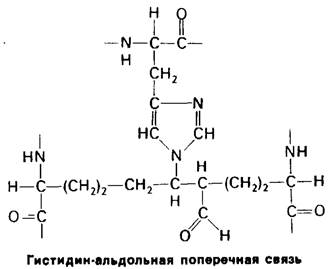
Рис. 9.20. Внутри- и межмолекулярные поперечные связи в коллагене
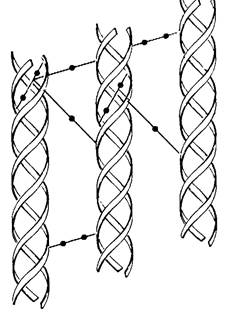
Количество и тип поперечных связей в коллагене зависят от функции и возраста ткани. Так, коллаген ахиллесова сухожилия крысы характеризуется большим количеством поперечных связей, а в коллагене более эластичного сухожилия хвоста их гораздо меньше. Значение поперечных связей, придающих волокнам коллагена высокую степень упругости, ясно выступает при латиризме- заболевании животных, вызванном поеданием семян сладкого горошка Lathyis odoratus. Токсическим агентом в этом случае является β-аминопропионитрил, подавляющий превращение боковой цепи лизина в альдегид. Под действием этого токсина коллаген заболевших животных теряет механическую прочность.
![]()