БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 23. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
23.4. Ключевые соединения: глюкозо-6-фосфат, пируват и ацетил-СоА
Факторы, определяющие потоки молекул в метаболических путях, можно описать подробнее, проанализировав три важнейших метаболита, на уровне которых происходит пересечение метаболических путей: глюкозо-6-фосфат, пируват и ацтил-СоА. Каждое из этих соединений имеет несколько альтернативных путей превращений.
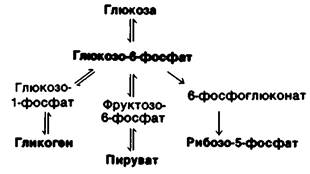
1. Глюкозо-6-фосфат. Глюкоза, поступающая в клетку, быстро фосфорилируется до глюкозо-6-фосфата, который может затем запасаться в виде гликогена, расщепляться до пирувата или превращаться в ри- бозо-5-фосфат (рис. 23.10). Гликоген образуется в условиях избытка глюкозо-6-фосфата и АТР. Если же АТР и углеродные скелеты молекул расходуются на биосинтетические реакции, глюкозо-6-фосфат вступает в реакции гликолитического пути. Таким образом, превращение глюкозо- 6-фосфата в пируват может быть, как анаболическим, так и катаболическим процессом. Третий вариант использования глю- козо-6-фосфата, пентозофосфатный путь, поставляет NADPH для восстановительных реакций биосинтеза и рибозо-5-фосфат для синтеза нуклеотидов. Относительные количества этих двух продуктов могут варьировать в очень широких пределах благодаря исключительной гибкости данной последовательности реакций, как это уже обсуждалось выше (разд. 15.6). Глюкозо-6- фосфат может образовываться либо при мобилизации гликогена, либо из пирувата и других неуглеводных предшественников в результате реакций глюконеогенеза. Чуть ниже мы увидим, что низкая концентрация глюкозы в крови стимулирует как гликогенолиз, так и глюконеогенез в печени и почках. Эти органы отличаются тем, что содержат глюкозо-6-фосфатазу, благодаря которой глюкоза может выделяться в кровь.
Рис. 23.10. Метаболические превращения глюкозо-6-фосфата
2. Пируват. Эта трехуглеродная α-оксо- кислота также лежит в точке пересечения главных метаболических путей (рис. 23.11). Пируват образуется главным образом из глюкозо-6-фосфата, лактата и аланина. Лактат-просто восстановленная форма пиру- вата. Пиру ват легко восстанавливается под действием лактат-дегидрогеназы. Данная реакция обеспечивает регенерирование NAD+, что позволяет гликолизу непрерывно протекать в анаэробных условиях. Лактат, образующийся в активных тканях, например, в сокращающихся мышцах, впоследствии снова окисляется до пирувата. Этот процесс идет главным образом в печени. Смысл этих превращений состоит в том, что они позволяют выиграть время и перемещают часть отходов метаболизма активно работающей мышцы в печень. Еще одна легко обратимая реакция, идущая в цитозоле, трансаминирование α-ок- сокислоты пирувата с образованием соответствующей аминокислоты-аланина. Таким путем некоторые аминокислоты могут вступать в реакции основных метаболических путей. Наряду с этим, некоторые аминокислоты могут таким образом синтезироваться из углеводных предшественников. Следовательно, трансаминирование- основная реакция, связывающая метаболизм аминокислот и углеводов. Третий способ использования пирувата-его карбоксилирование внутри митохондрий с образованием оксалоацетата. Эта реакция и последующее превращение оксалоацетата в фосфоенолпируват идут в обход необратимой стадии гликолиза и позволяют синтезировать глюкозу из пирувата. Кроме того, карбоксилирование пирувата играет важную роль в пополнении промежуточных продуктов цикла трикарбоновых кислот. Активация пируват-карбоксилазы под действием ацетил-СоА усиливает синтез оксалоацетата. Когда цикл трикарбоновых кислот замедляется из-за истощения этого метаболита. С другой стороны, если цикл трикарбоновых кислот ингибируется избытком АТР, оксалоацетат, синтезированный из пирувата, включается в последовательность реакций глюконеогенеза. Четвертая важная реакция, в которую вступает пируват, окислительное декарбоксилирование с образованием ацетил-СоА. Эта необратимая реакция, протекающая в митохондриях, решающий этап метаболизма: она направляет атомы углерода углеводов и аминокислот на путь окисления в цикле трикарбоновых кислот или синтеза липидов. Комплекс пируват-дегидрогеназы, катализирующий эту необратимую стадию, строго регулируется многочисленными аллостерическими взаимодействиями и ковалентными модификациями. Пируват превращается в ацетил-СоА с высокой скоростью, только если клетке необходимы АТР или двухуглеродные фрагменты для синтеза липидов.
Рис. 23.11. Метаболические превращения пирувата и ацетил-СоА
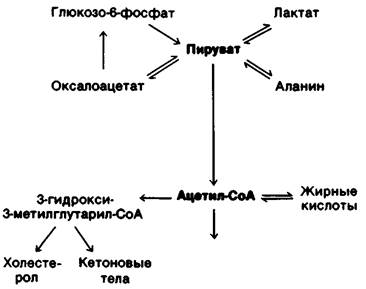
3. Ацетил-СоА. Основные источники этого активированного двухуглеродного фрагмента - окислительное декарбоксилирование пирувата и β-окисление жирных кислот (рис. 23.11). Кроме того, ацетил-СоА образуется из кетогенных аминокислот.
Судьба ацетил-СоА в метаболизме в отличие от многих других молекул строго определена. Ацетильный остаток может быть полностью окислен до СO2 в цикле трикарбоновых кислот. Другая возможность - образование З-гидрокси-З-метилглу- тарил-СоА из трех молекул ацетил-СоА. Это шестиуглеродное соединение - предшественник холестерола и кетоновых тел. Третий важный путь использования ацетил-СоА-его экспорт в цитозоль в виде цитрата для синтеза жирных кислот. Важно еще раз подчеркнуть, что в организме млекопитающих ацетил-СоА не может превращаться в пируват. Следовательно, у млекопитающих липиды не могут превращаться в углеводы.
23.5. Метаболические особенности основных органов
Метаболизм в мозгу, мышцах, жировой ткани и печени сильно различается. Рассмотрим различия между этими органами в отношении использования богатых энергией молекул.
1. Мозг. Глюкоза-практически единственный источник энергии в мозгу человека, за исключением условий продолжительного голодания. В мозгу нет запасов богатых энергией молекул, поэтому он нуждается в постоянном поступлении глюкозы. Мозг поглощает около 120 г глюкозы в сутки, что соответствует в энергетическом выражении 420 ккал. В состоянии покоя мозг расходует около 60% того количества глюкозы, которое в целом потребляется в организме. При голодании глюкозу в качестве источника энергии для мозга заменяют кетоновые тела (ацетоацетат и его восстановленный аналог 3-гидроксибу- тират). Ацетоацетат активируется путем переноса СоА с молекулы сукцинил-СоА; при этом образуется ацетоацетил-СоА (рис. 23.12). Затем расщепление тиолазой дает две молекулы ацетил-СоА, которые включаются в цикл трикарбоновых кислот. Жирные кислоты не могут служить источником энергии для мозга, так как они связаны с альбумином и неспособны проникнуть через гематоэнцефалический барьер. Итак, кетоновые тела-транспортабельный эквивалент жирных кислот. Чуть ниже мы обсудим, почему использование в качестве энергетических ресурсов не глюкозы, а кетоновых тел имеет важное значение для того, чтобы свести к минимуму распад белков во время голодания.
Рис. 23.12. Включение кетоновых тел в цикл трикарбоновых кислот
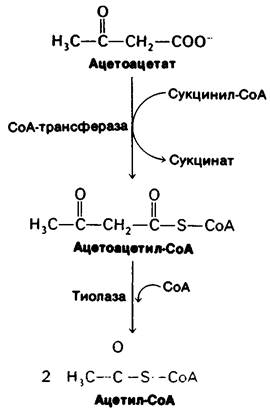
Рис. 23.13. Обмен метаболитами между мышцами и печенью
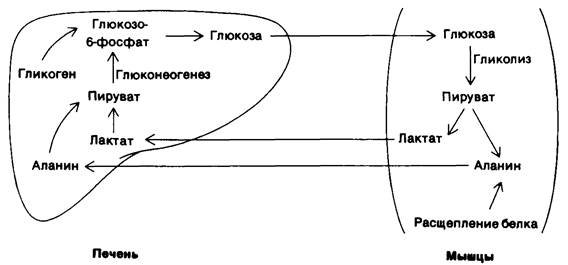
Таблица 23.1. Энергетические ресурсы у среднего мужчины весом 70 кг
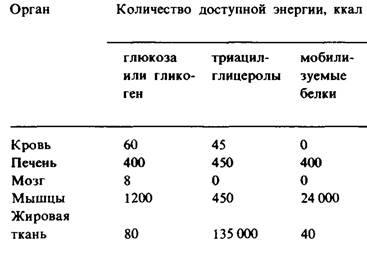
2. Мышцы. Основные источники энергии в мышцах-глюкоза, жирные кислоты и кетоновые тела. Мышцы отличаются от мозга большим запасом гликогена (1200 ккал). Около трех четвертых всего гликогена организма находится в мышцах (табл. 23.1). Содержание гликогена в мышцах после еды может достигать 1%. Этот гликоген легко превращается в глюкозо-6- фосфат для последующего использования в мышечных клетках. В мышцах, как и в мозгу, глюкозо-6-фосфатазы нет, в связи с чем экспорта глюкозы из этих клеток не происходит. Вместо этого мышцы задерживают глюкозу, которую они предпочитают другим источникам энергии в периоды повышенной активности. В активно сокращающихся скелетных мышцах скорость гликолиза сильно превосходит скорость цикла трикарбоновых кислот. Пируват, образующийся в этих условиях, большей частью восстанавливается до лактата. Лактат переходит в печень, где он превращается в глюкозу. В результате этих превращений, называемых циклом Кори (разд. 15.21), часть метаболических отходов мышц перемещается в печень. Кроме того, в активно работающей мышце образуется большое количество аланина в результате транс- аминирования пирувата. Подобно лактату, аланин может превращаться в печени в глюкозу. Совершенно иначе организован метаболизм покоящейся мышцы. В ней основным источником энергии служат жирные кислоты. Источником энергии для сердечной мышцы могут служить также кетоновые тела. Более того, сердечная мышца предпочитает ацетоацетат глюкозе.
3. Жировая ткань. Запасы триацилглицеролов в жировой ткани содержат огромный резерв метаболической энергии. Он составляет 135000 ккал в организме среднего взрослого мужчины весом 70 кг, Жировая ткань специально приспособлена для этерификации жирных кислот и их высвобождения из триацилглицеролов. У человека основное место синтеза жирных кислот-печень; поэтому важнейшая биохимическая функция жировй ткани состоит в активации этих жирных кислот и в переносе активированных СоА-производных на гли- церол. Глицерол-З-фосфат, ключевой промежуточный продукт этого биосинтеза (разд. 20.1), получается при восстановлении дигидроксиацетонфосфата, который образуется из глюкозы в результате гликолиза. Клетки жировой ткани неспособны фосфорилировать эндогенный глицерол, так как не содержат соответствующей киназы. Поэтому для синтеза триацилглицеролов жировым клеткам необходима глюкоза. Триацилглицеролы гидролизуются до жирных кислот и глицерола под действием липаз. Реакция, лимитирующая скорость всего процесса, освобождение первой жирной кислоты из триацилглицерола. Его катализирует гормон-зависимая липаза, которая может обратимо фосфорилироваться. Как и при метаболизме гликогена, с АМР выступает в качестве посредника, запускаемого гормоном усиливающего каскада. Триацилглицеролы в жировой ткани постоянно гидролизуются и ресинтезируются. Глицерол, образующийся при гидролизе, переносится в печень. Если глицерол-3-фосфат имеется в избытке, жирные кислоты снова подвергаются этерификации. Если же вследствие недостатка глюкозы создается дефицит глицерол-3-фосфата, они выделяются в плазму крови. Таким образом, концентрация глюкозы в жировых клетках - основной фактор, от которого зависит выделение жирных кислот в кровь.
Рис. 23.14. Синтез и расщепление триацилглицеролов в жировой ткани. Жирные кислоты поступают в жировую ткань в виде липопротеинов очень низкой плотности (ЛОНП)
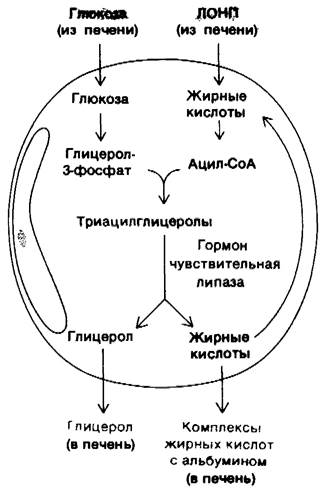
Рис. 23.15. Электронная микрофотография части клетки печени, активно участвующей в синтезе и секреции частиц липопротеинов очень низкой плотности (ЛОНП). Стрелкой отмечен пузырек, выбрасывающий свое содержимое-частицы ЛОНП
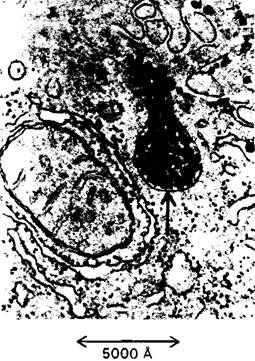
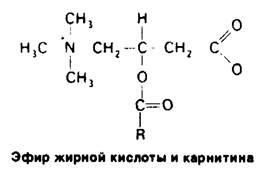
4. Печень. Метаболическая активность печени обеспечивает источниками энергии мозг, мышцы и другие периферические органы. Вещества, всасываемые в кишечнике, попадают главным образом в печень, что позволяет ей регулировать концентрацию в крови многих метаболитов. Печень поглощает большое количество глюкозы и превращает ее в гликоген. Таким образом, она способна запасать до 400 ккал. Печень может выделять глюкозу в кровь, расщепляя гликоген, в виде которого глюкоза запасается, или осуществляя глюконеогенез. Основные предшественники глюкозы-лактат и аланин, поступающие из мышц, глицерол-из жировой ткани и глюкогенные аминокислоты, поступающие с пищей. Кроме того, печень играет главную роль в регуляции липидного метаболизма. Когда в организме имеется избыток источников энергии, жирные кислоты синтезируются в печени, этерифицируются и секретируются в кровь в виде липопротеинов очень низкой плотности (ЛОНП) (рис. 23.15). Эти липопротеины плазмы-основной источник жирных кислот, используемых жировой тканью для синтеза триацилглицеролов. В то же время в условиях голодания печень превращает жирные кислоты в кетоновые тела. Как же клетки печени выбирают один из этих взаимоисключающих путей? Выбор зависит от того, должны ли жирные кислоты проникать в митохондриальный матрикс. Напомним, что жирные кислоты с длинной цепью проходят через внутреннюю митохондриальную мембрану только в том случае, если они связаны эфирной связью с карнитином (разд. 17.7). Фермент, катализирующий образование ацилкарнитина на наружной поверхности этой мембраны, ингибируется малонил-СоА - промежуточным продуктом, определяющим дальнейшую последовательность реакций в синтезе жирных кислот. Таким образом, при синтезе жирных кислот с длинной цепью они не проникают в митохондриальный матрикс-компартмент, где происходит β - окисление и образование кетоновых тел. Эти жирные кислоты включаются в триацилглицеролы и фосфолипиды. Если же источников энергии недостаточно, концентрация малонил-СоА, напротив, понижается. В этих условиях жирные кислоты, выделяющиеся из жировой ткани, проникают в митохондриальный матрикс для последующего превращения в кетоновые тела. Как печень обеспечивает свои энергетические потребности? Сама она в качестве источника энергии предпочитает глюкозе кетокислоты, образующиеся при распаде аминокислот. Действительно, основное назначение гликолиза в печени-образование строительных блоков для биосинтезов. К тому же печень не может использовать в качестве источника энергии ацетоацетат, так как она не содержит трансферазу, необходимую для его активации путем образования ацетил-СоА. Таким образом, печень избегает тех источников энергии, которые она отправляет в мышцы и мозг- прямо-таки альтруистический орган!
Рис. 23.16. Электронная микрофотография частиц липопротеинов очень низкой плотности (ЛОНП). Эти частицы имеют диаметр от 300 до 800 А; они переносят триацилглицеролы из печени в жировую ткань