БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 11 МЕТАБОЛИЗМ: ОСНОВНЫЕ ПОЛОЖЕНИЯ И ОБОЗНАЧЕНИЯ
11.7. Гидролиз АТР сдвигает равновесие сопряженных реакций в 108 раз
Чтобы лучше понять роль АТР в сопряжении энергии, следует проанализировать химическую реакцию, которая термодинамически невозможна без притока свободной
энергии. Предположим, что стандартная свободная энергия превращения А в В равна + 4 ккал/моль:
А ⇄ В ∆G0' = +4 ккал/моль.
В соответствии с уравнением (13) (разд. 11.2) константа равновесия Кeq этой реакции при 25°С выражается отношением
![]()
Таким образом, А не может спонтанно превратиться в В, если молярное отношение В к А равно или больше 1,15 • 10-3. Однако превращение А в В возможно и в том случае, если отношение [В]/[А] превышает 1,15 • 10-3 при условии, что реакция сопряжена с гидролизом АТР. Суммарное уравнение этой новой реакции будет иметь следующий вид:
А + АТР + Н2O ⇄ В + ADP + Рi + Н+
∆G0' = — 3,3 ккал/моль.
Указанное изменение стандартной свободной энергии (- 3,3 ккал/моль) представляет собою сумму ∆G0' для превращения А в В (+ 4 ккал/моль) и для гидролиза АТР (- 7,3 ккал/моль). Константа равновесия этой сопряженной реакции выражается отношением:

В состоянии равновесия отношение [В] к [А] дается уравнением
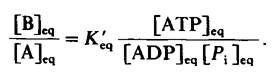
Система генерирования АТР в клетках поддерживает отношение [ATP]/[ADP] • [Pi] на высоком уровне, обычно порядка 500. Для такого отношения
![]()
Это означает, что гидролиз АТР обеспечивает возможность превращения А в В до тех пор, пока отношение [В]/[А] не достигнет значения 1,34 • 105. Указанное равновесное отношение резко отличается от значения 1,15 • 10-3 для реакции А ⇄ В в отсутствие гидролиза АТР. Другими словами, сопряженный гидролиз АТР изменил равновесное отношение В к А примерно в 108 раз.
Мы видим, таким образом, что термодинамическая сущность роли АТР-это функционирование в качестве энергосопрягающего агента. Клетки поддерживают содержание АТР на высоком уровне, используя свет и окисляемые субстраты в качестве источников свободной энергии. Гидролиз одной молекулы АТР резко сдвигает равновесное отношение концентрации продуктов к концентрации реагирующих веществ в сопряженной реакции-примерно в 10 раз. В более общем выражении гидролиз п молекул АТР изменяет равновесное отношение сопряженной реакции (или последовательности реакций) в 108n раз. Например, гидролиз трех молекул АТР в сопряженной реакции изменяет равновесное отношение в 1024 раз. Таким образом, термодинамически невыгодная последовательность реакций может быть превращена в термодинамически выгодную путем сопряжения с гидролизом достаточно большого количества молекул АТР. Надо также подчеркнуть, что А и В в предыдущем уравнении сопряженной реакции имеют очень общее значение. Например, А и В могут представлять различные конформации белка (например, при мышечном сокращении). В других случаях символы А и В могут относиться к концентрациям ионов или молекул вне и внутри клетки, как при активном транспорте пищевых веществ. Кроме того, А и В могут обозначать различные химические категории, в частности при биосинтезе сложных молекул из простых предшественников. В последующих главах мы рассмотрим многие важные механизмы сопряжения энергии в биологических процессах.
11.8. NADH и FADH2- основные переносчики электронов при окислении топливных молекул
Хемотрофы получают свободную энергию в результате окисления молекул, выполняющих роль топлива, таких, как глюкоза и жирные кислоты. У аэробных организмов единственным акцептором электронов является O2. Однако электроны не переносятся прямо на O2 от топливных молекул и продуктов их распада. Эти соединения
переносят электроны к специальным переносчикам-либо пиридиннуклеотидам, либо флавинам. Восстановленные формы переносчиков доставляют затем свои обладающие высоким энергетическим потенциалом электроны к O2 по цепи переноса электронов, локализованной во внутренней мембране митохондрий. Перенос электронов по цепи сопровождается образованием АТР из ADP и Pi. Этот процесс, называемый окислительным фосфорилированием (гл. 14), служит основным источником АТР у аэробных организмов. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении топливных молекул, могут быть использованы в процессах биосинтеза, для осуществления которых помимо АТР требуются восстановительные эквиваленты.
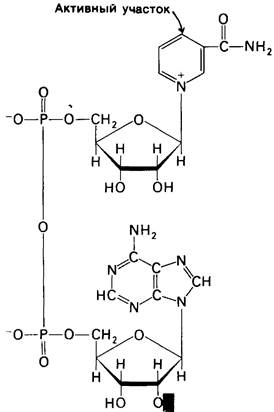
Никотинамидадениндинуклеотид (NAD+) - главный акцептор электронов при окислении топливных молекул (рис. 11.8). Реакционноспособная часть NAD+-ero никотинамидное кольцо. При окислении субстрата никотинамидное кольцо NAD+ присоединяет ион водорода и два электрона, которые являются эквивалентами гидрид- иона. Восстановленная форма этого переносчика-NADH.
Рис. 11.8. Строение окисленной формы никотинамидадениндину- клеотида (NAD+) и никотин- амидадениндинуклеотид фосфата (NADР+). В NAD+ R = Н; в NADP+ = РО23-
NAD+-акцептор электронов во многих реакциях типа
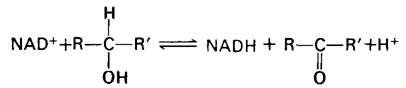
В ходе этого дегидрирования один атом водорода субстрата прямо переносится на NAD+, тогда как второй переходит в растворитель. Оба электрона, теряемые субстратом, переносятся на никотинамидное кольцо.
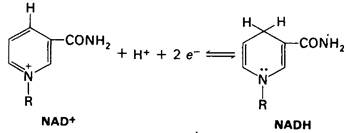
Второй основной переносчик электронов при окислении топливных молекул -флавинадениндинуклеотид (рис. 11.9). Сокращения, используемые для обозначения окисленной и восстановленной форм этого переносчика, соответственно FAD и FADH2. FAD является акцептором электронов в реакциях типа
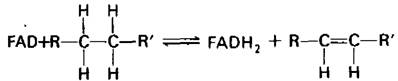
Рис. 11.9. Строение окисленной формы флавинадениндинуклеотида (FAD)
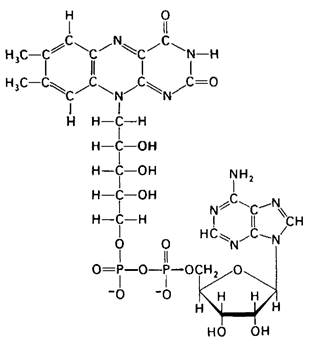
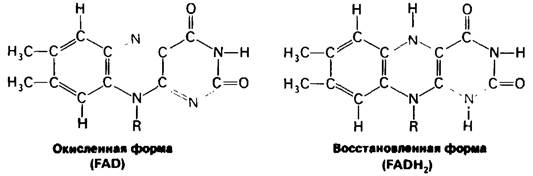
Реакционноспособная часть FAD-это его изоаллоксазиновое кольцо (рис. 11.10). FAD, подобно NAD+, присоединяет два электрона. Однако PAD в отличие от NAD + присоединяет оба теряемых субстратом атома водорода. Потенциалы переноса групп у NADH и FADH2 и термодинамика окислительно-восстановительных реакций рассматриваются в гл. 14.
Рис. 11.10. Строение реакционноспособных частей FAD+ иFADH2
11.9. NADPH-главный донор электронов в восстановительном биосинтезе
Соединения, играющие в биосинтетических путях роль предшественников, бывают, как правило, окислены сильнее, чем продукты реакции. Поэтому для осуществления процессов биосинтеза кроме АТР необходимо наличие восстановительною эквивалента. Например, при биосинтезе жирных кислот оксогруппа добавленного С2-предшественника восстанавливается в несколько стадий в метиленовую группу. Эта последовательность реакций требует присоединения четырех электронов
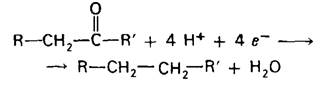
Роль донора электронов в большинстве процессов восстановительного биосинтеза выполняет восстановленная форма никотин- амидадениндинуклеогидфосфата (NADPH; рис. 11.8). NADPH отличается от NADH наличием фосфата, связанного эфирной связью с 2'-гидроксильной группой аденозина. Окисленная форма NADPH обозначается как NADP+. NADPH переносит электроны таким же образом, как NADH.
Однако NADPH используется почти исключительно в процессах восстановительного биосинтеза, тогда как NADH используется преимущественно для генерирования АТР.Дополнительная фосфатная группа NADPH, это участок, ответственный за осуществление целевого предназначения молекулы, состоящего в распознавании ферментами. Биологическое значение разграничения функций между NADPH и NADH рассматривается в гл. 15 (стр. 95).
Важно отметить, что NADH, NADPH и FADH2 в отсутствие катализаторов реагируют с O2 очень медленно. Гидролиз АТР в отсутствие катализатора также идет с низкой скоростью. Данные молекулы кинетически совершенно стабильны, хотя существует большая термодинамическая движущая сила для реакции указанных переносчиков электронов с O2 и для реакции АТР с водой. Стабильность этих молекул в отсутствие специфических катализаторов имеет существенное значение для их биологической функцииt поскольку она обеспечивает возможность ферментативной регуляции тока свободной энергии и восстановительных эквивалентов.