БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 15. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ И ГЛЮКОНЕОГЕНЕЗ
15.11. Недостаточность глюкозоб-фосфат—дегидрогеназы - причина лекарственной гемолитической анемии
Начало применения противомалярийного препарата памахина (pamaquine) относится к 1926 г. Большинство больных переносило этот препарат хорошо, но у незначительной части больных в течение нескольких дней после начала лечения развивались острые патологические симптомы. Моча становилась черной, развивалась желтуха, резко падало содержание гемоглобина в крови. В некоторых случаях происходило обширное разрушение эритроцитов, вызывавшее смерть больных.
Причина этой лекарственной гемолитической анемии была раскрыта в 1956 г. Первичное нарушение - недостаточность глюкозо-6-фосфат—дегидрогеназы в эритроцитах. Пентозофосфатный путь-единственный источник NADPH в этих клетках, поэтому при недостаточности глюкозо-6- фосфат—дегидрогеназы образование
NADPH уменьшается. Главная роль NADPH в эритроцитах состоит в восстановлении дисульфидной формы глутатиона в сульфгидрильную форму. Эта реакция катализируется глутатионредуктазой.
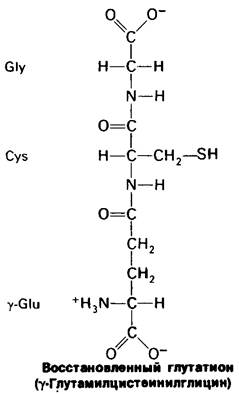
Восстановленная форма глутатиона, три- пептид со свободной сульфгидрильной группой, служит в качестве сульфгидрильного буфера, поддерживающего в восстановленном состоянии цистеиновые остатки гемоглобина и других белков эритроцитов.
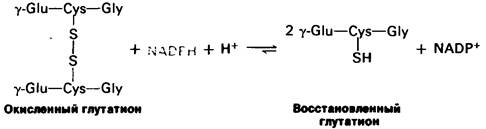
Соотношение восстановленной (Г-SH) и окисленной (Г-SS-Г) форм глутатиона составляет в норме около 500. Восстановленная форма глутатиона играет также определенную роль в процессах детоксикации, реагируя с перекисью водорода и органическими перекисями:
2Г-SH + R—О—ОН →Г- SS - Г - Н2О + ROH.
Восстановленный глутатион имеет также важное значение для поддержания нормальной структуры эритроцитов и для сохранения гемоглобина в ферроформе. Клетки со сниженным содержанием восстановленного глутатиона обладают повышенной чувствительностью к гемолизу, причина которой пока не выяснена. Возможно, что в отсутствие восстановленного глутатиона лекарственные препараты, подобные памахину, вызывают изменения поверхности эритроцитов, что увеличивает их подверженность деструкции и удалению селезенкой. Эти препараты повышают также скорость образования токсических перекисей, которые в норме элиминируются путем реакции с восстановленным глутатионом.
Недостаточность глюкозо-6-фосфат—дегидрогеназы -довольно распространенное заболевание. Оно наследуется как признак, связанный с полом. У гетерозиготных самок имеются две популяции эритроцитов: одна характеризуется нормальной ферментативной активностью, другая - недостаточностью глюкозо-6-фосфат—дегидрогеназы. В большинстве остальных тканей этот фермент детерминируется другим геном. Наиболее обычная форма недостаточности глюкозо-6-фосфат—дегидрогеназы (тип А), при которой происходит десятикратное снижение активности фермента в эритроцитах, встречается у 11% американцев негритянского происхождения. Такая высокая частота говорит о том, что при определенных условиях окружающей среды эта недостаточность может создавать какие-то преимущества. Действительно, недостаточность глюкозо-6-фосфат—дегидрогеназы в эритроцитах обусловливает, по-видимому, устойчивость к тропической малярии, потому что для оптимального роста возбудителя (Plasmodium falciparum) болезни требуются нормально функционирующий пентозофосфатный путь и восстановленный глутатион. Таким образом, недостаток глюкозо-6-фосфат—дегидрогеназы и признак серповидно- клеточности представляют собою параллельные механизмы защиты от малярии, что и обусловливает высокую частоту соответствующего гена в тех регионах мира, где распространена малярия.
Наличие недостаточности глюкозо-6-фосфат—дегидрогеназы отчетливо указывает на то, что атипичные ответы на лекарственные средства могут иметь генетическую основу. Такая наследуемая недостаточность фермента может быть относительно безвредной, до тех пор, пока не вводятся определенные лекарства. Мы вновь встречаемся здесь с взаимодействием наследственности и окружающей среды при возникновении заболевания. Яркой иллюстрацией такого взаимодействия служат также галактоземия, наследственное отсутствие толерантности к фруктозе, фенилкетонурия и чувствительность к сукцинилхолину.
15.12. Глутатион-редуктаза переносит электроны от NADPH к окисленному глутатиону при участии FAD
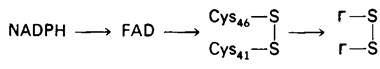
Регенерирование восстановленного глутатиона катализируется глутатион-редуктазой, димером, субъединицы которого имеют мол. массу 50 кДа. Электроны от NADPH не переносятся прямо на дисульфидную связь окисленного глутатиона. Они переносятся от NADPH на прочно связанный флавинадениндинуклеотид (FAD), затем на дисульфидный мостик между двумя остатками цистеина в субъединице и, наконец, на окисленный глутатион.
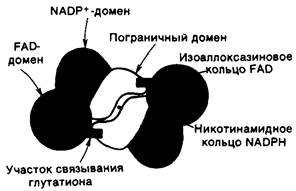
Каждая субъединица состоит из трех структурных доменов: FAD-связывающего домена, NADPH-связывающего домена и пограничного домена (рис. 15.4). Домены, связывающие FAD и NADP+, сходны друг с другом и подобны нуклеотидсвязывающим доменам в других дегидрогеназах. FAD и NADP+ связываются в вытянутой форме, их изоаллоксазиновое и никотинамидное кольца оказываются при этом по соседству друг с другом (рис. 15.4). Интересно отметить, что, место связывания, окисленного глутатиона образуется FAD-связываю- щим доменом одной субъединицы и пограничным доменом другой субъединицы.
Рис. 15.4. Схематическое изображение доменной структуры глутатион-редуктазы. Каждая субъединица этого димерного фермента состоит из NADP+ - домена, FAD-домена и пограничного домена. Глутатион связан с FAD-доменом одной субъединицы и пограничным доменом другой субъединицы
15.13. Глюкоза может синтезироваться из неуглеводных предшественников
Мы перейдем теперь к синтезу глюкозы из неуглеводных предшественников, процессу, называемому глюконеогенезом. Этот метаболический путь имеет очень важное значение, поскольку некоторые ткани, и в частности мозг, в высшей степени зависят от глюкозы как первичного топлива. Дневная потребность мозга взрослого человека
в глюкозе составляет примерно 120 г, т. е. на долю мозга приходится большая часть общей потребности организма в глюкозе (160 г). В жидкостях тела присутствует около 20 г глюкозы, и примерно 190 г глюкозы может быть легко получено из гликогена, ее резервной формы (гл. 16). Таким образом, «прямых» резервов глюкозы вполне достаточно для удовлетворения потребности в ней в течение одного дня. При более длительном голодании для обеспечения жизнеспособности организма глюкоза должна образовываться из неуглеводных источников. Важную роль играет глюконеогенез также в периоды интенсивной физической нагрузки.
Основными неуглеводными предшественниками глюкозы служат лактат, аминокислоты и глицерол. Лактат образуется в работающей скелетной мышце, когда скорость гликолиза превосходит скорость превращений в цикле трикарбоновых кислот и в дыхательной цепи (разд. 12.10). Аминокислоты происходят из белков, поступающих с пищей, а при голодании образуются в результате распада белков скелетных мышц (разд. 23.8). В результате гидролиза триа- цилглицеролов (разд. 17.4) в жировых клетках образуются глицерол и жирные кислоты. Глицерол служит предшественником глюкозы, тогда как жирные кислоты не могут превращаться в организме животных в глюкозу по причинам, которые будут обсуждаться позднее (разд. 17.14). По пути глюконеогенеза происходит превращение пирувата в глюкозу. Включение метаболитов в этот путь происходит в основном на уровне пиру вата, оксалоацетата и дигидрокси- ацетонфосфата.
Главным местом глюконеогенеза служит печень. Этот процесс протекает также в коре почек, но общее количество глюкозы, образующейся в почках, составляет лишь 1/10 такового и печени, что объясняется меньшей массой почечной ткани. Очень незначительный глюконеогенез имеет место в мозгу, а также в скелетной и сердечной мышцах. Скорее всего глюконеогенез в печени и почках обеспечивает такое содержание глюкозы в крови, при котором мозг и мышцы могут извлекать из крови достаточные количества глюкозы для удовлетворения своих метаболических потребностей.